第二章分子结构与性质
课标要求
1.了解共价键的主要类型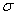 键和
键和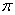 键,能用键长、键能和键角等说明简单分子的某些性质
键,能用键长、键能和键角等说明简单分子的某些性质
2.了解杂化轨道理论及常见的杂化轨道类型(sp、sp2、sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或离子的空间结构。
3.了解简单配合物的成键情况。
4.了解化学键合分子间作用力的区别。
5.了解氢键的存在对物质性质的影响,能列举含氢键的物质。
要点精讲
一.共价键
1.共价键的本质及特征
共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。
2.共价键的类型
①按成键原子间共用电子对的数目分为单键、双键、三键。
②按共用电子对是否偏移分为极性键、非极性键。
③按原子轨道的重叠方式分为σ键和π键,前者的电子云具有轴对称性,后者的电子云具有镜像对称性。
3.键参数
①键能:气态基态原子形成1 mol化学键释放的最低能量,键能越大,化学键越稳定。
②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。
③键角:在原子数超过2的分子中,两个共价键之间的夹角。
④键参数对分子性质的影响
键长越短,键能越大,分子越稳定.

4.等电子原理[来源:学§科§网]
原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。
二.分子的立体构型
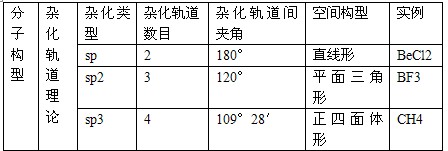
1.分子构型与杂化轨道理论
杂化轨道的要点
当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。
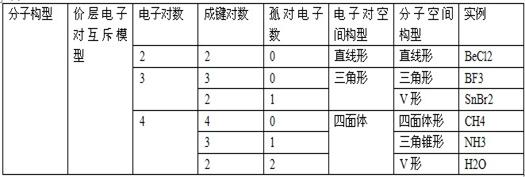
2分子构型与价层电子对互斥模型
价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
(1)当中心原子无孤对电子时,两者的构型一致;
(2)当中心原子有孤对电子时,两者的构型不一致。
3.配位化合物
(1)配位键与极性键、非极性键的比较
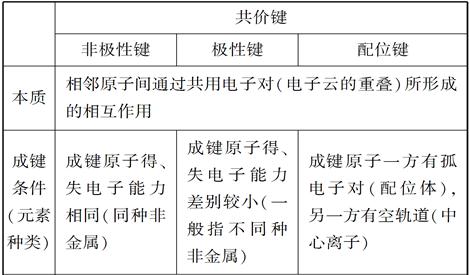

(2)配位化合物
①定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。
②组成:如[Ag(NH3)2]OH,中心离子为Ag+,配体为NH3,配位数为2。
三.分子的性质
1.分子间作用力的比较
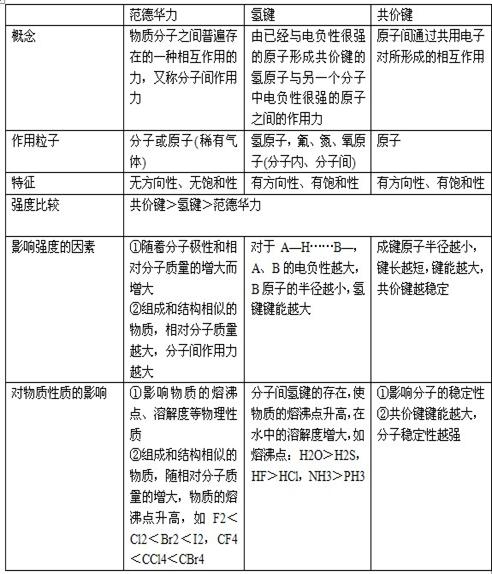
2.分子的极性
(1)极性分子:正电中心和负电中心不重合的分子。
(2)非极性分子:正电中心和负电中心重合的分子。
3.溶解性
(1)“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂.若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
(2)“相似相溶”还适用于分子结构的相似性,如乙醇和水互
溶,而戊醇在水中的溶解度明显减小.
4.手性
具有完全相同的组成和原子排列的一对分子,如左手和右手一样互为镜像,在三维空间里不能重叠的现象。
5.无机含氧酸分子的酸性
无机含氧酸可写成(HO)mROn,如果成酸 元素R相同,则n值越大,R的正电性越高,使R—O—H中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如HClO<HClO2<HClO3<
元素R相同,则n值越大,R的正电性越高,使R—O—H中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如HClO<HClO2<HClO3< HClO4。
HClO4。
第二篇:高中化学新课程化学选修三物质结构与性质第二章分子结构与性质总结
好用的眼霜 如何快速瘦腿 怎么去痘痘
高中化学新课程化学选修三物质结构与性质
第二章分子结构与性质总结
一、分子的结构:
(一)、分子内共价键:
(注意:并非所有的分子内都有共价键,稀有气体是单原子分子)
1、 概念:
2、 形成:原子轨道或电子云的重叠(电子出现在核间的_______增大)
3、 存在:___________、____________、_______________
4、 分类:

单键 C——C
双键 O===C
三键 N≡C
极性键 A——B
非极性键 A——A
按电子对的形成方式 共价键 “——”
配位键 “→”
按电子云的重叠方式 σ键
π键
5、描述—键参数 键能: (一般键长越短、共价键数目越多、键能越大) 键长: (原子半径越小、键长越短、一般键能越大)分子月
稳定)
决定分子的空间构型
键角: 决定分子的立体结构
注意:⑴:σ键与π键的比较与判断:
⑵:熟记:CH4、NH3、H2O、CO2的键角。
⑶:等电子理论:两等两相似。
注意:①、常见等电子体。
②、等电子体中各元素处于同一周期时,电子数也相同。
(二)、解释分子立体构型三大理论
1、价层电子对互斥理论:
(1)、价层电子对包括_________和___________。
BB霜 好用的眼霜 如何快速瘦腿 怎么去痘痘
好用的眼霜 如何快速瘦腿 怎么去痘痘
—
(2)
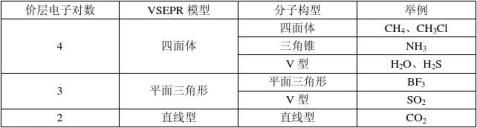
、计算价层电子对数的方法①符合8e稳定结构的分子直接写电子式即可。 ②有机化学写出结构式。
③AB σ键电子对数=____ 孤对电子对数=1/2(a-xb) (注意阴、阳离子中孤电子对的计算) (3)、由于价层电子对的相互排斥,得到含孤电子对的VSEPR模型,略去孤电子对得到分子的立体构型。
价层电子对数 略去孤电子对
分子式 ——————→确定VSEPR模型————————→分子的立体构型 (4)、
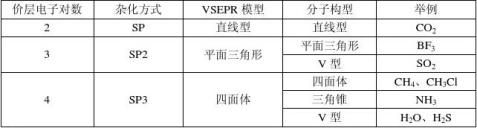
(三)、杂化轨道理论:
(1)可以发生杂化,重新组合成能量相同的杂化轨道,杂化轨道与原轨道数相同,杂化轨道只能容纳σ键电子对和孤电子对(即杂化轨道数等于价层电子对数)未杂化的P轨道可用于形成π键。 |
(3)、写出: —C— 、 C===C、 —C≡C— 、苯环中的C的杂化方式: |
_________、 __________、___________、______________。
(三)、配合物理论简介: (1)、配位键是一个原子提供电子对,两个原子共用形成的共价键。即电子对给予—接受键,用“A—→B”表示,但是配位键与其他共价键性质一样(如:NH4+是正四面体)
BB霜 好用的眼霜 如何快速瘦腿 怎么去痘痘
好用的眼霜 如何快速瘦腿 怎么去痘痘
(2)、配合物的形成与性质
例如:
[ Cu (NH3) 4] (OH) 2
[ Cu (NH3) 4 ]为内界(是离子时又叫配离子,可以带正电,也可以带负电)
其中:
Cu : 称为中心原子,一般为过渡金属原子或离子,要含有空轨道。
NH3:称为配体,一般为分子或离子,要含有孤电子对。
4 :称为配位数,一般为2、4、6、8。
(OH) 2 :为外界(也可以为阳离子,常在内界左边)
在溶液中内、外界可以电离成离子,内界不再电离,四个配体中孤电子对互斥,形成正四面体。
(3)、常见含配位键的物质:
铵根、H3O+、配位物(结晶水合物、含[ Cu (NH3) 4] 2+ 、[ Cu ( H2O ) 4 ] 2+、
[ Ag ( NH3 )2 ] +、[Fe (SCN) ] 2+ 、等的络合物。
BB霜 好用的眼霜 如何快速瘦腿 怎么去痘痘
