无机化学复习题
一、选择题(每题1分,共20分)
( C )1.已知H2和He的相对分子质量分别为2和4。2g H2与2gHe混合后体系的压力为3300kPa,则混合气体中He的分压为:
A、3300 kPa B、2200 kPa C、1100 kPa D、1650 kPa
( C )2.关于氧的相对原子质量下列叙述正确的是:
A、 等于8O16核素一个原子的质量
B、等于氧的平均原子质量
C、等于氧的平均原子质量与碳—12核素质量的 之比值
之比值
D、等于一个氧原子的质量与碳—12核素质量的 之比值
之比值
( D )3.下列关系式中错误的是:
A、H=U+PV B、ΔU(体系)+ ΔU(环境)=0
C、ΔG=ΔH-TΔS D、ΔG(正反应)×ΔG(逆反应)=1
( A )4.反应 2NO2(g)(红棕色)==N2O4(g)(无色) ΔrHm<0 达平衡后,将体系的温度降低,则混合气体颜色:
A、变浅 B、变深 C、不变 D、无法判断
( D )5.反应 C(s)+O2(g)===CO2(g),ΔrHm<0 下列不能使正反应速度增大的措施是:
A、缩小体系的体积 B、升高体系温度
C、增大氧气的分压 D、减小CO2(g)的分压
( A )6.在298K的温度下石墨的标准生成自由能为:
A、等于零 B、大于零 C、小于零 D、无法确定
( C )7.NO(g)+CO(g)=== N2(g)+CO2(g) ΔrHm= -373.4kJ·mol-1,欲使有害气体NO和CO取得最高转化率,则应选择的操作是:
N2(g)+CO2(g) ΔrHm= -373.4kJ·mol-1,欲使有害气体NO和CO取得最高转化率,则应选择的操作是:
A、增大NO浓度 B、增大CO浓度
C、降低温度、增大压力 D、使用高效催化剂
( D )8.对于等温等压下进行的任一反应,下列叙述正确的是:
A、ΔrSm越小反应速度越快 B、ΔrHm越小反应速度越快
C、ΔrGm越小反应速度越快 D、Ea越小反应速度越快
( D )9.下列四个量子数(依次为n,l,m,ms)不合理的一组是:
A、(3、1、0、+ ) B、(4、3、1、-
) B、(4、3、1、- )
)
C、(4、0、0、+ ) D、(2、0、1、-
) D、(2、0、1、- )
)
( B )10.下列四个量子数所描述的电子运动状态中,能量最高的电子是:
A、(4、1、0、+ ) B、(4、2、1、-
) B、(4、2、1、- )
)
C、(4、0、0、+ ) D、(4、1、1、-
) D、(4、1、1、- )
)
( D )11.下列分子中C原子形成共价键时,原子轨道采取SP3杂化的是:
A、CO2 B、CH2=CH2 C、CH≡CH D、CH4
( C )12.二氧化碳和碘分子之间存在的作用力是:
A、取向力 B、诱导力 C、色散力 D、以上三者都存在
( A )13.按照酸碱质子理论,下列既能做质子酸又能做质子碱的是:
A、HCO3- B、NH4+ C、H3O+ D、NO3-
( B )14.下列溶液(浓度均为0.10 mol·L-1)pH值最大的是:
A、NaAc溶液(Ka=1.76×10-5) B、NH3H2O溶液(Kb=1.78×10-5)
C、K2S溶液(K2=7.1×10-15) D、HCN溶液(Ka=4.0×10-10)
( B )15.下列两溶液等体积混合后,具有缓冲能力的是:
A、0.5mol·L-1HCl和0.5mol·L-1NaAc
B、0.1mol·L-1HCl和0.2mol·L-1NaAc
C、0.2mol·L-1HCl和0.1mol·L-1NaAc
D、HCl和NaAc无论浓度体积怎么样变化都不能组成缓冲溶液
( C )16.在难溶电解质BaSO4的饱和溶液中加入下列物质后,BaSO4的溶解度增大的是:
A、Na2SO4 B、BaCl2 C、KNO3 D、H2SO4
( C )17.已知某难溶电解质A2B的KSP=3.2×10-17,则该难溶物的溶解度为:
A、5.6×10-9mol·L-1 B、3.2×10-6mol·L-1
C、2.0×10-6mol·L-1 D、8.9×10-9mol·L-1
( D )18.下列化合物中,正负离子间附加极化作用最强的是:
A、AgF B、AgCl C、AgBr D、AgI
( D )19.下列分子间能形成氢键的是:
A、HF——HI B、H2O——H2Se
C、NH3——H3As D、NH3——H2O
( D )20.在XeF4分子中,中心原子“Xe”的价层电子对数是:
A、3对 B、4对 C、5对 D、6对
二、填空(30分)
1.状态函数的特征是其变化量只决定于始末状态 ,而与变化的
途径 无关。在热(Q)、功(W)、焓(H)和热力学能(U)中, H,U 是状态函数,Q,W 不是状态函数。
2.已知反应 NH4Cl(s)===NH3(g)+HCl(g) 在标准状态下能够自发进行,说明该反应的ΔrGmo <0 ,ΔrSmo >0 。(填写:>0、<0或 =0)。
3.在300K时反应 A(g)+B(g)==C(g) 的速度方程为v=kc(A)c1/2(B)。其反应速度的单位是mol/(L·S);速度常数的单位是(L·mol)1/2·s-1。(浓度的单位用mol·L-1,时间单位用s)
4.已知反应 2A(g) ===2C(g) +B(g) 为一基元反应,A的反应级数为2 ,总反应级数为 2 ,速度方程式为υ=kc、、。
5.可逆反应 2A(g)+B(g)===D(g)+E(g) 达到平衡时,其平衡常数表示式为Kc=P(D)P(E)/P(A)P(A)P(B)P*,Kp与 Kc的关系为Kp=Kc (RT-1)。
6.反应 C(s)+H2O(g)===CO(g)+H2(g),ΔrHmo > 0 达到平衡时,若减小容器的体积,平衡正向 移动,平衡常数 不变 ;若提高体系的温度,平衡 正向 移动,平衡常数增大
7.在配制FeCl3、SnCl2溶液时,通常要加入浓HCL中其目的是为了抑制水解 。
8.溶度积规则是指:当 J=Ksp 达到沉淀溶解平衡,形成饱和溶液;当 J>Ksp 为过饱和溶液,会有沉淀产生;当 J<Ksp 为不饱和溶液,若有沉淀,沉淀会溶解。
9.在NH3H2O溶液中加入一定量的固体NH4Cl,则溶液中的OH-浓度 降低 ,NH3的解离度减小 ,这种现象称为同离子效应 。NH3的解离常数 不变 。
10.30号元素基态原子核外电子排布式为 3d104s2 ,该元素属于第四 周期,IIB族, ds 区。
三、回答问题(20分)
1.为什么Al2(CO3)3不能存在于溶液中?
2.K原子的4s和3d轨道哪一个能级高?H原子呢?为什么?
3.为什么CuS不溶于盐酸,而溶于硝酸?
4.C和Si同为ⅣA族元素,为什么SiO2在常温下是固体且熔点很高,而CO2在常温下却是气体?
四、计算题(30分)(选做3题)
1.在1133K时于一恒容容器中发生如下反应:
3H2(g)+ CO(g)==== CH4(g) + H2O(g)
起始分压(kPa) 203.0 101.0 0 0
平衡时CH4的分压为13.2kPa,求该反应在1133K时的平衡常数Kc及各物质的平衡浓度。?
2.配制1L pH=9.0的缓冲溶液,若缓冲溶液中NH3H2O浓度为0.20mol·L-1,需1.0 mol·L-1的NH3H2O和1.0 mol·L-1 NH4Cl各多少毫升?(Kb=1.78×10-5)
3.已知反应 C(石墨)+O2(g) === CO2(g) ΔrHo=-393.5kJ·mol-1 ,ΔrGo=-394.4kJ·mol-1 ;C(金刚石)+O2(g)===CO2(g) ΔrHo=-391.6kJ·mol-1 ,ΔrGo=-390.5kJ·mol-1 ,So(石墨)=5.74 J·mol-1·K-1 。通过计算说明石墨和金刚石哪一个晶体的晶格有序程度更高。
4.试计算0.10 mol·L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。
(已知Fe(OH)3的KSP=1.1×10-36)
5.将铜片插入盛有0.5 mol·L-1的CuSO4溶液的烧杯中,银片插入盛有0.5 mol·L-1的AgNO3溶液的烧杯中。
(1)写出该原电池的符号; (2)写出电极反应式和原电池的电池反应;
(3)求该电池的电动势; (4)若加氨水于CuSO4溶液中,电池电动势如何变化?若加氨水于AgNO3溶液中,电池电动势又如何变化?(定性回答)
一、选择题
1C2C3D4A5D 6A7C8D9D10B 11D12C13A14B15B 16C17C18D19D20D
二、填空题
1.始末状态,途径, H、U, Q、W; 2.<0,>0; 3.mol/(L·s),(L·mol)1/2s-1; 4.2,2,v=kc·c; 5. ,Kc(RT)-1;
,Kc(RT)-1;
6.正向,不变,正向,增大;7.盐酸溶液,抑制Fe3+、Sn2+水解;8.J=Ksp,J>Ksp,J<Ksp;9.降低,减小,同离子效应,不变;10.1S22S22P63S23P63d104S2,第四,ⅡB族,ds。
三、回答问题
1.∵Al2(CO3)3+3H2O===2Al(OH)3↓+3CO2↑,∴Al2(CO3)3不能存在于溶液中。
2.K原子的E3d>E4s,H原子E3d<E4s 。∵K是多电子原子,电子间存在着相互作用,而发生能级交错现象;在H原子中核外只有一个电子,没有其它电子的作用,能级只与主量子数有关。∴K原子的E3d>E4s,H原子E3d<E4s 。
3.∵KspCuS <Ka1 ∴CuS不溶于HCl,但是HNO3 能与CuS发生氧化还原反应而使CuS溶解。
4.∵ SiO2是原子晶体,熔化时需克服质点间的作用力是共价键;CO2形成的是分子晶体,质点间以微弱的分子间力结合。
四、计算题
1.解: 平衡分压(kPa):P(CH4)=P(H2O)=13.2 P(H2)=203.0-3×13.2=163.4
P(CO)=101.0-13.2=87.8
平衡浓度为: [CH4]=[H2O]= =0.0014mol.L-1
=0.0014mol.L-1
[H2]= 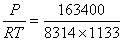 =0.0173mol.L-1,
=0.0173mol.L-1,
[CO]=  =0.0093mol.L-1
=0.0093mol.L-1
Kc= =40.7
=40.7
2.解:pH=9.0,pOH=5.0 即[OH-]=1.0×10-5 V=1000mL
NH3H2O ==== NH + OH- [OH-]=Ka
+ OH- [OH-]=Ka =1.0×10-5
=1.0×10-5
x=1.76×0.2=0.352 mol.L-1
设需要1.0 mol.L-1的NH3H2O V1mL,则需要1.0 mol.L-1的NH4Cl V2 mL
即 1.0×V1=0.2×1000,∴V1=200mL 则需要1.0 mol.L-1的NH4Cl为
1.0×V2=0.352×1000 ∴V1=352mL
3.(1) C(石墨)+O2(g) === CO2(g)
ΔrHo=-393.5kJ·mol-1 ,ΔrGo=-394.4kJ·mol-1 ;
(2) C(金刚石)+O2(g)===CO2(g)
ΔrHo=-395.4kJ·mol-1 ,ΔrGo=-397.3kJ·mol-1 ,
(1)-(2) 得 C(石墨)=== C(金刚石)
ΔrHo =1.9kJ·mol-1 ,ΔrGo=2.9kJ·mol-1
由ΔrGo=ΔrHo-TΔrSo 得:ΔrSo=
ΔrSo=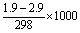 =-3.36 J·mol-1·K-1 。
=-3.36 J·mol-1·K-1 。
而ΔrSo= So(金刚石)- So(石墨)
∴So(金刚石)=ΔrSo+So(石墨)=-3.36+5.73=2.37 J·mol-1·K-1
故金刚石晶体的晶格有序程度更高。
4.[OH-]3[Fe3+]=KSP ∴[OH-]=
(1) Fe3+开始沉淀时[OH-]= =2.2×10-12 pH=2.35
=2.2×10-12 pH=2.35
(2) Fe3+沉淀完全时[OH-]=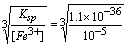 =4.79×10-11 pH=3.68
=4.79×10-11 pH=3.68
5.(1) (+)
(+)
(2)电极反应:
负极 Cu-2e Cu2+
Cu2+
正极 Ag++e Ag
Ag
电池反应 2Ag++ Cu Cu2+ +2Ag
Cu2+ +2Ag
(3)
(4)因为:铜极加氨水,Cu2+ 浓度减小,,因此负极电极电势减小,所以电动势增大。
因为:银极加氨水,Ag+ 浓度减小,因此正极电极电势减小,所以电池电动势减小。
第二篇:无机化学试题【附答案】@厦大

厦门大学“无机化学(一)”课程试卷 化学化工学院化学系、材料系20xx年级
化学、化学生物、化学教育、高分子专业
主考教师:郑兰荪、朱亚先、黄荣斌、林丽榕 试卷类型:(闭卷)
班级 姓名 分数
一、选择题 ( 共13题 17分 )
1. 1 分
下列物质中可以认为具有最大摩尔熵的是………………………………………… ( )
(A) Li(g) (B) Li(s)
(D) Li2CO3(s) (C) LiCl·H2O(s)
2. 2 分
一个气相反应mA(g) + nB(g)qC(g), 达到平衡时……………………………( )
? (A) ?rGm= 0 (B) Qp = 1
(D) 反应物分压和等于产物分压和 (C) Qp =K?
3. 2 分
下列反应均在恒压下进行,若压缩容器体积,增加其总压力,平衡正向移动的是…( )
CaO(s) + CO2(g) (A) CaCO3(s)
2HCl(g) (B) H2(g) + Cl2(g)
2NO2(g) (C) 2NO(g) + O2(g)
CO(g) + Cl2(g) (D) COCl2(g)
4. 2 分
反应 H2(g) + Br2(g)4 mol Br2和5 mol HBr 2HBr(g) 的 Kc = 1.86。若将3 mol H2,3 放在10 dm烧瓶中,则…………………………………………………………………… ( )
(A) 反应将向生成更多的HBr方向进行
(B) 反应向消耗H2的方向进行
(C) 反应已经达到平衡
(D) 反应向生成更多Br2 的方向进行
5. 2 分
试由下列表中数据,确定压力为101 kPa时BCl3的沸点为…………………… ( ) BCl3(l) BCl3(g)
??fHm/ kJ·mol-1 -427.2 -403.76
?Sm/ J·mol-1·K-1 206.27 289.99
(A) 280℃ (B) 7℃ (C) -17℃ (D) -280℃
6. 1 分
? 化学反应Ag(NH3)2 + Br?AgBr? + 2NH3按照路易斯酸碱理论,它应属
于…………………………………………………………………………………………… ( )
(A) 碱取代反应 (B) 置换反应
(C) 酸取代反应 (D) 沉淀反应
7. 1 分
如果一个反应的吉布斯自由能变为零,则反应………………………………………( )
(A) 能自发进行 (B) 是吸热反应
(C) 是放热反应 (D) 处于平衡状态
8. 1 分
? 下列反应中?rSm> 0的是……………………………………………………………( )
(A) 2H2(g) + O2(g) 2H2O(g)
223= (B) N(g) + 3H(g) = 2NH(g)
(C) NHCl(s) = NH(g) + HCl(g)
(D) C(s) + O(g) = CO(g) 4322
9. 1 分
一个体系从一个特定的开始状态到终止状态总是有……………………………… ( )
(A) Q途径1 = Q途径2
(B) W途径1 = W途径2
(C) (Q - W)途径1 = (Q - W)途径2
(D) ΔU = 0,与途径无关
10. 1 分
??F3BNH3中,BF3为…………………………………………( ) 在反应BF3 + NH3?
(A) Arrhenius碱 (B) Br?nsted酸
(C) Lewis碱 (D) Lewis酸
11. 1 分
某体系在失去15 kJ热给环境后,体系的内能增加了5 kJ,则体系对环境所作的功 是…………………………………………………………………………………………… ( )
(A) 20 kJ (B) 10 kJ (C) -10 kJ (D) -20 kJ
12. 1 分
?mol, 298 K下,H2(g) +1当温度升高了100 K,O2(g) H2O(g) ?fHm= -242 kJ·
? 则反应的?rSm值应为…………………………………………………………………… ( )=-1
(A) 比升温前大 (B) 比升温前小
(C) 和升温前近似 (D) 不变
13. 1 分
在HAc水溶液中加入NaAc使HAc电离度降低,在BaSO4饱和溶液中加入Na2SO4使
BaSO4沉淀定量增加,这是由于……………………………………………………………( )
(A) 前者叫同离子效应,后者叫盐析
(B) 前者叫同离子效应,后者叫盐效应
(C) 两者均属同离子效应
(D) 两者均属盐效应
二、填空题 ( 共11题 28分 )
14. 5 分
理想气体向真空膨胀过程中,下列热力学数据W、Q、ΔU、ΔH、ΔS和ΔG中,不为零的是 。
若过程改为液态H2O在100℃、1.013 ??105 Pa下蒸发,上述热力学数据中为零的是 。
15. 5 分
?、Cl? 四种分子和离子中: NH3、Cu2+、HCO3
________________既是Br?nsted酸又是Br?nsted碱;它们的共轭碱是_______________; ________________既是Lewis碱又是Br?nsted碱;________________是Lewis酸而不是Br?nsted酸;________________是Br?nsted酸而不是Lewis酸。
16. 5 分
可逆反应 2A(g) + B(g)?2C(g) ?rHm< 0,反应达到平衡时,容器体积不变,增 加B的分压,则C的分压 __________ ,A的分压 ___________ ;减小容器的体积,B的分压 ___________ ,Kp____________ ;升高温度,则Kp______________ 。
17. 1 分
对于缓冲能力较大的缓冲溶液,它们的pH值主要是由_____________________决定的。
18. 1 分
根据酸碱电子理论判断:在反应SbF5 + BF3
KF + BF3+ SbF6?+BF2?及反应 K+BF4?中BF3所起的作用不同,在前一反应中它是_____________;在后一反应中它是______________。
19. 2 分
化学反应的等压热效应Qp与等容热效应QV的关系,可用下式表示:Qp – QV =ΔnRT。它的应用条件是_______________________________________________________________。
20. 2 分
? 向0.10 mol·dm-3草酸溶液中滴加NaOH溶液使pH = 7.00,溶液中(H2C2O4,HC2O4,
?C2O2
4) ______________浓度最大 。
(H2C2O4 的 Ka1 = 5.9 ? 10-2,Ka2 = 6.4 ? 10-5)
21. 2 分
同离子效应使难溶电解质的溶解度_________________________; 盐效应使难溶电解质的溶解度_____________________________; 后一种效应较前一种效应_____________________________得多。
21. 2 分
下列过程的熵变的正负号分别是 :
? (1) 溶解少量食盐于水中,?rSm是__________号;
?是__________号; (2) 纯碳和氧气反应生成CO(g),?rSm
? (3) 液态水蒸发变成H2O(g),?rSm是____________号;
?CaCO3(s)加热分解CaO(s) 和CO2(g),?rSm (4) 是____________号。
23. 2 分
(1) 0.4 mol·dm-3 HAc溶液的氢离子浓度是0.1 mol·dm-3 HAc溶液的氢离子的浓度的________倍。(已知K(HAc) = 1.8 ? 10-5)
(2) NaHSO3水溶液呈酸性、中性、还是碱性?__________。 (已知 H2SO3的K1 = 1.5 ? 10-2,K2= 1.1 ? 10-7)
24. 1 分
在含有0.10 mol·dm-3 CaCl2的CaF2饱和溶液中,F? 离子浓度是________________。(已知Ksp(CaF2) = 2.7 ? 10-11)
三、计算题 ( 共 5题 45分 )
25. 10 分
?= -123.9 kJ·mol-1,丙烷恒容燃烧 已知298K时,丙烯加H2生成丙烷的反应焓变?rHm
??热 QV = -2213.0 kJ·mol-1,?fHm(CO2, g) = -393.5 kJ·mol-1,?fHm(H2O, l) = -286.0
kJ·mol-1。
计算:(1) 丙烯的燃烧焓;(2) 丙烯的生成焓。
26. 10 分
(1) 在0.10 mol·dm-3 FeCl2中通入H2S至饱和,欲使FeS不沉淀,溶液的pH最高值为多少?
(2)一含有FeCl2和CuCl2的溶液,两者的浓度均为0.10 mol·dm-3,通H2S至饱和是否会生成FeS沉淀?
已知:Ksp(FeS) = 3.7 ? 10-19 ,Ksp(CuS) = 6.0 ? 10-36,
H2S:Ka1 = 5.7 ? 10-8,Ka2 = 1.2 ? 10-15
27. 10 分
N2H4和H2O2的混合物可作为火箭燃料,它们的反应如下:
N2H4(g) + 2H2O2(g) N2(g) + 4H2O(g)
?(1) 若已知N2H4(g) 的?fHm= 95.8 kJ·mol-1;
?= -348.6 kJ·mol, 反应H2(g) + H2O2(g) 2H2O(g) 的?rHm
? 求上述反应的?rHm。 ==-1
(2) 已知?H?H─H = 436 kJ·mol-1,H─O = 465 kJ·mol-1
求H2O2中O─O键的键能。
28. 10 分
在血液中,H2CO3-NaHCO3缓冲对的功能之一是从细胞组织中迅速地除去运动产生的乳酸(HLac:K (HLac) = 8.4 ? 10-4)。
? (1) 已知K1(H2CO3)= 4.3 ? 10,求HLac +HCO3-7H2CO3 + Lac的平衡常数K; -
? (2) 在正常血液中,[H2CO3] = 1.4 ? 10-3 mol·dm-3, [HCO3] = 2.7 ? 10-2mol·dm-3 求
pH值;
(3) 若1.0 dm3血液中加入5.0 ? 10-3 mol HLac后,pH为多少?
29. 5 分
今有1.0 dm3 0.10 mol·dm-3氨水,问:
(1) 氨水的[H+]是多少 ?
(2) 加入5.35 g NH4Cl后,溶液的[H+] 是多少?(忽略加入NH4Cl后溶液体积的变化)
(3) 加入NH4Cl前后氨水的电离度各为多少?(NH3 :Kb=1.8 ? 10-5)
(原子量:Cl 35.5, N 14)
四、问答题 ( 共 2题 10分 )
30. 5 分
?= -287.0 kJ·mol-1 白磷是热力学规定的稳定单质,PCl3(g) ?fHm
?H=
2P(s, 红)+ 3Cl(g) = 2PCl(g) ?H
2P(s, 红)+ 3Cl(g) = 2PCl(l) ?H(3) 2P(s, 白)+ 3Cl2(g) 2PCl3(g) 2233rrr?
m?m(1) ?m(2)
?(1)是多少? 反应(1)随温度升高K?加大还是减小? 问哪个反应的反应热最大? ?rHm
31. 5 分
100 g铁粉在25℃溶于盐酸生成氯化亚铁(FeCl2),
(1) 这个反应在烧杯中发生;(2) 这个反应在密闭贮瓶中发生;两种情况相比, 哪个放热较多? 简述理由。
2004级“无机化学(一)”期中考试
参 考 答 案
一、选择题 ( 共13题 17分 )
1. 1 分
(A)
2. 2 分
(C)
3. 2 分
(C)
4. 2 分
(D)
5. 2 分
(B)
6. 1 分
(A)
7. 1 分
(D)
8. 1 分
(C)
9. 1 分
(C)
10. 1 分
(D)
11. 1 分
(D)
12. 1 分
(C)
13. 1 分
(C)
二、填空题 ( 共11题 28分 )
14. 5 分
ΔS、ΔG, ΔG
15. 5 分
???,NH3;CO2 HCO33,NH2
? HCO3,NH3,Cl?
Cu,
? NH3,HCO3 2+
16. 5 分 增大, 减小, 增大, 不变, 减小 。
17. 1 分 共轭酸的电离常数
18. 1 分
碱;酸。
19. 2 分
理想气体;只做膨胀功
20. 2 分
? C2O2
4
21. 2 分
减小,增大,小
22. 2 分
(1) +;(2) +;(3) +;(4) +
23. 2 分
(1) 2倍;(2) 酸性
24. 1 分
-6-3 8.2 ? 10mol·dm
三、计算题 ( 共 5题 45分 )
25. 10 分
? ① C3H6(g) + 2O2(g) 3CO2(g) + 3H2O(l) ?rHm1 = 丙烷燃烧热 =
② H2(g) +2O2(g) H2O(l) = -1?(H2O, l) = -286.0 kJ·mol ?rHm
-1Qv = -2213.0 kJ·mol ③ C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
36238-1?= -123.9 kJ·mol ?rHm= ④ CH(g) + H(g) = CH(g)
④ + ③ - ② = ①
???? 所以 ?rHm(1) =?rHm(4) +?rHm(3) –?rHm(2)
? 因为 ?rHm(3) =ΔU +Δ(pV) = -2213.0 + (-2.5) (8.314 ? 298 ? 10) = -2219.2 -1(kJ·mol) -3
? 所以 ?rHm(1) = -123.9 - 2219.2 - (-286.0) = -2057.1 (kJ·mol)
-1 即: C3H6(g) 的燃烧焓为 -2057.1 kJ·mol -1
???? 而?rHm(1) = 3?fHm(H2O, l) + 3?fHm(CO2, g) –?fHm(C3H6, g)
? 所以 -2057.1 = 3(-286.0) + 3(-393.5) –?fHm(C3H6, g)
? ?fHm(C3H6, g) = -18.6 kJ·mol -1
26. 10 分
2-19 -18-3 (1) [S?] = 3.7 ? 10/ 0.10 = 3.7 ? 10 (mol·dm)
[H] =+K1K2?[H2S]
3.7?10?18= 1.4 ? 10 (mol·dm) pH = 2.85
+-3-3-3 (2) CuS先生成沉淀,溶液中 [H] = 0.10 ? 2 = 0.20 (mol·dm)
6.8?10?24-22-3 c (S) == 1.7 ? 10 (mol·dm) 20.202? c(Fe) c(S?) = 0.10 ? 1.7 ? 10 =1.7 ? 10 < 3.7 ? 10 所以不生成 FeS?。
27. 10 分 2+2-22-23-19
?H= 95.8 kJ·mol ① =
H(g) + HO(g) = 2HO(g) ?H= -348.6 kJ·mol ② 2 ? ② - ①:NH(g) + 2HO(g) = N(g) + 4HO(g) (1) N2(g) + 2H2(g) N2H4(g) 2222r?m-1r?m-1242222
? ?rHm= 2 ? (-348.6) - 95.8 = -793 (kJ·mol) -1
?= -348.6 kJ·mol (2) H2(g) + H2O2(g) 2H2O(g) ?rHm-1=
??rHm= -[4?H?O—H -?H?H—H -2?H?O—H -?H?O—O] = -348.6 (kJ·mol ) -1?H?O—O = -348.6 + 2 ? 465 - 436 = 145 (kJ·mol) -1
28. 10 分
[H2CO3][Lac?][H?]K(HLac) 8.4?10?43 = 2.0 ? 10 (1) K =??????7[HLac][HCO3][H]K1(H2CO3)4.3?10
ca14.?10?3
= 6.37 - (-1.28) = 7.65 (2) pH = pK1 - lg= 6.37 - lg?2cs2.7?10
ca(14.?50.)?10?3
(3) pH = pK1- lg= 6.37 - lg= 6.37 - (-0.54) = 6.91 cs(2.7?0.5)?10?2
29. 5 分
? HSO4-3?H +SO24 K2 = 1.26 ? 10 +-2 平衡浓度/ mol·dm 0.10 - x x x x2
-2= 1.26 ? 10 010.?x
[H] = x = 3.0 ? 10 mol·dm
-2 pH = -lg 3.0 ? 10 = 1.52 +-2-3
Kw10.?10?14
-13?= 7.9 ? 10 故水解可忽略 Kh =?2K2126.?10
四、问答题 ( 共 2题 10分 )
30. 5 分
???? 因为?rHm(2) > ?rHm(1) ?rHm(2) > ?rHm(3) ?(2)最大 所以?rHm
??(1) = ?fHm = -287.0 kJ·mol-1 ?rHm
反应(1)随温度升高,K?减小。
31. 5 分
Qp = QV +ΔnRT ,第(1)种情况放热量为Qp,第(2)种情况为QV ,因为变化过程有气体产生,Δn为正值。所以情况(2)放热多于(1)。

厦门大学“无机化学(一)”课程试卷
化学化工学院化学系、材料系20xx年级
化学、化学生物、化学教育、高分子专业 试卷类型:(A卷、闭卷) 考试时间:2小时
(注意:试卷纸必须与答题纸同时上缴!)
班级 姓名 分数
一、选择题 ( 共14题 28分 )
1. 下列原子轨道的n相同,且各有1个自旋方向相反的不成对电子,则x轴方向可形成? 键的是………………………………………………………………………………………… ( )
(B) px- py (C) py- pz (D) pz- pz (A) px- px
2. 电池Cu│Cu+‖Cu+,Cu2+│Pt和电池Cu│Cu2+‖Cu2+,Cu+│Pt的反应均可写成 Cu + Cu2+ = 2Cu,此两电池的……………………………………………………………( ) +
?(B) ?rGm相同,E?不同
?(D) ?rGm,E?均不同 ? (A) ?rGm,E?均相同 ? (C) ?rGm不同,E?相同
3. 关于下列元素第一电离能的大小的判断,正确的是…………………………………( )
(A) N > O (B) C > N (C) B > C (D) B > Be
4. 对于下面两个反应方程式,说法完全正确的是…………………………………… ( ) 2Fe + Sn Fe + 3+13+2+2+Sn + 2Fe 4+2+1Sn + Fe
?,KC都相等 E?,?rGm4+2+Sn (A) 两式的
? (B) 两式的E?,?rGm,KC不等
? (C) 两式的?rGm相等,E?,KC不等
? (D) 两式的E?相等,?rGm,KC不等
5. M3+ ──── M+ ──── M 则??(M3+/M) 为……………………………( )
(A) 0.00 V
0.30 V -0.60 V (B) 0.10 V
?(C) 0.30 V (D) 0.90 V 6. 在H原子中,对r = 0.53A(10-8cm) 处的正确描述是………………………………( )
(A) 该处1s电子云最大 (B) r是1s径向分布函数的平均值
(C) 该处为H原子Bohr半径 (D) 该处是1s电子云界面
7. 不用惰性电极的电池反应是………………………………………………………… ( )
(A) H2 + Cl2???2HCl(aq)
1
(B) Ce4+ + Fe2+???Ce3+ + Fe3+
(C) Ag+ + Cl????AgCl(s)
(D) 2Hg2+ + Sn2+ + 2Cl????Hg2Cl2 + Sn4+
8. 下列元素原子半径的排列顺序正确的是…………………………………………… ( )
(A) Mg > B > Si > Ar (B) Ar > Mg > Si > B
(C)Si>Mg>B>Ar(D)B>Mg>Ar>Si
9. 两个半电池,电极相同,电解质溶液中的物质也相同,都可以进行电极反应,但溶液的浓度不同,它们组成电池的电动势…………………………………………………………( )
(A)E?= 0,E = 0
(C)E?≠0,E = 0 (B)E?≠0, E ≠0 (D)E?= 0, E ≠0
10. 下面氧化还原电对的电极电势不随酸度变化的是………………………………… ( )
? (A) NO3? HNO2 ?(B) SO24? H2SO3
2?(D) MnO?4? MnO4 (C) Fe(OH)3 ? Fe(OH)2
11. 核外某电子的主量子数n = 4,它的角量子数l可能的取值有………………………( )
(A) 1个 (B) 2个 (C) 3个 (D) 4个
p2H2O来说,当O2= 100 kPa时,酸度对电极电势影响的关系式12. 对于电极反应O2 + 4H+ + 4e??
是…………………………………………………………………………… ( )
? =??+ 0.0592 pH (A)
? =??- 0.0592 pH (B)
?? =?+ 0.0148 pH (C)
? =??- 0.0148 pH (D)
13. 已知 M1+ 2e?
3?+ e? M14?+ e? M12?M1 ?= -2.0 V; 2? M1 ??= -1.0 V; ?M2+ e???M22+ e???= 0.5 V M2 ?M?2 ?= 1.0 V ?3???? M1 ??= 0.5 V; M3M22+ e2 ?= 1.9 V
下列情况中,不可能反应的是………………………………………………………………( )
(A) M1 投入水中
2? (B) M1离子加到水中
3?1 mol M1离子加到1 dm3的1 mol·dm-3 M? (C) 2离子溶液中
?? (D) M32离子加到含M2离子的溶液中去
14. 以分子间作用力结合的晶体是……………………………………………………… ( )
CuAl2(s) (D) SiC(s) (A) KBr(s) (B) CO2(s) (C)
二、填空题 ( 共11题 32分 )
15. 写出具有下列基态电子组态的元素的符号和名称,所处的周期及族:
1s22s22p63s23p4 ;
2
1s22s22p63s23p63d84s2 ;
[Ar]3d104s2
16. Na原子核最外层电子的四个量子数n, l, m, ms依次为
?、O2、B2、NO?的未成对电子数目和键级分别17. 利用分子轨道能级图确定O2
为 、 、 、 。
18. 按离子极化大小排列 FeCl3,FeCl2,KCl,CaCl2____________________________;
19. 2 分
有A、B、C、D四种金属,将A、B用导线连接后浸入稀H2SO4中,A上放出氢气,B逐渐溶解生成B2+;在电解含A2+和C2+的混合溶液时,阴极上先析出C;将D放入含B2+
的硝酸溶液中,D表面有B析出,同时生成D2+。则这四种金属阳离子的氧化性由强到弱的顺序是 。
20. 6 分
将Ni + 2Ag+ = 2Ag + Ni2+ 氧化还原反应设计为一个原电池。则电池的负极为
__________________________,正极为______________________________,
原电池符号为________________________________________________________。
已知??(Ni2+ / Ni) = -0.25 V,??(Ag+ / Ag) = 0.80 V,则原电池的电动势E?为
?为______________,该氧化还原反应的平衡常数为________________。 ___________,?rGm
21. 2 分
在NH3,H2O,H2S,HCl和HF中,氢键最强的是_____________________。
22. 2 分
Cl的第一电离能小于F的原因是。
23. 2 分 将氢原子核外的1s电子激发到2s或2p, 前者所需能量________后者所需能量;若将氦原子核外一个1s电子激发到2s或2p时,前者所需能量______后者所需能量。
24. 2 分 (7021)
7021
NH3分子键角?H—N—H、CH4分子键角?H—C—H、H2O分子键角?H—O—H,按键角增加的顺序是______________________________________________________________。
25. 2 分
比较下列各对元素电负性的大小(用 < 或 > 表示):
3
三、计算题 ( 共 2题 20分 )
26. 10 分 298K时,在Ag+/Ag电极中加入过量I?,设达到平衡时[I?] = 0.10 mol·dm-3,而另一个电极为
Cu2+/Cu,[Cu2+] = 0.010 mol·dm-3,现将两电极组成原电池,写出原电池的符号、电池反应式、并计算电池反应的平衡常数。
??(Ag+/Ag) = 0.80 V,??(Cu2+/Cu) = 0.34 V,Ksp(AgI) = 1.0 ? 10-18
27. 10 分
根据已知的下列数据,计算氯化钡的晶格能。
?
氯化钡的?fHm -860.2 kJ·mol-1
氯分子的离解焓 238.5 kJ·mol-1 钡的升华焓 192.5 kJ·mol-1 钡的第一电离能 501.2 kJ·mol-1 钡的第二电离能 962.3 kJ·mol-1 氯的电子亲合能 -364 kJ·mol-1
四、问答题 ( 共 2题 20分 )
28. 10 分 请填空回答:
2334
中心原子杂化轨道 (注明等性或不等性) 中心原子价层电子对构
分子空间构型
/
分子有无极性有无大Π键,如有写出大Π键的个数及类型
29. (10分)比较并说明下列各组物质的熔沸点高低
(1)CaCl2 和 ZnCl2 (2)AgCl 和AgI (3)PCl3 和 PCl5 (4)NH3和PH3 (5)NaF 和MgO
4
2004级“无机化学(一)”期末考试
参 考 答 案
一、选择题 ( 共14题 27分 )
1. (D)
2. (B)
3. (A)
4. (D)
5. (A)
6. (C)
7. (C)
8. (B)
9. (D)
10. (D)
11. (D)
12. (B)
13. (C)
14. (B)
二、填空题 ( 共11题 31分 )
15. S硫,第三周期、ⅥA
Ni镍,第四周期、Ⅷ
Zn锌,第四周期、ⅡB
16. 5 分 3, 0, 0,2(或?2 )
17. 2 分 1,1.5 2,2 无,1, 2,2
18. 2 分 FeCl3>FeCl2 >CaCl2>KCl
19. 2 分 C2+ > A2+ > B2+ > D2+
20. 5 分 镍电极,银电极。
(-) Ni(s)│Ni2+(c+
1)‖Ag(c2)│Ag(s) (+)
0.80 - (-0.25) = 1.05 (V)
-203 kJ·mol-1
3.41 ? 1035
1
21. 2 分 HF
22. 2 分 同族自上而下原子半径增大,第一电离能通常减小。
23. 2 分 等于, 小于。
24. 2 分 ?H—O—H < ?H—N—H < ?H—C—H
25. 2 分 O > N Cu < CuO > S B > Al
+
2+
三、计算题 ( 共 2题 20分 )
26. 10 分
2+
?(Cu/Cu) = 0.34 + (0.0591/2) lg(0.010) = 0.28 (V) ?(AgI/Ag) = 0.80 + (0.0591/1) lg(Ksp / [I?])
-18
= 0.80 + 0.0591 lg(1.0 ? 10/ 0.10) = -0.20 (V) 所以原电池符号:
-32+-3
Ag, AgI(s)│I?(0.10 mol·dm)‖Cu(0.010 mol·dm)│Cu(s) 电池反应式: 2Ag + Cu+ 2I?
+
2+
= 2AgI + Cu
-18
??(AgI/Ag) =??(Ag/Ag) + 0.0591 lg Ksp(AgI) = 0.80 + 0.059 lg(1.0 ? 10) = -0.26 (V) E?=??(Cu/Cu) –??(AgI/Ag) = 0.34 - (-0.26) = 0.60 (V)
2+
lgK? =zE?/ 0.0591 = 2 ? 0.60 / 0.0591 = 20.34 所以平衡常数 K?= 2.2 ? 10
20
27. 10 分
-860.2
Ba(s) + Cl2(g) ───────→BaCl2(s) 192.5↓ ↓238.5 Ba(g) 2Cl(g) U 501.2 + 962.3↓ ↓-364 ? 2
2+- Ba(g) + 2Cl(g) ────────
U = -860.2 - 192.5 - 238.5 - 1463.5 + 728 = -2027 (kJ·mol-1)
-1
U = 2027 kJ·mol
四、问答题 ( 共 1题 10分 )
28. 10 分
中心原子杂化轨道 (注明等性或不等性) 中心原子价层电子对构
CO2 sp 等性 直线性
ICl3 spd 不等性 三角双锥
3
NO3 sp等性 平面三角形
2
-
PH4 sp等性 正四面体
3
+
2
分子空间构型
分子有无极性
有无大Π键,如有写出
大Π键的个数及类型
直线性 无 2个Π3 4T型 有 无 平面三角形 / Π4 6正四面体 / 无
29.(10分)比较并说明下列各组物质的熔沸点高低
(1) CaCl2 > ZnCl2 由于锌离子极化能力比较大,ZnCl2 共价能力强,熔沸点降低。
(2) AgCl >AgI 由于碘离子变形性比较大,AgI共价能力强,熔沸点降低。
(3) PCl3 < PCl5 由于PCl5分子量较大,色散力较大,熔沸点较高。
(4) NH3>PH3 由于NH3分子中存在氢键,熔沸点较高。
(5) NaF < MgO 由于MgO 的晶格能较大,熔沸点较高。
3

厦门大学“无机化学(二)”课程试卷
化学化工学院化学、材料系20xx年级化学各专业
试卷类型:(A卷) 班级 姓名 分数
一、选择题 ( 共18题 35分 )
1. 2 分
InCl2为逆磁性化合物,其中In的化合价为…………………………………………( )
(A) +1 (B) +2 (C) +3 (D) +1和+3
2. 2 分
下列氢化物中,在室温下与水反应不产生氢气的是…………………………………( )
(B) CaH2 (C) SiH4 (D) NH3 (A) LiAlH4
3. 2 分
和水反应得不到H2O2的是……………………………………………………………( )
(B) Na2O2 (C) KO2 (D) KO3 (A) K2O2
4. 2 分
下列物质的水解产物中既有酸又有碱的是………………………………………… ( )
(B) SbCl5 (C) POCl3 (D) NCl3 (A) Mg3N2
5. 2 分
有关H3PO4、H3PO3、H3PO2不正确的论述是…………………………………( )
(A) 氧化态分别是+5,+3,+1 (B) P原子是四面体几何构型的中心
(C) 三种酸在水中的离解度相近 (D) 都是三元酸
6. 2 分
下列各组化合物中,都有颜色的一组化合物是…………………………………… ( )
(A) SiCl4,SnCl4,PbO
(B) CCl4,NO2,HgI2
(C) SiC,B2H6,N2O4
(D) PbO2,PbI2,SnS
7. 2 分
下列化合物中最稳定的是…………………………………………………………… ( )
(B) Na2O2 (C) K2O2 (D) Rb2O2 (A) Li2O2
8. 2 分
1 mol 下列各物质溶于1 dm3水中,生成的溶液 中H+ 浓度最高的是……………( )
(B) P4O10 (C) HF (D) MgH2 (A) SO3
1
9. 2 分
对于H2O2和N2H4,下列叙述正确的是………………………………………………( ) (A) 都是二元弱酸 (B) 都是二元弱碱 (C) 都具有氧化性和还原性 (D) 都可与氧气作用
10. 2 分
下列分子式中错误的是……………………………………………………………… ( )
(A) SF2
(B) SF3 (C) SF4 (D) SOF4
11. 2 分
O2?
2可作为…………………………………………………………………………… ( (A) 配体 (B) 氧化剂 (C) 还原剂 (D) 三者皆可
12. 2 分
下列含氧酸根中,属于环状结构的是……………………………………………… ( (A) S?4O26 (B) S2?O3?5?
3O10 (C) P39
(D) P3O10
13. 2 分
BF3通入过量的Na2CO3溶液,得到的产物是………………………………………( (A) HF和H3BO3
(B) HBF4和B(OH)3 (C) NaBF4和NaB(OH)4
(D) HF和B4O3
14. 2 分
下列含氧酸中酸性最弱的是………………………………………………………… ( (A) HClO3
(B) HBrO3 (C) H2SeO4 (D) H6TeO6
15. 2 分
下列各组物质氧化性变化次序不正确的是………………………………………… ( (A) HNO3 > H3PO4 > H3AsO4 (B) HBrO3 > HClO3 > HIO3 (C) H2SeO4 > H6TeO6> H2SO4 (D) HClO4 > H2SO4 > H3PO4
16. 2 分
锌粉与酸式亚硫酸钠反应生成……………………………………………………… ( (A) Na2S2O4
(B) Na2S2O3 (C) Na2SO3 (D) Na2SO4
17. 2 分
用于制备K2S2O8的方法是……………………………………………………………( (A) 在过量的硫酸存在下,用高锰酸钾使K2SO4氧化 (B) 在K+ 离子存在下,往发烟硫酸中通入空气
(C) 在K+ 离子存在下,电解使硫酸发生阳极氧化作用 (D) 用氯气氧化硫代硫酸钾K2S2O3
2
)
)
)
)
) )
)
18. 1 分
鉴别Sn4+和Sn2+离子,应加的试剂为…………………………………………………( )
(A) 盐酸 (B) 硝酸 (C) 硫酸钠 (D) 硫化钠(过量)
二、填空题 ( 共8题 25分 )
19. 5 分
比较下列各物质的性质:
(1) BeCl2和CaCl2的沸点,前者______________后者;
(2) NH3和PH3的碱性,前者______________后者;
(3) NaOCl和NaClO3的氧化性,前者______________后者;
(4) BaCrO4和CaCrO4在水中的溶解度,前者______________后者;
(5) TlCl和TlCl3的水解度,前者______________后者。
20. 5 分
把下列氯化物分别置于纯水中,(1) 能生成盐酸和碱式盐沉淀的是________________,(2) 能生成盐酸和相应的含氧酸的是__________________,(3) 能生成盐酸和氧化物的水合物的是_________________。 NaCl,KCl,MgCl2,AlCl3,SnCl2,SbCl3,SnCl4,ZnCl2,SCl4,PCl5,BaCl2。
21. 5 分
在砷分族的氢氧化物(包括含氧酸盐)中酸性以_____________为最强,碱性__________最强,以____________的还原性最强,以____________的氧化性最强,这说明从砷锑到铋氧化数为________的化合物渐趋稳定。
22. 2 分
① Bi ② Sn ③ Se ④ F2
上述单质与NaOH溶液反应属于:
(1) 很难发生反应的是____________________;
(2) 发生歧化反应的是____________________;
(3) 有氢气生成的是______________________;
(4) 在一定条件下,有氧气放出的是________。
23. 2 分
在AlCl3和SbCl3溶液中各加入适量Na2S溶液,将分别产生__________和_________沉淀,使后者与过量的Na2S溶液作用,将生成___________而溶解。
24. 2 分
在Sn(II)的强碱溶液中加入硝酸铋溶液,发生变化的化学方程式为:
3
________________________________________________________________。
25. 2 分
H3BO3是极弱的一元酸,在定量分析中不能直接用强碱滴定,如果加一定量的_____________________,生成________________________________后,因酸性大为增强,则就可滴定了。
26. 2 分
TlCl3与H2S以及Tl和稀HNO3的反应式分别为________________________________和_______________________________。
三、计算题 ( 共 2题 15分 )
27. 10 分
在酸性溶液中,KBrO3能把KI氧化成I2和KIO3,本身可被还原为Br2、Br-;而KIO3和KBr反应生成I2和Br2,KIO3和KI反应生成I2。现于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质的量的比是多少?
28. 5 分
高纯锡可在600 K温度下炼铸,这时反应 Sn(l) + O2(g) SnO2(s)
-1-6?= - 418.4 kJ·mol。炼铸时常用氩作为保护气体,然而其中常包含分压力为1.0 ? 10 标准压力的?rGm
(p?=100kPa)的氧。 试回答在此环境中锡是否会受到氧化?
四、问答题 ( 共 5题 25分 )
29. 3 分
?比较BH?
4和AlH4的碱性。哪一个离子是较强的还原剂?
?3写出GaH?
4与过量HCl(c = 1 mol·dm )反应的方程式。
30. 5 分
写出下列物质的名称或化学式:
(1) BaO4,(2) HN3,(3) H2NOH,(4) H2SO4·SO3,(5) KH2PO2,
(6) 芒硝,(7) 海波,(8) 保险粉,(9) 联膦,(10) 正高碘酸
31. 10 分
氮、磷、铋都是VA族元素,它们都可以形成氯化物,例如:NCl3、PCl3、PCl5和BiCl3。试问:
(1) 为什么不存在NCl5及BiCl5而有PCl5?
(2) 请你对比 NCl3、PCl3、BiCl3水解反应的差异(指水解机理及水解物性质上差异)。写出有关反应方程式。
32. 8 分
石硫合剂是以硫黄粉、石灰及水混合,煮沸、摇匀而制得的橙色至樱桃红色透明水溶液,写出相应的反应方程式。该溶液在空气的作用下又会发生什么反应?
=
4
2004级“无机化学(二)期中考试
参 考 答 案
一、选择题 ( 共18题 36分 )
1. 2 分 (D)
2. 2 分 (D)
3. 2 分 (D)
4. 2 分 (D)
5. 2 分 (D)
6. 2 分 (D)
7. 2 分 (D)
8. 2 分 (A)
9. 2 分 (C)
10. 2 分 (B)
11. 2 分 (D)
12. 2 分 (C)
13. 2 分 (C)
14. 2 分 (D)
15. 2 分 (A)
16. 2 分 (A)
17. 2 分 (C)
18. 2 分 (D)
二、填空题 ( 共 8题 25分 )
19. 5 分 (1) 低于 (2) 强于 (3) 强于 (4) 小于 (5) 小于
20. 5 分 (1) SnCl2,SbCl3
(2) SCl4,PCl5
(3) SnCl4
21. 5 分 H3AsO4 Bi(OH)3
Na3AsO3 NaBiO3 +3
22. 2 分 (1) ① (2) ③ (3) ② (4) ④
23. 2 分 Al(OH)3?(白) Sb2S3?(橙) Na3SbS3
24. 2 分 3Sn(OH)? + 2Bi + 9OH= 32?
33+? Sn(OH)6 + 2Bi?
黑
25. 2 分
甘油或甘露醇(己六醇)
2OOCH2
配合物 HHOCHCHOH
22
26. 2 分
1
2TlCl3 + 3H2S Tl2S? + 2S? + 6HCl
3Tl + 4HNO3(稀) 3TlNO3 + NO? + 2H2O
三、计算题 ( 共 2题 15分 )
27. 10 分 6KBrO3 + 5KI + 3H2SO4 3Br2 + 5KIO3 + 3K2SO4 + 3H2O 6 mol 5 mol 3 mol 5 mol
所余1 mol KI将和(1/5) mol KIO3作用生成(3/5) mol I2
KIO3 + 5KI + 3H2SO4 3I2 + 3K2SO4 + 3H2O
1/5 mol 1 mol 3/5 mol
生成Br2、I2、KIO3,其物质的量比为3 : 3/5 : 24/5。
?28. 5 分 用式Δr G m =?rGm+ RT ln (1/pO2) = -349.4 kJ·mol,表明锡在氩中能被氧化。 -1====
四、问答题 ( 共 3题 20分 )
29. 5 分
???碱性BH4<<AlH4,AlH4是较强的还原剂;
??GaH4+ 4HCl???GaCl4+ 4H2
30. 5 分 (1) 超氧化钡 (2) 叠氮化氢或叠氮酸
(3) 羟氨 (4) 焦硫酸或一缩二硫酸
(5) 次磷酸钾 (6) Na2SO4·10H2O
(7) Na2S2O3·5H2O (8) Na2S2O4·2H2O
(10) H5IO6 (9) P2H4
31. 10 分 氮为第二周期元素,只有2s、2p轨道,最大配位数为4。故只能形成NCl3不可能有NCl5。
33 (1)磷为第三周期元素,有3s、3p、3d轨道,既可以sp杂化轨道成键,也可以以spd杂化轨道成键,
最大配位数为6。故除可以形成PCl3外,还可以形成PCl5。
2 铋为第六周期元素,由于存在6s惰性电子对效应,Bi(V)有强氧化性,Cl又有还原性,所以BiCl5不会
形成。
(2) NCl3 + 3H2O NH3 + 3HClO
NCl3中N上孤对作Lewis碱配出,发生亲电水解,产物为NH3(碱)及HClO(酸)。 =
PCl3 + H2O =HOHOH+ 3HCl
PCl3中P有孤对电子,又有空轨道,所以可以发生亲电亲核水解。
BiCl3 + H2O BiOCl? + 2HCl,水解产物是生成更难溶的盐及酸,其机理可以认为是酸碱电离平衡。
32. 5 分 4Li + O2 2 Li2O
Li + 2H2O LiOH + H2? ===
2
6Li + N2 2Li3N
Li2O + CO2 Li2CO3
2LiOH + CO2 2CO3 + H2O CO2 3)2
33. 5 分 3S + 3Ca(OH)2 2CaS + CaSO3 + 3H2O (x-1)S + CaS CaSx(橙色),随x升高显樱桃红色。 S + CaSO3 CaS2O3
所以 石硫合剂是CaSx·CaS2O3和Ca(OH)2的混合物。 由于石硫合剂在空气中与H2O及CO2作用,发生以下反应: CaSx + H2O + CO2 CaCO3 + H2Sx H2Sx H2S? + (x-1)S? ========
3

厦门大学“无机化学(二)”课程试卷 化学化工学院化学系、材料系20xx年级化学各专业 试卷类型:(闭卷、A卷) 考试时间:1小时
班级 姓名 分数
一、选择题 ( 共 9题 17分 )
1. 1 分
在下列化合物中,属杂多酸盐的是……………………………………………………( )
(B) KCr(SO4)2·12H2O (A) Na3[P(W12O40)]
(C) Na4Mo7O23 (D) Fe2(CO)9
2. 2 分
下列方法中可得到产率高、质量好的是………………( ) 欲将K2MnO4转变为KMnO4,
(A) CO2通入碱性K2MnO4溶液 (B) 用Cl2氧化K2MnO4溶液
(C) 电解氧化K2MnO4溶液 (D) 用HAc酸化K2MnO4
3. 2 分
下列物质不能大量在溶液中共存的是…………………………………………………( )
-? (A)Fe(CN)36和OH
4- (C)Fe(CN)6和I2 -?(B)Fe(CN)36和I (D) Fe3+ 和Br?
4. 2 分
下列离子中氧化性最强的是……………………………………………………………( )
? (A) CoF36
?Co(CN)3 (C) 6 ?(B) Co(NH3)33 (D) Co3+
5. 2 分
某金属离子在八面体弱场中的磁矩是4.90 B.M.,而在八面体强场中的磁矩为0,该中心金属离子可能是……………………………………………………………………………( )
(A) Cr(III) (B) Mn(II) (C) Mn(III) (D) Fe(II)
6. 2 分
弱场中,八面体和四面体配合物的 CFSE 相等的是…………………………………( ) 2+2+2+2+ (A) Fe (B) Ni (C) Mn (D) Cu
7. 2 分
在[Co(en)(C2O4)2]配离子中,中心离子的配位数为…………………………………( )
(A) 3 (B) 4 (C) 5 (D) 6
8. 2 分
[Fe(H2O)6]2+的晶体场稳定化能(CFSE)是……………………………………………( )
(A) -4 Dq (B) -12 Dq (C) -6 Dq (D) -8 Dq
9. 2 分
根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋或低自旋的电子构型是…………………………………………………………………………………… ( )
(A) d2 (B) d3 (C) d4 (D) d8
二、填空题 ( 共 4题 13分 )
10. 4 分
K2Cr207溶液分别与BaCl2、KOH、浓HCl(加热)和H2O2(乙醚)作用,将分别转变为_______________,______________,_____________,_____________ 。
11. 2 分
在NiSO4和CoSO4溶液中各加入过量KCN溶液,将分别生成__________和__________;将后者溶液放置或微热渐渐转化而成__________。
12. 2 分
配合物[Cr(OH)(C2O4)(en)(H2O)]的系统命名法名称为 ___________________________。
13. 5 分
配离子 几何构型 化轨道类型
4?Fe(CN)6 ___________ ____________
?Cu(NH3)2 ___________ ____________ 4
?Ni(NH3)24 ___________ ____________
?MnCl24 ___________ ____________
?CoF36 ___________ ____________
三、综合题 ( 共 3题 20分 )
14. 5 分
在某温度时用1.0 dm31.00 mol·dm-3 NH3·H2O处理过量的AgIO3固体时,溶解了85 g AgIO3,计算K稳([Ag(NH3)2]+)值。
(已知该温度时Ksp(AgIO3) = 4.5 ? 10-8,相对原子质量: Ag 108, I 127)
15. 10 分
??Co2+ 已知 Co3+ + e? ?
??2H2O O2 + 4H+ + 4e??
?35 Co(NH3)36的K稳 = 1.410, ??= 1.808 V ??= 1.229 V
2? Co(NH3)6的K稳 = 1.3105, NH3的Kb = 1.8 ? 10-5
(1) 试确定Co3+ 在水溶液中能否稳定存在?
?-3 (2) 当体系中加入氨水后,试确定Co(NH3)36配离子在1.0 mol·dm氨水中能否稳定存
在(设各物质浓度均为1.0 mol·dm-3)。
16. 5 分
根据pH = 14时锰元素的吉布斯生成自由能变-氧化态图回答下列问题:
(1) 其中最稳定的物质是哪一个?
(2) 写出能发生歧化反应的化学方程式;
(1) 写出能互相发生氧化还原反应(歧化反应的逆反应)的化学反应方程式二例。
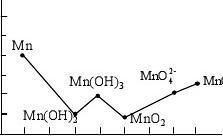
-1?/J·mol?fGm
?4
附加题(10 分)
1. 利用18电子规则,完成下列反应:
(1) Re2O7 + CO →
→ (2) Fe(CO)5 + NO
→ (3) Co2(CO )8 + NO
(4)Cr(CO)6 + NO (完全取代)→
2. 比较下列羰基配合物 M-C 键的强弱。用 > 或 < 表示。
-[Mn(CO)6]+、Cr(CO)6、[V(CO)6]
2004级“无机化学(二)”期末考试闭卷部分
参 考 答 案
一、选择题 ( 共 9题 17分 )
1. 1分 (A)
2. 2 分 (C)
3. 2 分 (C)
4. 2 分 (D)
5. 2 分 (D)
6. 2 分 (C)
7. 2 分 (D)
8. 2 分 (A)
9. 2 分 (C)
二、填空题 ( 共 4 13)
10 2 分 BaCrO4 K2CrO4 CrCl3 CrO5
2-4-3-11. 2 分 [Ni(CN)4] [Co(CN)6] [Co(CN)6]
12. 2 分 一羟基·草酸根·乙二胺·一水合铬(Ⅲ)
13 10 分
几何构型 杂化轨道类型
4?Fe(CN)6 正八面体形 d2 s p3
? 2 Cu(NH3)2
4 平面正方形 ds p
? 3 Ni(NH3)2
4 四面体形 sp
? MnCl2 4 四面体形 sp 3
? CoF3
6 八面体形 sp3d 2
三、综合题(共 3题20分 )
14 5 分 AgIO3 + 2NH3 ? Ag(NH3)2?IO3 +
85-3= 0.30 (mol·dm) 283
4.5?10?8
+-7-3 c (Ag) == 1.5 ? 10 (mol·dm) 0.30
+ Ag + 2NH3 Ag(NH3)?2
-3-7-7-7平衡浓度/mol·dm 0.30-1.5 ? 10 1.5 ? 10 1.00-2(0.30-1.5 ? 10) 0.307K稳 == 1.3 ? 10 ?721.5?10?0.40
c (AgIO3) =
15 10分 (1)不能。因为??(Co/Co) >??(O2 / H2O) 3+2+
所以2Co+ H2O 2Co+3+ =2+ 1+ O2 + 2H2
?2?3+2+?(2) ??(Co(NH3)3
6/ Co(NH3)6) =?(Co/Co) + 0.0591lg2?K稳(Co(NH3)6)
?K稳(Co(NH3)3
6)
1.3?105
= 0.033 (V) = 1.808 + 0.0591lg1.4?1035
? NH3 + H2ONH?
4+ OH
4.2 ? 10-3 (mol·dm-3) [OH?] =.8?10?5?1.0 =
[H+] = (1 ? 10-14) / (4.2 ? 10-3) = 2.4 ? 10-12 (mol·dm-3)
0.0591 ??(O2 / H2O) = 1.229 +lg (2.4 ? 10-12)4 = 0.542 (V) 4
?2?? 因为??(Co(NH3)3
6/Co(NH3)6) <?(O2 / H2O)
? 所以Co(NH3)3
6能稳定存在。
16. 5 分 (1) MnO2
= Mn(OH)+ MnO+ 2HO
3MnO+ 2HO = 2MnO+ MnO + 4OH
(3) Mn + 2Mn(OH) = 3Mn(OH)
2Mn(OH)+MnO= 3MnO+ 2OH+ 2HO (2) 2Mn(OH)3 2?42 2 22?42?323 2?
42 ? 2
附加题:
1. (1) Re2O7 +17 CO → Re2(CO)10+ 7CO2
(2) Fe(CO)5 + 2NO → Fe(CO)2 (NO)2 + 3CO
(3) Co2(CO )8 +2 NO → 2Co(CO )3NO + 2CO
(4) Cr(CO)6 + NO (完全取代)→ Cr(NO)4 + 6 CO
2. M-C 键的强弱
+ -[Mn(CO)6]< Cr(CO)6 < [V(CO)6]

厦门大学“无机化学(二)”课程试卷
化学化工学院化学、材料系20xx年级化学各专业
班级 姓名 分数
1. 5 分
在放有Fe2+和硝酸盐(或亚硝酸盐)的混合溶液的试管中,小心地加入浓H2SO4,在浓
。近年来对此“棕色环”物进行了深入研究表明,该棕H2SO4溶液的界面上出现了“棕色环”
色环是铁的低氧化态八面体配合物,其分子式可写为[Fe(NO)(H2O)5]SO4,其中有三个未成对电子,且这些单电子全来源于铁,请根据这些信息描述配合物的成键细节,包括配体形成、中心离子的价态和电子分布、成键情况等。写出形成“棕色环”有关的反应方程式。
2. 5 分
工业上以废铜为原料经氯化生产氯化亚铜,其反应如下: H2O a. Cu+Cl2 ——→ Cu2++2Cl-
b. Cu2++Cu+2Na+2Cl-——→ 2Na[CuCl2]
2O CuCl↓+NaCl c. Na[CuCl2] H——→
在操作中为了保证质量,必须按一定规范程序进行操作。请回答下列问题:
(1) 制备中当氯化完成后须经中间步骤(即生成配合物Na[CuCl2]),为什么不用一步法制得CuCl?
(Cu2++Cu+2Cl-—→ 2CuCl↓)
(2)为什么必须外加NaCl且控制接近饱和?
(3)为什么要在反应体系中加入少量盐酸,它起何作用?
(4)合成结束后为什么用酒精洗?
3. 5 分
含汞废水处理是环保工作的重要任务之一,化学沉淀法是在含汞废水中先加入一定量的硫化钠,然后再加入FeSO4。查找数据,通过计算说明以上过程为什么要加入FeSO4。
4. 5 分
某公司突发剧毒化学气体(光气)泄漏事故,导致一人死亡,400余人先后出现不同程度的身体不适症状。光气品名碳酰氯或氧氯化碳,为窒息性毒气,毒性比氯气大10倍。它遇水缓慢分解,生成 和 。加热分解,产生有毒和腐蚀性气体。万一有光气漏逸,微量时可用水蒸汽冲散;较大量时,可用液氨喷雾解毒,其反应式为:
。它可作为试剂,用它作配位体,是Lewis碱,可与AlCl3、SnCl2、SbCl5等金属氯化物MCln形成加合物的形式为 ,它还是有用的氯化试剂,可将金属氧化物转化为 。
试卷类型:(A卷、开卷) 考试时间:1小时 1
2004级“无机化学(二)”期末考试开卷部分
参 考 答 案
1. 3Fe2+ + NO3- + 4H+ ====== 3Fe3+ + NO + 2H2O (1分)
[Fe(H2O)6]2+ + NO ====== [Fe(NO)(H2O)5]2+ + H2O(1分)
棕色
根据题目中信息推断,配合物中心原子Fe的氧化态为+1,配位体为NO。也就是说NO与Fe成键时,NO先后提供3个电子,其中1个电子给予Fe,另2个电子则参与形成配位键,[Fe(NO)(H2O)5]中的电子分配如下: (3分)

2. (1)由于白色粉末状CuCl沉淀会沉积在金属铜上影响反应进行。(1分)
(2分) (2)NaCl接近饱和,[Cl]浓度较高,有利于生成Na[CuCl2],使产率提高。
(1分) (3)加入少量盐酸防止Cu的水解。
(4)用酒精洗涤目的使CuCl尽快干燥,防止CuCl在空气中被氧化。(1分)
3. HgS(s) + S2- = HgS22- (1 分) 2+-+2+2+2+
K = Ksp(HgS)× K稳(HgS22-)
= 4×10-53×9.5×1052 = 3.8 (可逆) (2 分) 汞废水处理中,硫化物的加入要适量,若加入过量会产生可溶性 HgS22-配合物,也会使处理后的水中残余硫偏高,带来新的污染。过量的S的处理办法是在废水中加入适量的FeSO4,生成FeS沉淀的同时与悬浮的HgS发生吸附作用共同沉淀下来。(2分) HgS22- + Fe = HgS + FeS
K = 1/ [ HgS2] [Fe] 2-2+2+2-
= [Hg2+] [S][S] / [ HgS ] [Hg] [S] [Fe] [S] 2
稳2-2-2-2+2-2+2-= 1/( K × Ksp (HgS)× Ksp(FeS) )
-53=1/4 × 10×9.5×10 ×6.25×1052-18 = 4.2 ×1016 > 107 (反应彻底)
4. CO HCl (各1分)
COCl2 + 4NH3 == CO(NH2)2 + 2NH4Cl(1分)
Cl2CO:MCln(1分)
金属氯化物(1分)
雁过无痕 整理出品
有需要者 请与下载后站内信 告知邮箱地址 将电邮提供doc格式
