高中有机化学基础知识总结概括
1.各类有机物异构体情况:
⑴ CnH2n+2:只能是烷烃,而且只有碳链异构。如CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4
⑵ CnH2n:单烯烃、环烷烃。如CH2=CHCH2CH3、
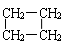
 CH3CH=CHCH3、CH2=C(CH3)2、 、
CH3CH=CHCH3、CH2=C(CH3)2、 、
⑶ CnH2n-2:炔烃、二烯烃。如:CH≡CCH2CH3、CH3C≡CCH3、CH2=CHCH=CH2


 ⑷ CnH2n-6:芳香烃(苯及其同系物)。如: 、 、
⑷ CnH2n-6:芳香烃(苯及其同系物)。如: 、 、
⑸ CnH2n+2O:饱和脂肪醇、醚。如:CH3CH2CH2OH、CH3CH(OH)CH3、CH3OCH2CH3
⑹ CnH2nO:醛、酮、环醚、环醇、烯基醇。如:CH3CH2CHO、CH3COCH3、CH2=CHCH2OH、
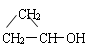
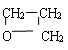
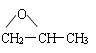 、 、
、 、
⑺ CnH2nO2:羧酸、酯、羟醛、羟基酮。如:CH3CH2COOH、CH3COOCH3、HCOOCH2CH3、HOCH2CH2CHO、CH3CH(OH)CHO、CH3COCH2OH
⑻ CnH2n+1NO2:硝基烷、氨基酸。如:CH3CH2NO2、H2NCH2COOH
⑼ Cn(H2O)m:糖类。如:
C6H12O6:CH2OH(CHOH)4CHO,CH2OH(CHOH)3COCH2OH
C12H22O11:蔗糖、麦芽糖。
2.有机物的物理性质
1、状态:
固态:饱和高级脂肪酸、脂肪、葡萄糖、果糖、蔗糖、麦芽糖、淀粉、维生素、醋酸(16.6℃以下);
气态:C4以下的烷、烯、炔烃、甲醛、一氯甲烷、新戊烷;
液态:
 油状:乙酸乙酯、油酸;
油状:乙酸乙酯、油酸;
粘稠状:石油、乙二醇、丙三醇。
2、气味:
无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味);
稍有气味:乙烯;
特殊气味:甲醛、乙醛、甲酸和乙酸;
香味:乙醇、低级酯;
3、颜色:
白色:葡萄糖、多糖
黑色或深棕色:石油
4、密度:
比水轻:苯、液态烃、一氯代烃、乙醇、乙醛、低级酯、汽油;
比水重:溴苯、乙二醇、丙三醇、CCl4。硝基苯
补充说明:所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
5、挥发性:
乙醇、乙醛、乙酸。
6、水溶性:
不溶:高级脂肪酸、酯、溴苯、甲烷、乙烯、苯及同系物、石油、CCl4、淀粉、纤维素
易溶:甲醛、乙酸、乙二醇;
与水混溶:乙醇、乙醛、甲酸、丙三醇(苯酚常温难溶于水)
补充说明:碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但高于65℃任意比互溶。
3.最简式相同的有机物
1、CH:C2H2、C6H6(苯、棱晶烷、盆烯)、C8H8(立方烷、苯乙烯);苯乙烯( —CH=CH2)
—CH=CH2)
2、CH2:烯烃和环烷烃;
3、CH2O:甲醛、乙酸、甲酸甲酯、葡萄糖;果糖(C6H12O6)
4、CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数的饱和一元羧酸或酯;如乙醛(C2H4O)与丁酸及异构体(C4H8O2)
5、炔烃(或二烯烃)与三倍于其碳原子数的苯及苯的同系物。
如:丙炔(C3H4)与丙苯(C9H12)
4.能与溴水发生化学反应而使溴水褪色或变色的物质
⑴ 不饱和烃(烯烃、炔烃、二烯烃等)
⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)
⑶ 石油产品(裂化气、裂解气、裂化汽油等)
⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)
⑸ 天然橡胶(聚异戊二烯)
(6)烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物
5.能萃取溴而使溴水褪色的物质
上层变无色的(ρ>1):卤代烃(CCl4、氯仿、溴苯等)、CS2等;
下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等。(补充说明:苯、苯的同系物(甲苯)、CCl4、氯仿、液态烷烃等。)
6.能使酸性高锰酸钾溶液褪色的物质
⑴ 不饱和烃(烯烃、炔烃、二烯烃等)
⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)
⑶ 石油产品(裂化气、裂解气、裂化汽油等)
⑷ 醇类物质(乙醇等)
⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)
⑹ 天然橡胶(聚异戊二烯)
⑺ 苯的同系物
(8)烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
注:聚乙烯、乙酸不能使酸性高锰酸钾溶液褪色,乙炔、聚乙炔、乙烯、甲苯、乙醛、甲酸、乙都能使KMnO4(H+)(aq)褪色
7.有机化学计算
1、有机物化学式的确定
(1)确定有机物的式量的方法
①根据标准状况下气体的密度ρ,求算该气体的式量:M = 22.4ρ(标准状况)
②根据气体A对气体B的相对密度D,求算气体A的式量:MA = DMB
③求混合物的平均式量:M = m(混总)/n(混总)
④根据化学反应方程式计算烃的式量。
⑤应用原子个数较少的元素的质量分数,在假设它们的个数为1、2、3时,求出式量。
(2)确定化学式的方法
①根据式量和最简式确定有机物的分子式。
②根据式量,计算一个分子中各元素的原子个数,确定有机物的分子式。
③当能够确定有机物的类别时。可以根据有机物的通式,求算n值,确定分子式。
④根据混合物的平均式量,推算混合物中有机物的分子式。
(3)确定有机物化学式的一般途径
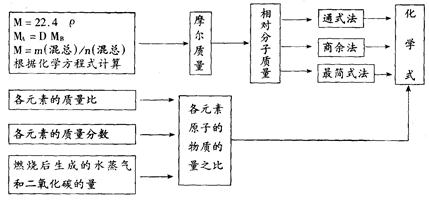
(4)有关烃的混合物计算的几条规律
①若平均式量小于26,则一定有CH4
②平均分子组成中,l < n(C) < 2,则一定有CH4。
③平均分子组成中,2 < n(H) < 4,则一定有C2H2。
2、有机物燃烧规律及其运用
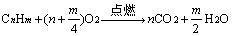
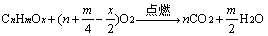
(1)物质的量一定的有机物燃烧
规律一:等物质的量的烃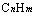 和
和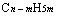 ,完全燃烧耗氧量相同。
,完全燃烧耗氧量相同。
[ ]
]
规律二:等物质的量的不同有机物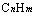 、
、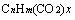 、
、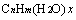 、
、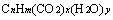 (其中变量x、y为正整数),完全燃烧耗氧量相同。或者说,一定物质的量的由不同有机物
(其中变量x、y为正整数),完全燃烧耗氧量相同。或者说,一定物质的量的由不同有机物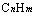 、
、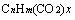 、
、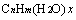 、
、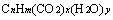 (其中变量x、y为正整数)组成的混合物,无论以何种比例混合,完全燃烧耗氧量相同,且等于同物质的量的任一组分的耗氧量。
(其中变量x、y为正整数)组成的混合物,无论以何种比例混合,完全燃烧耗氧量相同,且等于同物质的量的任一组分的耗氧量。
符合上述组成的物质常见的有:
①相同碳原子数的单烯烃与饱和一元醇、炔烃与饱和一元醛。其组成分别为
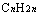 与
与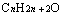 即
即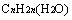 ;
;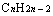 与
与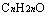 即
即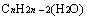 。
。
②相同碳原子数的饱和一元羧酸或酯与饱和三元醇。
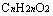 即
即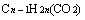 、
、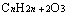 即
即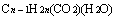 。
。
③相同氢原子数的烷烃与饱和一元羧酸或酯
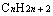 与
与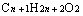 即
即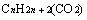
规律三:若等物质的量的不同有机物完全燃烧时生成的H2O的量相同,则氢原子数相同,符合通式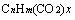 (其中变量x为正整数);若等物质的量的不同有机物完全燃烧时生成的CO2的量相同,则碳原子数相同,符合通式
(其中变量x为正整数);若等物质的量的不同有机物完全燃烧时生成的CO2的量相同,则碳原子数相同,符合通式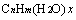 (其中变量x为正整数)。
(其中变量x为正整数)。
(2)质量一定的有机物燃烧
规律一:从C+O2=CO2、6H2+3O2=6H2O可知等质量的碳、氢燃烧,氢耗氧量是碳的3倍。可将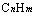 →
→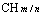 ,从而判断%m(H)或%m(C)。推知:质量相同的烃(
,从而判断%m(H)或%m(C)。推知:质量相同的烃(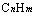 ),m/n越大,则生成的CO2越少,生成的H2O越多,耗氧量越多。
),m/n越大,则生成的CO2越少,生成的H2O越多,耗氧量越多。
规律二:质量相同的下列两种有机物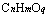 与
与 完全燃烧生成CO2物质的量相同;质量相同的下列两种有机物
完全燃烧生成CO2物质的量相同;质量相同的下列两种有机物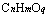 与
与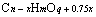 ,燃烧生成H2O物质的量相同。
,燃烧生成H2O物质的量相同。
规律三:等质量的具有相同最简式的有机物完全燃烧时,耗氧量相同,生成的CO2和H2O的量也相同。或者说,最简式相同的有机物无论以何种比例混合,只要总质量相同,耗氧量及生成的CO2和H2O的量均相同。
(3)由烃燃烧前后气体的体积差推断烃的组成
当温度在100℃以上时,气态烃完全燃烧的化学方程式为:
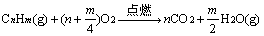
①△V > 0,m/4 > 1,m > 4。分子式中H原子数大于4的气态烃都符合。
②△V = 0,m/4 = 1,m = 4。、CH4,C2H4,C3H4,C4H4。
③△V < 0,m/4 < 1,m < 4。只有C2H2符合。
(4)根据含氧烃的衍生物完全燃烧消耗O2的物质的量与生成CO2的物质的量之比,可推导有机物的可能结构
①若耗氧量与生成的CO2的物质的量相等时,有机物可表示为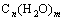
②若耗氧量大于生成的CO2的物质的量时,有机物可表示为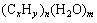
③若耗氧量小于生成的CO2的物质的量时,有机物可表示为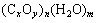
(以上x、y、m、n均为正整数)
8.俗名总结:1 甲烷:沼气、天然气的主要成分 11 Na2CO3 纯碱、苏打
2 乙炔:电石气 12 NaHCO3 小苏打
3 乙醇:酒精 13 CuSO4?5H2O 胆矾、蓝矾
4 丙三醇:甘油 14 SiO2 石英、硅石
5 苯酚:石炭酸 15 CaO 生石灰
6 甲醛:蚁醛 16 Ca(OH)2 熟石灰、消石灰
7 乙酸:醋酸 17 CaCO3 石灰石、大理石
8 三氯甲烷:氯仿 18 Na2SiO3水溶液 水玻璃
9 NaCl:食盐 19 KAl(SO4)2?12H2O 明矾
10 NaOH:烧碱、火碱、苛性钠 20 CO2固体 干冰 (制冷剂)
21. 三氯甲烷:氯仿
9.需要水浴加热的实验:制硝基苯( —NO2,60℃)、制苯磺酸(
—NO2,60℃)、制苯磺酸( —SO3H,80℃)、制酚醛树脂(沸水浴)、银镜反应、醛与新制的Cu(OH)2悬浊液反应(热水浴)、酯的水解、二糖水解(如蔗糖水解)、淀粉水解(沸水浴)
—SO3H,80℃)、制酚醛树脂(沸水浴)、银镜反应、醛与新制的Cu(OH)2悬浊液反应(热水浴)、酯的水解、二糖水解(如蔗糖水解)、淀粉水解(沸水浴)
10.基础知识整理
1、 碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
2、 无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
3、 属于取代反应范畴的有:卤代、硝化、磺化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
4、 能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(CH2=CHCOOH)及其酯(CH3CH=CHCOOCH3)、油酸甘油酯等。
5、 
 能发生水解的物质:金属碳化物(CaC2)、卤代烃(CH3CH2Br)、醇钠(CH3CH2ONa)、酚钠(C6H5ONa)、羧酸盐(CH3COONa)、酯类(CH3COOCH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)(—C6H10O5—n)、
能发生水解的物质:金属碳化物(CaC2)、卤代烃(CH3CH2Br)、醇钠(CH3CH2ONa)、酚钠(C6H5ONa)、羧酸盐(CH3COONa)、酯类(CH3COOCH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)(—C6H10O5—n)、
蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。
6、 能与活泼金属反应置换出氢气的物质:醇、酚、羧酸。
7、 能发生缩聚反应的物质:苯酚(C6H5OH)与醛(RCHO)、二元羧酸(COOH—COOH)与二元醇(HOCH2CH2OH)、二元羧酸与二元胺(H2NCH2CH2NH2)、羟基酸(HOCH2COOH)、氨基酸(NH2CH2COOH)等。
8.光照条件下能发生反应的:烷烃与卤素的取代反应、苯与氯气加成反应(紫外光)、 —CH3+Cl2
—CH3+Cl2  —CH2Cl(注意在铁催化下取代到苯环上
—CH2Cl(注意在铁催化下取代到苯环上
8、 能发生银镜反应的物质(或与新制的Cu(OH)2共热产生红色沉淀的):醛类(RCHO)、葡萄糖、麦芽糖、甲酸(HCOOH)、甲酸盐(HCOONa)、甲酸酯(HCOOCH3)等。 【凡含醛基的物质】
9、 


 常见的官能团及名称:—X(卤原子:氯原子等)、—OH(羟基)、—CHO(醛基)、—COOH(羧基)、—COO—(酯基)、—CO—(羰基)、—O—(醚键)、 C=C (碳碳双键)、—C≡C—(碳碳叁键)、—NH2(氨基)、—NH—CO—(肽键)、—NO2(硝基)
常见的官能团及名称:—X(卤原子:氯原子等)、—OH(羟基)、—CHO(醛基)、—COOH(羧基)、—COO—(酯基)、—CO—(羰基)、—O—(醚键)、 C=C (碳碳双键)、—C≡C—(碳碳叁键)、—NH2(氨基)、—NH—CO—(肽键)、—NO2(硝基)
10、检验酒精中是否含水:用无水CuSO4——变蓝
11、发生加聚反应的:含C=C双键的有机物(如烯)
12、能发生消去反应的是:乙醇(浓硫酸,170℃);卤代烃(如CH3CH2Br)

 醇发生消去反应的条件:C—C—OH、卤代烃发生消去的条件:C—C—X
醇发生消去反应的条件:C—C—OH、卤代烃发生消去的条件:C—C—X
H H
13、能发生酯化反应的是:醇和酸
14、燃烧产生大量黑烟的是:C2H2、C6H6
15、属于天然高分子的是:淀粉、纤维素、蛋白质、天然橡胶(油脂、麦芽糖、蔗糖不是)
16、属于三大合成材料的是:塑料、合成橡胶、合成纤维
17、常用来造纸的原料:纤维素
18、常用来制葡萄糖的是:淀粉
19、能发生皂化反应的是:油脂
20、水解生成氨基酸的是:蛋白质
21、水解的最终产物是葡萄糖的是:淀粉、纤维素、麦芽糖
22、能与Na2CO3或NaHCO3溶液反应的有机物是:含有—COOH:如乙酸
23、能与Na2CO3反应而不能跟NaHCO3反应的有机物是:苯酚
24、有毒的物质是:甲醇(含在工业酒精中);NaNO2(亚硝酸钠,工业用盐)
25、能与Na反应产生H2的是:含羟基的物质(如乙醇、苯酚)、与含羧基的物质(如乙酸)【凡含羧基的物质】
26、能还原成醇的是:醛或酮
27、能氧化成醛的醇是:R—CH2OH
28、能作植物生长调节剂、水果催熟剂的是:乙烯
29、能作为衡量一个国家石油化工水平的标志的是:乙烯的产量
30、通入过量的CO2溶液变浑浊的是:C6H5ONa溶液
31、不能水解的糖:单糖(如葡萄糖)
32、可用于环境消毒的:苯酚
33、皮肤上沾上苯酚用什么清洗:酒精;沾有油脂是试管用热碱液清洗;沾有银镜的试管用稀硝酸洗涤
34、医用酒精的浓度是:75%
36、加入浓溴水产生白色沉淀的是:苯酚
37、 加入FeCl3溶液显紫色的:苯酚
38、能使蛋白质发生盐析的两种盐:Na2SO4、(NH4)2SO4
39、能与NaOH发生反应的有机物:酚、羧酸、卤代烃(水溶液:水解;醇溶液,消去),蛋白质(水解)、酯(水解,加热快,不加热慢)。
40、既能与酸又能与碱反应的有机物:具有酸、碱官能团的有机物(氨基酸、蛋白质)
41、显酸性的有机物有:含有酚羟基和羧基的化合物
42、能使蛋白质变性的有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等
43、能发生水解反应的物质有:卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
44、常温下为气体的有机物有: 分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
45、浓硫酸、加热条件下发生的反应有:苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解
46、酯的水解产物可能是酸和醇、也可能是酸和酚
46、棉花、人造丝、人造棉、玻璃纸都是纤维素
47、等质量甲烷、乙烯、乙炔充分燃烧时,所耗用的氧气的量由多到少(同质量的烃类,H的比例越大燃烧耗氧越多)
48、羟基官能团可能发生反应类型:取代(醇、酚、羧酸);消去(醇);酯化(醇、羧酸);氧化(醇、酚);缩聚(醇、酚、羧酸);中和反应(羧酸、酚)
49、四氯化碳可做灭火剂,CO2可做制冷剂
11.有机物除杂常见错误及原因分析
依据有机物的水溶性、互溶性以及酸碱性等,可选择不同的分离方法达到分离、提纯的目的。在进行分离操作时,通常根据有机物的沸点不同进行蒸馏或分馏;根据物质的溶解性不同,采取萃取、结晶或过滤的方法。有时也可以用水洗、酸洗或碱洗的方法进行提纯操作。下面就有机物提纯中常见的错误操作进行分析。(括号中物质为杂质)
1.乙烷(乙烯)
错例A:通入氢气,使乙烯反应生成乙烷。
错因:①无法确定加入氢气的量;②反应需要加热,并用镍催化,不符合“操作简单”原则。
错例B:通入酸性高锰酸钾溶液,使乙烯被氧化而除去。
错因:乙烯被酸性高锰酸钾溶液氧化可生成二氧化碳气体,导致新的气体杂质混入。
正解:将混合气体通入溴水洗气,使乙烯转化成1,2-二溴乙烷液体留在洗气瓶中而除去。
2.乙醇(水)
错例A:蒸馏,收集78℃时的馏分。
错因:在78℃时,一定浓度(95.57%)的乙醇和水会发生“共沸”现象,即以恒定组成共同气化,少量水无法被蒸馏除去。
错例B:加生石灰,过滤。
错因:生石灰和水生成的氢氧化钙能溶于乙醇,使过滤所得的乙醇混有新的杂质。
正解:加生石灰,蒸馏。(这样可得到99.8%的无水酒精)。
3.乙醇(乙酸)
错例A:蒸馏。(乙醇沸点78.5℃,乙酸沸点117.9℃)。
错因:乙醇、乙酸均易挥发,且能形成恒沸混合物。
错例B:加入碳酸钠溶液,使乙酸转化为乙酸钠后,蒸馏。
错因:乙醇和水能形成恒沸混合物。
正解:加入适量生石灰,使乙酸转化为乙酸钙后,蒸馏分离出乙醇。
4.溴乙烷(乙醇)
错例:蒸馏。
错因:溴乙烷和乙醇都易挥发,能形成恒沸混合物。
正解:加适量蒸馏水振荡,使乙醇溶于水层后,分液。
5.苯(甲苯)[或苯(乙苯)]
错例:加酸性高锰酸钾溶液,将甲苯氧化为苯甲酸后,分液。
错因:苯甲酸微溶于水易溶于苯。
正解:加酸性高锰酸钾溶液后,再加氢氧化钠溶液充分振荡,将甲苯转化为易溶于水的苯甲酸钠,分液。
6.苯(溴)[或溴苯(溴)]
错例:加碘化钾溶液。
错因:溴和碘化钾生成的单质碘又会溶于苯。
正解:加氢氧化钠溶液充分振荡,使溴转化为易溶于水的盐,分液。
7.苯(苯酚)
错例A:加FeCl3溶液充分振荡,然后过滤。
错因:苯酚能和FeCl3溶液反应,但生成物不是沉淀,故无法过滤除去。
错例B:加水充分振荡,分液。
错因:常温下,苯酚在苯中的溶解度要比在水中的大得多。
错例C:加浓溴水充分振荡,将苯酚转化为三溴苯酚白色沉淀,然后过滤。
错因:三溴苯酚在水中是沉淀,但易溶解于苯等有机溶剂。因此也不会产生沉淀,无法过滤除去;
正解:加适量氢氧化钠溶液充分振荡,将苯酚转化为易溶于水的苯酚钠,分液。这是因为苯酚与NaOH溶液反应后生成的苯酚钠是钠盐,易溶于水而难溶于甲苯(盐类一般难溶于有机物),从而可用分液法除去。
8.乙酸乙酯(乙酸)
错例A:加水充分振荡,分液。
错因:乙酸虽溶于水,但其在乙酸乙酯中的溶解度也很大,水洗后仍有大量的乙酸残留在乙酸乙酯中。
错例B:加乙醇和浓硫酸,加热,使乙酸和乙醇发生酯化反应转化为乙酸乙酯。
错因:①无法确定加入乙醇的量;②酯化反应可逆,无法彻底除去乙酸。
错例C:加氢氧化钠溶液充分振荡,使乙酸转化为易溶于水的乙酸钠,分液。
错因:乙酸乙酯在氢氧化钠溶液中容易水解。
正解:加饱和碳酸钠溶液(乙酸乙酯在饱和碳酸钠溶液中的溶解度较小),使乙酸转化为钠盐溶于水层后,分液。
9.苯(甲苯)。试剂高锰酸钾(酸化)和氢氧化钠 方法分液
硝基苯(苯)。试剂NaOH ,方法蒸馏
溴苯(溴)。试剂NaOH,方法分液
苯(苯磺酸)。试剂NaOH,方法加水分液
10.CH4 (CH2=CH2) 溴水 洗气
溴苯(溴) NaOH 分夜
硝基苯(no2)NaOH分夜
苯(甲苯) KMnO4 or NaOH 分液
苯(苯酚) NaOH 分液
苯酚(苯) 蒸馏
乙醇(苯酚)NaOH蒸馏
乙醇(水) CaO 蒸馏
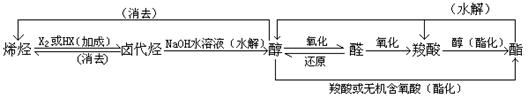
11. 
12. 乙烯(SO2、H2O) 碱石灰 洗气
乙烷(乙烯) 溴水 洗气
溴苯(溴)稀NaOH溶液 分液
硝基苯(NO2) 稀NaOH溶液 分液
甲苯(苯酚) NaOH溶液 分液
乙醛(乙酸) 饱和Na2CO3溶液 蒸馏
乙醇(水) 新制生石灰 蒸馏
苯酚(苯) NaOH溶液、CO2 分液
乙酸乙酯(乙酸) 饱和Na2CO3溶液 分液
溴乙烷(乙醇) 蒸馏水 分液
肥皂(甘油) 食盐 过滤
葡萄糖(淀粉) 半透膜渗析
12.有明显颜色变化的有机反应:
(1)苯酚与三氯化铁溶液反应呈紫色;
(2)KMnO4酸性溶液的褪色;
(3)溴水的褪色;
(4)淀粉遇碘单质变蓝色。
(5)蛋白质遇浓硝酸呈黄色(颜色反应)
