一、基本要求
严格遵守考试纪律,绝不做任何有作弊嫌疑的动作。
二、考试需要携带的物品
相关身份证件、笔、计算器
三、复习要点
(一)基本概念(红色粗体部分是热力学与传热学最基本的概念,要求掌握其定义、物理意义、表达式、单位)
第一章 基本概念
工质、热源、热力系统、外界(环境)、闭口系统、开口系统、绝热系统、孤立系统、平衡状态、热力状态、状态参数、基本状态参数、压力(Pa,mmH2O,mmHg,atm, at换算)、温度、比体积、密度、状态公理、状态方程式、准平衡过程、可逆过程、不可逆过程、功、膨胀功、热量、比熵、熵、定熵过程
第二章 热力学第一定律
储存能、热力学能、稳定流动、焓、比焓、流动功、技术功
第三章 理想气体的性质和热力过程
理想气体、状态方程式、气体常数、摩尔气体常数、热容、比热容、过程方程式、多变指数
第四章 热力学第二定律
自发过程、热力循环、正向循环、逆向循环、动力循环、循环热效率、制冷系数、供热系数、克劳修斯积分等式、克劳修斯不等式、熵流、熵产、闭口系统熵方程
第五章 水蒸气与湿空气
饱和状态、饱和液体、饱和蒸气、饱和温度、未饱和水、饱和水、湿(饱和)蒸汽、干度、干(饱和)蒸气、汽化潜热、过热蒸气、饱和水线(下界线)、干饱和蒸汽线(上界线)、临界点、未饱和湿空气、饱和湿空气、露点(温度)、绝对湿度、相对湿度、含湿量。
第六章
蒸汽动力装置、蒸汽动力循环、郎肯循环(循环的过程构成及主要装置)、提高蒸汽动力循环效率的途径。
第八章
导热、一维稳态导热、热流量、热导率(导热系数)、导热热阻(平壁)、热流密度、热对流、对流换热、表面传热系数、对流换热热阻、热辐射、辐射换热、传热过程、传热热阻、传热系数
第九章
温度场、非稳态温度场、稳态温度场、稳态导热、等温线、等温面、温度梯度、热量密度矢量、热导率、保温材料、热扩散率(导温系数)、单值性条件、边界条件、导热热阻(圆筒壁)、傅里叶数、毕渥数、特征数、集总参数法、特征长度、时间常数。
第十章
平均表面传热系数、局部表面传热系数、对流换热影响因素、特征长度(定型尺寸)、流动边界层、边界层区、主流区、层流边界层、湍流边界层、层流底层、缓冲层、临界距离、临界雷诺数、热边界层、普朗特数、特征数关联式、努塞尔数、平均努塞尔数、相似原理、管
内强迫对流换热的特点及影响因素(修正系数大于?小于?1)、外掠壁面强迫对流换热影响因素、体膨胀系数、格拉晓夫数。 第十一章
投入辐射、吸收比、反射比、透射比、发射率、灰体、黑体、辐射力、光谱辐射力、黑体光谱辐射力随波长和温度变化的特点、斯忒藩-玻尔兹曼定律、角系数、角系数的性质、有效辐射、表面辐射热阻、空间辐射热阻
第十二章
复合换热、辐射换热表面传热系数、换热器、对数平均温差。
(二)基本定律与定理
热力学第零定律、热力学第一定律、热力学第二定律、卡诺定理、孤立系统熵增原理、相似原理、傅里叶导热定律、牛顿冷却定律、普朗克定律、斯忒藩-玻尔兹曼定律、基尔霍夫定律。
(三)图
1、理想气体p-v,T-s图
要求:满足一定要求的可逆热力过程在坐标图上的表示;功、热量正负、相对大小的判别;p,v,T,s,h,u,相对大小的判别。
2、水的汽化过程的p-v,T-s图
要求:1点、2线、3区、5态;能利用该图判断物质所处的状态。
3、利用湿空气的焓湿图分析湿空气的基本热力过程
四、计算
1、利用热力学第一定律分析计算系统与外界之间功与能量的交换。
2、理想气体热力过程的计算(状态方程、过程方程、热力学变化、焓变、熵变等,表3-2中公式)
3、卡诺热效率、供热系数、制冷系数
4、用卡诺定律、克劳修斯积分或孤立系统熵增原理分析过程是否满足热力学第二定律
5、平壁或圆筒壁稳态导热问题的计算
6、集总参数法计算非稳态导热问题
7、相似原理分析计算对流换热问题
8、已知特征数关联式,计算对流换热量
9、两个灰体表面构成封闭空腔的辐射换热计算
10、通过平壁或圆筒壁的稳态传热问题计算
11、换热器计算
考试不涉及的章节
3-3 理想混合气体;
3-6气体在喷管中的流动;
3-7绝热滞止;
4-4火用
5-2 .2水蒸气的焓熵图
5-4.4湿空气的相对分子质量、气体常数及密度
5-4.5湿空气的焓
5-6干湿球温度计
6-2活塞式内燃机循环
6-3燃气轮机装置的理想循环
第七章 全部
9-2.3球壁的稳态导热
9-2.4肋片的稳态导热
9-2.5多维稳态导热的形状因子解法
9-2.6接触热阻
9-3.1(3)诺谟图
9-3.2特殊多维非稳态导热的简易求解方法
9-4导热问题的数值解法基础
10-3.3动量传递与热量传递的比拟简介
10-7 凝结与沸腾换热
11-1.3辐射强度
11-4.3(多个漫灰表面构成的封闭空腔中的辐射换热) 11-5遮热板原理
11-6太阳辐射
12-1.3临界绝缘直径
12-1.4通过肋壁的传热过程
第二篇:《工程热力学及传热学》复习资料(安全本)
下述说法是否有错误:
⑴ 循环净功Wnet愈大则循环热效率愈高;
⑵ 不可逆循环的热效率一定小于可逆循环的热效率;
⑶ 可逆循环的热效率都相等,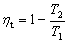 。
。
答:⑴说法不对。循环热效率的基本定义为: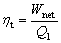 ,循环的热效率除与循环净功有关外,尚与循环吸热量Q1的大小有关;
,循环的热效率除与循环净功有关外,尚与循环吸热量Q1的大小有关;
⑵说法不对。根据卡诺定理,只是在“工作于同样温度的高温热源和同样温度的低温热源间”的条件下才能肯定不可逆循环的热效率一定小于可逆循环,离开了这一条件结论就不正确;
⑶说法也不正确。根据卡诺定理也应当是在“工作于同样温度的高温热源和同样温度的低温热源间”的条件下才能肯定所有可逆循环的热效率都相等,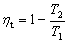 ,而且与工质的性质与关,与循环的种类无关。如果式中的温度分别采用各自的放热平均温度和吸热平均温度则公式就是正确的,即
,而且与工质的性质与关,与循环的种类无关。如果式中的温度分别采用各自的放热平均温度和吸热平均温度则公式就是正确的,即 ,不过这种情况下也不能说是“所有可逆循环的热效率都相等”,只能说所有可逆循环的热效率表达方式相同。
,不过这种情况下也不能说是“所有可逆循环的热效率都相等”,只能说所有可逆循环的热效率表达方式相同。
试证明热力学第二定律各种说法的等效性:若克劳修斯说法不成立,则开尔文说法也不成立。
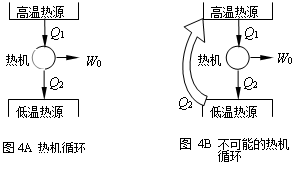 证:热力学第二定律的克劳修斯表述是:热不可能自发地、不付代价地从高温物体传至低温物体。开尔文表述则为:不可能从单一热源取热使之全部变为功而不产生其它影响。按照开尔文说法,遵循热力学第二定律的热力发动机其原则性工作系统应有如图4A所示的情况。假设克劳修斯说法可以违背,热量Q2可以自发地不付代价地从地温物体传至高温物体,则应有如图4B所示的情况。在这种情况下,对于所示的热机系统当热机完成一个循环时,实际上低温热源既不得到什么,也不失去什么,就如同不存在一样,而高温热源实际上只是放出了热量(Q1-Q2),同时,热力发动机则将该热量全部转变为功而不产生其它影响,即热力学第二定律的开尔文说法不成立。
证:热力学第二定律的克劳修斯表述是:热不可能自发地、不付代价地从高温物体传至低温物体。开尔文表述则为:不可能从单一热源取热使之全部变为功而不产生其它影响。按照开尔文说法,遵循热力学第二定律的热力发动机其原则性工作系统应有如图4A所示的情况。假设克劳修斯说法可以违背,热量Q2可以自发地不付代价地从地温物体传至高温物体,则应有如图4B所示的情况。在这种情况下,对于所示的热机系统当热机完成一个循环时,实际上低温热源既不得到什么,也不失去什么,就如同不存在一样,而高温热源实际上只是放出了热量(Q1-Q2),同时,热力发动机则将该热量全部转变为功而不产生其它影响,即热力学第二定律的开尔文说法不成立。
试判断下列各种说法是否正确:
(1)定容过程即无膨胀(或压缩)功的过程;
(2)绝热过程即定熵过程;
(3)多变过程即任意过程。
答:①膨胀功(压缩功)都是容积(变化)功,定容过程是一种系统比体积不变,对控制质量或说系统容积不变的过程,因此说定容过程即无膨胀(或压缩)功的过程是正确的;
②绝热过程指的是系统不与外界交换热量的过程。系统在过程中不与外界交换热量,这仅表明过程中系统与外界间无伴随热流的熵流存在,但若为不可逆过程,由于过程中存在熵产,则系统经历该过程后会因有熵的产生而发生熵的额外增加,实际上只是可逆的绝热过程才是定熵过程,而不可逆的绝热过程则为熵增大的过程,故此说法不正确;
③多边过程是指遵循方程Pvn = 常数(n为某一确定的实数)的那一类热力过程,这种变化规律虽较具普遍性,但并不包括一切过程,因此说多变过程即任意过程是不正确的。
为什么推动功出现在开口系能量方程式中,而不出现在闭口系能量方程式中?
答:当流体流动时,上游流体为了在下游占有一个位置,必须将相应的下游流体推挤开去,当有流体流进或流出系统时,上、下游流体间的这种推挤关系,就会在系统与外界之间形成一种特有的推动功(推进功或推出功)相互作用。反之,闭口系统由于不存在流体的宏观流动现象,不存在上游流体推挤下游流体的作用,也就没有系统与外间的推动功作用,所以在闭口系统的能量方程式中不会出现推动功项。
经历一个不可逆过程后,系统能否恢复原来状态?包括系统和外界的整个系统能否恢复原来状态?
答:所谓过程不可逆,是指一并完成该过程的逆过程后,系统和它的外界不可能同时恢复到他们的原来状态,并非简单地指系统不可能回复到原态。同理,系统经历正、逆过程后恢复到了原态也并不就意味着过程是可逆的;过程是否可逆,还得看与之发生过相互作用的所有外界是否也全都回复到了原来的状态,没有遗留下任何变化。原则上说来经历一个不可逆过程后系统是可能恢复到原来状态的,只是包括系统和外界在内的整个系统则一定不能恢复原来状态。
1.比热是过程量,定压比热 B 。
A. 表示比体积一定时比内能随温度的变化率 B. 是温度与压力的状态函数
C. 与系统质量成正比 D. 也是过程量
2.对闭口系任意微元过程, 若系统的熵变等于零, 则___ C ___。
A. 该过程可逆 B. 该过程不可逆 C. 无法判定过程的可逆与否 D. 必为吸热过程
3.概括性卡诺循环热机的效率可以表示为____ A_____。
A.  B.
B. 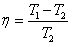 C.
C.  D.
D. 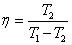
(下标“1”表示高温,“2”表示低温,“net”表示循环)
4.理想气体多变过程的比热为 _ D __ 。
A. 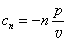 B.
B.  C.
C. 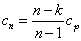 D.
D. 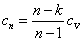
5.在压缩比相同、吸热量相同时,定容加热循环(Otto)、定压加热循环(Diesel)和混合加热循环的效率(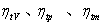 )大小依次为_____ B _____。
)大小依次为_____ B _____。
A. 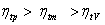 B.
B. 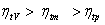 C.
C. 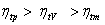 D.
D. 
6.对于闭口系绝热过程,错误的表述是 D 。
A. 熵变等于熵产 B. 过程功的大小等于内能差 C. 熵变必大于零 D. 必为等熵过程
7. 准平衡过程是指___ B ___的过程。
A. 弛豫时间很长 B. 不平衡势差无限小 C. 温差无限小 D. 压差无限小
8.理想气体的比内能和比焓_____ C ____。
A. 是温度与压力的函数 B. 是压力的函数
C. 在初终态压力不同,温度相同时的变化值相同 D. 在初终态压力相同,温度不相同时的变化值相同
9.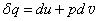 适用于____ C ___。
适用于____ C ___。
A. 定压过程 B. 准平衡过程 C. 无耗散的准平衡过程(可逆过程w=PdV) D. 理想气体的任意过程
10.湿空气 B 。
A. 可当作纯物质来处理 B. 中的干空气与水蒸汽均可视为理想气体
C. 中的干空气与水蒸汽的状态由分体积定律确定 D. 中的干空气必须视为混合物
11.在理想气体压容图上,等熵线____ C _____。
A. 的斜率为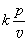 B. 比等温线平缓 C. 比等温线陡 D. 的斜率为
B. 比等温线平缓 C. 比等温线陡 D. 的斜率为 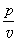
12.闭系经历一不可逆循环,作循环功5KJ, 则___ D __。
A. 熵变小于零 B. 循环热小于5KJ C. 熵变大于零 D. 循环热等于5KJ
13.空气的平均分子量为28.97, 定压比热 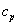 =1004 J/(kg.K), 其定容比热为___ A ____ J/(kg.K)。
=1004 J/(kg.K), 其定容比热为___ A ____ J/(kg.K)。
A. 717 B. 0.717 C. 1006 D. 2006
15.相同初终态参数条件下,不可逆过程的 B 。
A. 熵变一定大于可逆过程的熵变 B. 焓差一定等于可逆过程的焓差
C. 熵变一定小于可逆过程的熵变 D. 焓差一定小于可逆过程的焓差
16.1kg理想气体在一容器内作绝热自由膨胀, 体积扩大了两倍, 熵差为__ A _。
A. 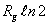 B.
B. 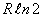 C.
C. 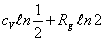 D.
D. 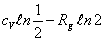
17.湿空气的相对湿度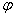 =100%时,表明空气中 B 。
=100%时,表明空气中 B 。
A. 只有水蒸气 B. 的水蒸气处于饱和状态
C. 的水蒸气的绝对含量很高 D. 的干空气处于饱和状态
18.湿空气的状态可以由 A 确定。
A. 3个强度参数 B. 总压与干球温度 C. 总压与相对湿度 D. 比焓和湿球温度
19.摄氏温标 B 。
A. 是经验温标 B. 是由热力学温标导出的温标
C. 有两个基准点 D. 在水的冰点与沸点无量测误差
20.与理想气体比较,实际气体的最大两个特点是 A 。
A. 分子占有体积和分子间有作用力 B. 分子占有体积和压缩因子等1
C. 压缩因子等于1和分子间有作用力 D. 以上选择都
含湿量(比湿度):在含有1kg干空气的湿空气中,所混有的水蒸气质量
开尔文说法:只冷却一个热源而连续不断作功的循环发动机是造不成功的。
克劳修斯说法:热不可能自发地、不付代价地从低温物体传到高温物体。
系统经历一可逆正向循环及其逆向可逆循环后,系统和外界有什么变化?若上述正向及逆向循环中有不可逆因素,则系统及外界有什么变化?
答:系统完成一个循环后接着又完成其逆向循环时,无论循环可逆与否,系统的状态都不会有什么变化。根据可逆的概念,当系统完成可逆过程(包括循环)后接着又完成其逆向过程时,与之发生相互作用的外界也应一一回复到原来的状态,不遗留下任何变化;若循环中存在着不可逆因素,系统完成的是不可逆循环时,虽然系统回复到原来状态,但在外界一定会遗留下某种永远无法复原的变化。
(注意:系统完成任何一个循环后都恢复到原来的状态,但并没有完成其“逆过程”,因此不存在其外界是否“也恢复到原来状态”的问题。一般说来,系统进行任何一种循环后都必然会在外界产生某种效应,如热变功,制冷等,从而使外界有了变化。)
马赫数:工质(如气体和蒸汽)的流速Wg与当地音速C之比。
临界压力比:气体速度等于当地音速的截面为临界截面,临界截面上的压力即临界压力Pcr与气体进口压力P1之比。Bcr=Pcr/P1.
干度:工程上通常给出的“干度”表示1kg湿蒸汽中含有Xkg的饱和蒸汽。
露点:未饱和空气中的过热蒸汽在水蒸气分压力不变的情况下,冷却至饱和蒸汽时的温度称为未饱和空气的露点,或湿空气中水蒸气分压力Pv相应的饱和温度即为露点。
过热蒸汽:蒸汽温度t高于其压力p所对应的饱和温度ts,这种蒸汽称为过热蒸汽。过热蒸汽的P和T是两个相互独立的参数。
热力学第一定律解析式有时写成下列两种形式:
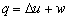
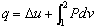
分别讨论上述两式的适用范围。
答:第一个公式为热力学第一定律的最普遍表达,原则上适用于不作宏观运动的一切系统的所有过程;第二个表达式中由于将过程功表达成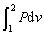 ,这只是对简单可压缩物质的可逆过程才正确,因此该公式仅适用于简单可压缩物质的可逆过程。
,这只是对简单可压缩物质的可逆过程才正确,因此该公式仅适用于简单可压缩物质的可逆过程。
熵增原理:孤立系统中,如进行的过程是可逆过程,其熵保持不变,如为不可逆过程,其熵增加,不论进行什么过程,其熵不可能减少。
热力学第一定律的能量方程式是否可写成

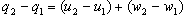
的形式,为什么?
答:⑴热力学第一定律的基本表达式是:
过程热量 = 工质的热力学能变化 + 过程功
第一个公式中的Pv并非过程功的正确表达,因此该式是不成立的;
⑵热量和功过程功都是过程的函数,并非状态的函数,对应于状态1和2并不存在什么q1、q2和w1、w2;对于过程1-2并不存在过程热量 和过程功
和过程功 ,因此第二个公式也是不成立的。
,因此第二个公式也是不成立的。
黑度:实际物体的辐射力E与同温度下绝对黑体的辐射力Eo之比值。ε=E/Eo,黑度表征着物体辐射力接近黑体辐射力的程度。
灰体:在所有波长下,物体的单色辐射力Eλ与同温度,同波长下黑体单色辐射力Eoλ之比为定值的物体。
准静态过程:过程进行得非常缓慢,使过程中系统内部被破坏了的平衡有足够的时间恢复到新的平衡态,从而使过程的每一瞬间系统内部的状态都非常接近平衡状态,整个过程可看作是由一系列非常接近平衡态的状态所组成,并称之为准静态过程。
在闭口热力系的定容过程中,外界对系统施以搅拌功δw,问这时δQ = mcvdT是否成立?
答:不成立。只是在内部可逆的单纯加热过程中(即无不可逆模式功存在时)才可以通过热容与温度变化的乘积来计算热量,或者原则地讲,只是在在可逆过程中(不存在以非可逆功模式做功的时候)才可以通过上述热量计算公式计算热量。对工质施以搅拌功时是典型的不可逆过程。
相对湿度:湿空气的绝对湿度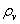 与同温度下饱和空气的饱和绝对湿度
与同温度下饱和空气的饱和绝对湿度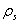 的比值
的比值
循环热效率公式 和
和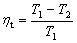 是否完全相同?各适用于哪些场合?
是否完全相同?各适用于哪些场合?
答:不完全相同。前者是循环热效率的普遍表达,适用于任何循环;后者是卡诺循环热效率的表达,仅适用于卡诺循环,或同样工作于温度为T1的高温热源和温度为T2的低温热源间的一切可逆循环。
黑体: 能全部吸收外来射线,即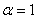 的物体
的物体
经验温标的缺点是什么?为什么?
答:由选定的任意一种测温物质的某种物理性质,采用任意一种温度标定规则所得到的温标称为经验温标。由于经验温标依赖于测温物质的性质,当选用不同测温物质制作温度计、采用不同的物理性质作为温度的标志来测量温度时,除选定的基准点外,在其它温度上,不同的温度计对同一温度可能会给出不同测定值(尽管差值可能是微小的),因而任何一种经验温标都不能作为度量温度的标准。这便是经验温标的根本缺点。
灰体: 指物体单色辐射力与同温度黑体单色辐射力随波长的变化曲线相似,或它的单色发射率不随波长变化。
刚性绝热容器中间用隔板分为两部分,A中存有高压空气,B中保持真空,如图所示。若将隔板抽去,分析容器中空气的热力学能如何变化?若隔板上有一小孔,气体泄漏人B中,分析A、B两部分压力相同时A、B两部分气体的比热力学能如何变化?
答: ⑴ 定义容器内的气体为系统,这是一个控制质量。
由于气体向真空作无阻自由膨胀,不对外界作功,过程功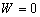 ;容器又是绝热的,过程的热量
;容器又是绝热的,过程的热量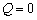 ,因此,根据热力学第一定律
,因此,根据热力学第一定律 ,应有
,应有 ,即容器中气体的总热力学能不变,膨胀后当气体重新回复到热力学平衡状态时,其比热力学能亦与原来一样,没有变化;若为理想气体,则其温度不变。
,即容器中气体的总热力学能不变,膨胀后当气体重新回复到热力学平衡状态时,其比热力学能亦与原来一样,没有变化;若为理想气体,则其温度不变。
⑵ 当隔板上有一小孔,气体从A泄漏人B中,若隔板为良好导热体,A、B两部分气体时刻应有相同的温度,当A、B两部分气体压力相同时,A、B两部分气体处于热力学平衡状态,情况像上述作自由膨胀时一样,两部分气体将有相同的比热力学能,按其容积比分配气体的总热力学能;若隔板为绝热体,则过程为A对B的充气过程,由于A部分气体需对进入B的那一部分气体作推进功,充气的结果其比热力学能将比原来减少,B部分气体的比热力学能则会比原来升高,最终两部分气体的压力会达到平衡,但A部分气体的温度将比B部分的低
对于理想气体的任何一种过程,下列两组公式是否都适用:
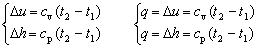
答:因为理想气体的热力学能和焓为温度的单值函数,只要温度变化相同,不论经历任何过程其热力学能和焓的变化都会相同,因此,所给第一组公式对理想气体的任何过程都是适用的;但是第二组公式是分别由热力学第一定律的第一和第二表达式在可逆定容和定压条件下导出,因而仅分别适用于可逆的定容或定压过程。就该组中的两个公式的前一段而言适用于任何工质,但对两公式后一段所表达的关系而言则仅适用于理想气体。
在定容过程和定压过程中,气体的热量可根据过程中气体的比热容乘以温差来计算。定温过程气体的温度不变,在定温膨胀过程中是否需对气体加入热量?如果加入的话应如何计算?
答:在气体定温膨胀过程中实际上是需要加入热量的。定温过程中气体的比热容应为无限大,应而不能以比热容和温度变化的乘积来求解,最基本的求解关系应是热力学第一定律的基本表达式:q = Δu + w 。
下述说法是否有错误:
⑴ 熵增大的过程必为不可逆过程;⑵ 使系统熵增大的过程必为不可逆过程;
⑶ 熵产Sg > 0的过程必为不可逆过程;⑷ 不可逆过程的熵变DS无法计算;
⑸ 如果从同一初始态到同一终态有两条途径,一为可逆,另一为不可逆,则
 、
、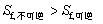 、
、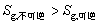 ;
;
⑹ 不可逆绝热膨胀的终态熵大于初态熵,S2>S1,不可逆绝热压缩的终态熵小于初态熵S2<S1;⑺ 工质经过不可逆循环有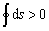 ;
;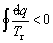 。
。
答:⑴说法不正确。系统的熵变来源于熵产和热熵流两个部分,其中熵产必定是正值(含零),热熵流则可为正值,亦可为负值。当系统吸热时热熵流为正值,即便是可逆过程(熵产为零)系统的熵也增大;
⑵此说法与⑴是一样的。如果所说的“系统”指的是孤立系统则说法是正确的。不过实在不应该这样含糊“系统”这一概念!
⑶根据熵产原理,这一说法是正确的。
⑷此说法完全错误。熵是状态参数,只要过程的初、终状态确定了,系统的熵变就完全确定,与过程无关。因此,不可逆过程熵变的计算方法之一便是借助同样初、终状态的可逆过程来进行计算。至于利用熵的一般关系式进行熵变计算,它们根本就与过程无关。
⑸ 根据熵为状态参数知,两种过程的端点状态相同时应有相同的熵变,认为 是错误的;
是错误的;
不可逆过程将有熵产生,而可逆过程则不会产生熵,因此说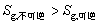 是正确的;
是正确的;
熵是状态参数,过程端点状态相同时应有相同熵变,由系统熵方程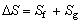 ,过程可逆时
,过程可逆时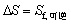 ;不可逆时
;不可逆时 ,式中
,式中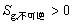 ,可见应有
,可见应有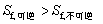 ,而不是
,而不是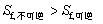 。
。
⑹此说法不对。根据熵产原理,系统经历不可逆绝热过程后,无论是膨胀或受压缩,其熵都将增大。
⑺由熵为状态参数知,工质经过循环过程后其熵应不变,所以认为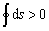 是不正确的;根据克劳修斯不等式知,
是不正确的;根据克劳修斯不等式知,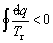 是正确的。
是正确的。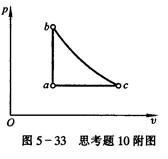 10. 从点a开始有两个可逆过程::定容过程a-b和定压过程a-c,b、c两点在同一条绝热线上(见图5-33),问qa-b和qa-c哪个大?并在T-s图上表示过程a-b、a-c及qa-b、qa-c 。(提示::可根据循环a-b-c-a考虑。)
10. 从点a开始有两个可逆过程::定容过程a-b和定压过程a-c,b、c两点在同一条绝热线上(见图5-33),问qa-b和qa-c哪个大?并在T-s图上表示过程a-b、a-c及qa-b、qa-c 。(提示::可根据循环a-b-c-a考虑。)
答:根据循环a-b-c-a的情况应是正循环,即循环的吸热量应大于循环的放热量(指绝对值)。其中qa-b为循环的吸热量,qc-a为循环的放热量,由此,知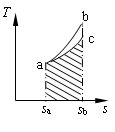 qa-b > qa-c
qa-b > qa-c
在T-s图上
qa-b的大小如面积abcsbsaa所示;
qa-c的大小如面积acsbsaa所示;
