第二篇:高中化学必背知识点知识点分析新人教版必修2
1
高中化学必背知识点
1、元素周期表和元素周期律
①原子组成: 中子 原子不带电:中子不带电,质子带正电荷,电子带负电荷 质子 质子数==原子序数==核电荷数==核外电子数
核外电子 相对原子质量==质量数
②原子表示方法: A A:质量数 Z:质子数 N:中子数 A=Z+N Z 决定元素种类的因素是质子数多少,确定了质子数就可以确定它是什么元素
③同位素:质子数相同而中子数不同的原子互称为同位素,如:16O和18O,12C和14C,35Cl
和37Cl
④电子数和质子数关系:不带电微粒:电子数==质子数
带正电微粒:电子数==质子数—电荷数
带负电微粒:电子数==质子数+电荷数
⑤1—18号元素(请按下图表示记忆)
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
⑥元素周期表结构
短周期(第1、2、3周期,元素种类分别为2、8、8)
元 周期(7) 长周期(第4、5、6周期,元素种类分别为18、18、32) 素不完全周期(第7周期,元素种类为26,若排满为32)
主族(7个)(ⅠA—ⅦA)
期族(18个纵行,16) 副族(7个)(ⅠB—ⅦB)
表族(稀有气体族:He、Ne、Ar、Kr、Xe、Rn)
Ⅷ族(3列)
⑦元素在周期表中的位置:周期数==电子层数,主族族序数==最外层电子数==最高正化合
价
⑧元素周期律:
从左到右:原子序数逐渐增加,原子半径逐渐减小,得电子能力逐渐增强(失电子能力逐
渐减弱),非金属性逐渐增强(金属性逐渐减弱)
从上到下:原子序数逐渐增加,原子半径逐渐增大,失电子能力逐渐增强(得电子能力逐
渐减弱),金属性逐渐增强(非金属性逐渐减弱)
所以在周期表中,非金属性最强的是F,金属性最强的是Fr (自然界中是Cs,因为Fr
是放射性元素)
※ 判断金属性强弱的四条依据:
a、与酸或水反应的剧烈程度以及释放出氢气的难易程度,越剧烈则越容易释放出H2,金
属性越强
b、最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强
c、金属单质间的相互置换(如:Fe+CuSO4==FeSO4+Cu)
d、原电池的正负极(负极活泼性﹥正极)
※ 判断非金属性强弱的三条依据:
a、与H2结合的难易程度以及生成气态氢化物的稳定性,越易结合则越稳定,非金属性
越强
b、最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强
c、非金属单质间的相互置换(如:Cl2+H2S==2HCl+S↓) X
2
注意:“相互证明”——由依据可以证明强弱,由强弱可以推出依据
⑨化学键:原子之间强烈的相互作用
极性键 化学键非极性键
共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元
素间形成。
非极性键:相同的非金属原子之间,A—A型,如:H2,Cl2,O2,N2中存在非极性键 极性键:不同的非金属原子之间,A—B型,如:NH3,HCl,H2O,CO2中存在极性键 离子键:原子之间通过得失电子形成的化学键,一般由活泼的金属(ⅠA、ⅡA)与活泼的
非金属元素(ⅥA、ⅦA)间形成,如:NaCl,MgO,KOH,Na2O2,NaNO3中存在离子键
注:有NH4+离子的一定是形成了离子键;AlCl3中没有离子键,是典型的共价键 共价化合物:仅仅由共价键形成的化合物,如:HCl,H2SO4,CO2,H2O等
离子化合物:存在离子键的化合物,如:NaCl,Mg(NO3)2,KBr,NaOH,NH4Cl 2、化学反应速率
①定义:单位时间内反应物浓度的减少量或生成物浓度的增加量,v==△C/△t
②影响化学反应速率的因素:
浓度:浓度增大,速率增大 温度:温度升高,速率增大 压强:压强增大,速率增大(仅对气体参加的反应有影响)
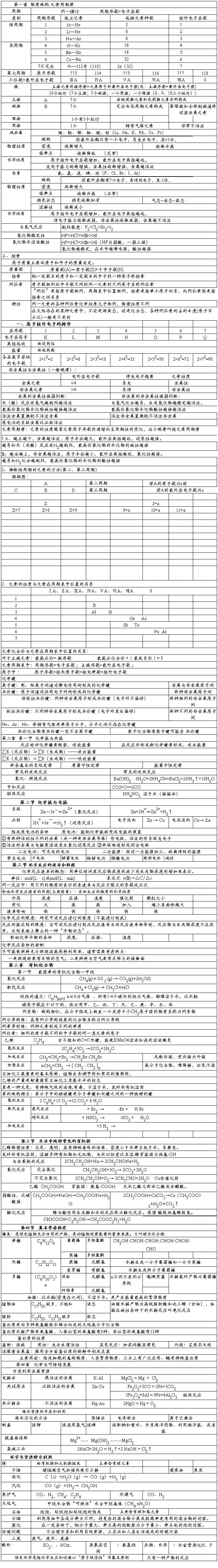
催化剂:改变化学反应速率 其他:反应物颗粒大小,溶剂的性质 3、原电池
负极(Zn):Zn—2e-==Zn2+ 正极(Cu):2H++2e-==H2↑ ①定义:将化学能转化为电能的装置
②构成原电池的条件:
a、有活泼性不同的金属(或者其中一个为碳棒)做电极,其中较活泼
金属做负极,较不活泼金属做正极 b、有电解质溶液 c、形成闭合回路 4、烃
①有机物 a、概念:含碳的化合物,除CO、CO2、碳酸盐等无机物外
b、结构特点:ⅰ、碳原子最外层有4个电子,一定形成四根共价键
ⅱ、碳原子可以和碳原子结合形成碳链,还可以和其他原子结合
ⅲ、碳碳之间可以形成单键,还可以形成双键、三键、碳碳可以形成链状,也可以形
成环状
c、一般性质:ⅰ、绝大部分有机物都可以燃烧(除了CCl4不仅布燃烧,还可以用来灭火)
ⅱ、绝大部分有机物都不溶于水(乙醇、乙酸、葡萄糖等可以)
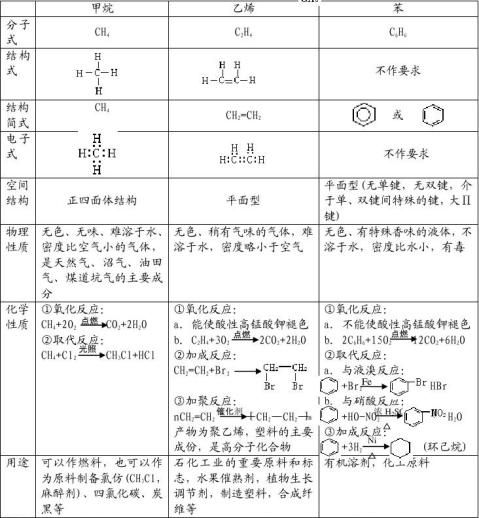
②烃:仅含碳、氢两种元素的化合物(甲烷、乙烯、苯的性质见表)
③烷烃:a、定义:碳碳之间以单键结合,其余的价键全部与氢结合所形成的链状烃称之为
烷烃。因为碳的所有价键都已经充分利用,所以又称之为饱和烃
b、通式:CnH2n+2,如甲烷(CH4),乙烷(C2H6),丁烷(C4H10)
c、物理性质:随着碳原子数目增加,状态由气态(1—4),液态(5—16),固态(17及以上) d、化学性质(氧化反应):能够燃烧,但不能使酸性高锰酸钾溶液褪色,同甲烷
CnH2n+22+(n+1)H2O
e、命名(习惯命名法):碳原子在10个以内的,用甲、乙、丙、丁、戊、己、庚、辛、壬、癸命名
④同分异构现象:分子式相同,但结构不同的现象,称之为同分异构现象 同分异构体:具有同分异构现象的物质之间称为同分异构体
3
如C4H10有两种同分异构体:CH3CH2CH2CH3(正丁烷),CH3CHCH3(异丁烷)
加成反应:有机物分子中不饱和键(双键或三键)两端的原子与其他原子直接相连的反应: 芳香烃:含有一个或多个苯环的烃称为芳香烃。苯是最简单的芳香烃(易取代,难加成)。 5、烃的衍生物
①乙醇:
a、物理性质:无色,有特殊气味,易挥发的液体,可和水以任意比互溶,良好的溶剂 b、分子结构:分子式C2H6O,结构简式CH3CH2OH或C2H5OH,官能团: 羟基(—OH) c、化学性质:ⅰ、与活泼金属(Na)反应:2CH3CH3CH2ONa+H2↑
ⅱ、氧化反应:燃烧:C2H5或Ag 2CO2+3H2O
催化氧化:2CH3CH 22CH3CHO+2H2O
浓H2SO4
ⅲ、酯化反应:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O △ d、乙醇的用途:燃料,医用消毒(体积分数75%),有机溶剂,造酒 ②乙酸:
4
a、物理性质:无色,,有强烈刺激性气味,液体,易溶于水和乙醇。纯净的乙酸称为冰醋酸。
b、分子结构:分子式:C2H4O2,结构简式:CH3COOH,官能团:羧基(—COOH) c、化学性质:
ⅰ、酸性(具备酸的通性):比碳酸酸性强
2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2, CH3COOH+NaOH=CH3COONa+H2O
ⅱ、酯化反应(用饱和Na2CO3溶液来吸收,3个作用) d、乙酸的用途:食醋的成分(3%—5%) ③酯:
a、物理性质:密度小于水,难溶于水。低级酯具有特殊的香味。 b、化学性质:水解反应
浓H2SO4
ⅰ、酸性条件下水解:CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH ⅱ、碱性条件下水解:CH3COOCH2CH3
3COONa+CH3CH2OH 6、煤、石油、天然气
①煤:由有机物和少量无机物组成的复杂混合物,可通过干馏、气化和液化进行综合利用 蒸馏:利用物质沸点(相差在20℃以上)的差异将物质进行分离,物理变化,产物为纯净物 分馏:利用物质沸点(相差在5℃以内)的差异将物质分离,物理变化,产物为混合物
②天然气:主要成份是CH4,重要的化石燃料,也是重要的化工原料(可加热分解制炭黑和H2)
③石油:多种碳氢化合物(烷烃、环烷烃、芳香烃)的混合物,可通过分馏、裂化、裂解、
催化重整进行综合利用
分馏的目的:得到碳原子数目不同的各种油,如液化石油气、汽油、煤油、柴油、重油等 裂化的目的:对重油进行裂化得到轻质油(汽油、煤油、柴油等),产物一定是一个烷烃分子加
一个烯烃分子
裂解的目的:得到重要的化工原料“三烯”(乙烯、丙烯、1,3—丁二烯) 催化重整的目的:得到芳香烃(苯及其同系物)
