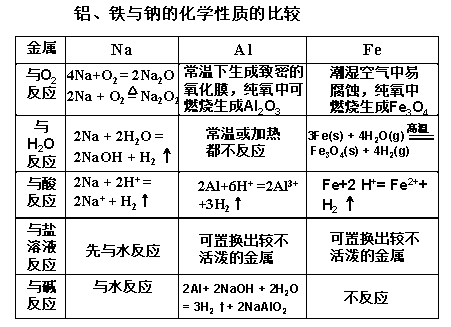
化学必修一第三章知识点总结
1.元素的存在形式有两种:游离态和化合态。
(1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
(2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:
(1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
(2)镁条燃烧发出耀眼的白光,用来做照明弹。
(3)利用铝的良好导电性,做导线。利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。
3.金属化合物的用途:
(1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。
(2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
(3)明矾做净水剂。
4.金属的分类:
(1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。
(2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、钡,密度小于4.5g/cm3的金属是轻金属:如钠、镁、铝。
5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。
(1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。
(2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(3)非金属氧化物分为酸性氧化物、不成盐氧化物。
(4)氧化物(根据氧化物是否与碱或酸反应生成盐)分为成盐氧化物和不成盐氧化物(CO 、NO)。
(5)成盐氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(6)酸性氧化物分为高价态的金属氧化物(Mn2O7)和非金属氧化物(CO2)。
(7)碱性氧化物只能是金属氧化物(CaO)。
(8)两性氧化物只能是金属氧化物(Al2O3 、ZnO)。
6.金属氢氧化物的分类:碱性氢氧化物和两性氢氧化物。
7.含金属阳离子的物质分为金属单质、金属氧化物、金属氢氧化物、金属无氧酸盐、金属含氧酸盐。
8.酸根离子分为三类:
(1)含金属元素的含氧酸根离子(AlO2- 、MnO4-)。
(2)含非金属元素的含氧酸根离子(NO3-)。
(3)含非金属元素的无氧酸根离子(Cl-)等。
9.阳离子分类:
(1)金属阳离子(Na+)和非金属阳离子(H+ 、NH4+)。
(2)阳离子分单一价态阳离子(Na+)和变价态阳离子(Fe2+ 、Fe3+),单一价态的阳离子和最高价态的阳离子只有氧化性,氧化性顺序:Ag+ > Fe3+ > Cu2+ > H+ ;较低价态的金属离子既有氧化性又有还原性,遇到强氧化剂呈还原性,遇到强还原剂呈氧化性。
10.温度不同产物不同的化学方程式:
4Na+O2=2Na2O ; 2Na+O2=Na2O2
11.量不同产物不同的化学方程式:
CO2 + NaOH = NaHCO3 ;CO2+2NaOH =Na2CO3 + H2O
Na2CO3 +HCl =NaHCO3+NaCl;Na2CO3 +2HCl=2NaCl + H2O+CO2↑
NaHCO3+Ca(OH)2=CaCO3+NaOH+H2O;
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+ 2H2O
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
Al2(SO4)3+8NaOH=2NaAlO2+3Na2SO4+4H2O
2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4+K2SO4 ;
KAl(SO4)2+2Ba(OH)2=2H2O+2BaSO4↓+KAlO2
12.物质既能跟强酸反应又能跟强碱反应的的化学方程式:
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ ;2Al+6HCl=2AlCl3+3H2 ↑
Al2O3 +2NaOH=2NaAlO2+H2O ;Al2O3 +6HCl=2AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O ;Al(OH)3+3HCl=AlCl3+3H2O
NaHCO3+ NaOH= Na2CO3 + H2O;NaHCO3+ HCl = NaCl + H2O+CO2↑
13.相互转化的化学方程式
氧化还原反应实例:除去氯化铁中的氯化亚铁: 2FeCl2+Cl2=2FeCl3
氧化还原反应实例:除去氯化亚铁中的氯化铁: 2FeCl3+Fe=3FeCl2
酸碱性实例:除去碳酸氢钠中的碳酸钠: Na2CO3+CO2+H2O=2NaHCO3
酸碱性实例:除去碳酸钠中的碳酸氢钠:
NaHCO3 +NaOH = Na2CO3 + H2O,2NaHCO3= Na2CO3+CO2 ↑+H2O
14.酸碱性强弱区别的化学方程式
硫酸铝溶液中滴入过量的强碱溶液不再有沉淀:
Al2(SO4)3+8NaOH=2NaAlO2+3Na2SO4+4H2O离子方程式:Al3+ +4OH- = AlO2- +2H2O
硫酸铝溶液中滴入过量的弱碱氨水溶液始终有沉淀:
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
离子方程式:Al3+ +3 NH3·H2O =Al(OH)3↓+3NH4+
15.互滴法鉴别无色试剂的实验组:碳酸钠溶液和盐酸,硫酸铝溶液和强碱,偏酸盐溶液和强酸
16.Fe2+的检验:
①取少量待测液于试管中,在试管中滴入可溶性碱溶液,先产生白色沉淀,过一会沉淀变成灰绿色,最终变成红褐色,说明溶液中有Fe2+ 。
②取少量待测液于试管中,在试管中先滴入KSCN溶液,无现象,再滴入氯水,溶液马上变成血红色,说明溶液中有Fe2+。
17.Fe3+的检验:
①取少量待测液于试管中,在试管中滴入可溶性碱溶液,产生红褐色沉淀,说明溶液中有Fe3+ 。
②取少量待测液于试管中,在试管中先滴入KSCN溶液,溶液马上变成血红色,说明溶液中有Fe3+ 。
18.指示剂颜色变化:
①在盛有水的试管里,加入过氧化钠,然后滴入指示剂:酚酞先变红后褪色(紫色石蕊先变蓝后褪色)。
②在盛有水的试管里,加入碳酸钠,然后滴入指示剂:酚酞变红(紫色石蕊变蓝)。
③在盛有水的试管里,加入碳酸氢钠,然后滴入指示剂:酚酞变红(紫色石蕊变蓝)。
19.氯化铁溶液可以止血,氯化铁溶液可以用来腐蚀电路板,饱和氯化铁溶液滴入沸水中可以制备氢氧化铁胶体,铝化铁溶液蒸干得到氢氧化铁,灼烧得到氧化铁。
20.与Fe3+不能共存的离子有:
①发生复分解反应的离子:OH- 。②发生络合反应的离子:SCN- 。③发生双水解反应的离子:CO32- 、HCO3- 。④发生氧化还原反应的离子:S2- 、I- 。
21.与Al3+不能共存的离子有:
①发生复分解反应的离子:OH- 。②发生络合反应的离子:F- 。③发生双水解反应的离子:CO32- 、HCO3- 、S2- 、AlO2- 。
22.与H+不能共存的离子有:
①发生复分解反应产生气体的离子:CO32- 、HCO3- 、(S2- 、HS- 、S2O32- )。
②发生复分解反应产生沉淀的离子:AlO2- 、[SiO32- 、C6H5O- (石炭酸根)]。
③发生复分解反应没有任何现象的离子: OH- 、F- 、ClO- 、(PO43- 、HPO42- 、H2PO4- 、CH3COO- 、HC2O4- 、C2O42- )。
23.与OH-不能共存的离子有:
①发生复分解反应产生气体的离子:NH4+ 。
②发生复分解反应产生沉淀的离子:金属活动顺序表中镁以后的离子:Mg2+ 、 Al3+ 、Fe3+ 、Fe2+ 、Cu2+ 、Ag+ 。
③发生复分解反应没有任何现象的离子: H+ 、HCO3- 、(HS- 、HSO3- 、HPO42- 、H2PO4- 、HC2O4- )。
24.易失电子的物质除了金属外,还含有强还原性的物质:H2S 、K2S 、HI 、KI。
25.原子的最外层只有1个电子的元素有:
(1)H 。(2)Na、 K 、Rb 、Cs 。(3)Cu 、Ag 、Au 。

化学必修一第四章知识点总结
1.非金属元素的种类:在迄今为止发现和合成的112种元素中非金属元素有16种。(依据元素三分法)。
2.非金属元素的存在形式:游离态和化合态两种。
(1)硅元素:只存在化合态,主要以二氧化硅和硅酸盐的形式存在。
(2)氯元素:只存在化合态,主要以氯化钠的形式存在于海水和陆地的盐矿中。
(3)硫元素:游离态存在于火山喷口附近或地壳的岩层里,化合态主要以硫化物和硫酸盐的形式存在,在火山喷出物里含有大量的含硫化合物,如硫化氢、二氧化硫和三氧化硫等;硫还是一种生命元素,组成某些蛋白质时离不开它。
(4)氮元素:游离态主要存在于空气中,化合态主要存在于土壤中,氮元素也是蛋白质的重要组成元素。
3.非金属单质种类与元素种类是两码事,因为存在同素异形体(同一元素形成的不同单质互称同素异形体的缘故)。
(1)氧元素有O2 和O3两种单质形式。
(2)硫元素由单斜硫和斜方硫两种单质形式。
(3)氮元素有N2和N4两种单质形式。
(4)磷元素有红磷和白磷两种单质形式。
(5)碳元素有金刚石、石墨、无定形碳、C60 、C120等多种形式。
4.只由非金属元素构成的化合物种类:离子化合物和共价化合物。
(1)离子化合物主要是:铵盐NH4Cl 、NH4NO3
(2)共价化合物有:
非金属氢化物:CH4、NH3 、H2O、HF
非金属氧化物:CO 、CO2 、NO 、NO2
非金属互化物:CS2、
非金属含氧酸:H2CO3 、H2SiO3
5.非金属元素的化合价推断方法:
画出元素的原子结构示意图,根据最外层电子数就是最高正价数,最外层电子数减去8(或2)得到该元素的最低价态,最低价态和最高价态之间的所有化合价皆有可能形成。
6.非金属元素的化合价规律是:最外层电子数是奇数的元素其化合价通常也是奇数价,最外层电子数是偶数的元素其化合价通常也是偶数价。
氯元素的常见价态:-1 、+1 、+3 、+5 、+7,例外的有+4,例如:二氧化氯(ClO2)。
氮元素的常见价态:-1 、+1 、+3 、+5,例外的有:+2、+4 ,例如:一氧化氮(NO)、二氧化氮(NO2)。
7.特殊的不对应现象:
(1)通常元素一种价态对应一种氧化物,+4价的氮元素例外,有二氧化氮(NO2)和四氧化二氮(N2O4)两种化合物。
(2)通常一种酸酐对应一种含氧酸,SiO2 和P2O5例外
SiO2 —H2SiO3(硅酸) ,SiO2 —H4SiO4(原硅酸)
P2O5—HPO3(偏磷酸),P2O5—H3PO4(磷酸)
8.酸酐与含氧酸的判断方法:
(1)从价态判断:酸酐中非氧元素的价态与含氧酸中成酸元素的价态相同。
(2)从转化关系判断:
①可溶性的含氧酸可以由其酸酐和水反应生成,例如:CO2+H2O=H2CO3 。
②不溶性的含氧酸受热分解生成酸酐和水,例如:H2SiO3=SiO2+H2O 。
(3)利用记忆判断:常见酸酐对应的含氧酸如下:
①碳族元素:CO2 — H2CO3 ;SiO2 —H2SiO3 ,SiO2 —H4SiO4
②氮族元素:N2O3 —HNO2 (亚硝酸);N2O5—HNO3 (硝酸);P2O5—HPO3(偏磷酸),P2O5—H3PO4(磷酸)
③氧族元素:SO2 —H2SO3 (亚硫酸),SO3—H2SO4(硫酸)
④卤素:Cl2O3 —HClO2(亚氯酸);Cl2O5—HClO3 (氯酸);Cl2O7—HClO4(高氯酸);
9.实验室制取下列气体时的收集方法:
(1)只能用排水法收集的是:CO、NO。
(2)只能用向上排空气法收集的是:HCl、NO2 。
(3)只能用用向下排空气法收集的是:NH3 。
(4)既能用排水法收集,也能用向下排空气法收集的是:H2 。
(5)既能用排水法收集,也能用向上排空气法收集的是:O2 。
(6)CO2:既能用向上排空气法收集,也能用排饱和NaHCO3溶液法收集 。
(7)Cl2:既能用向上排空气法收集,也能用排饱和NaCl水法收集 。
(8)SO2:既能用向上排空气法收集,也能用排饱和NaHSO3溶液法收集 。
10.除去气体中的杂质方法归纳:
(1)杂质气体是水蒸气时
①Cl2 (H2O) 、HCl (H2O) 、CO2 (H2O) 、SO2 (H2O) :用酸性干燥剂:浓硫酸、硅胶、硫酸铜,或中性干杂剂:氯化钙。
②H2 (H2O) 、O2 (H2O) 、CO (H2O) :选酸性干燥剂、中性干燥剂、碱性干燥剂。
③NH3 (H2O) :选碱性干燥剂。
(2)杂质气体的酸性比主气体的酸性强时:
除杂规律:选用主气体的酸式盐的饱和溶液,实例如下:
①Cl2 (HCl) :用饱和氯化钠溶液
②CO2 (HCl) :用饱和碳酸氢钠溶液
③SO2 (HCl) :用饱和的亚硫酸氢钠溶液
④CO2 (SO2) :用饱和碳酸氢钠溶液
(3)杂质气体呈酸性时:
H2中的H2S:通过NaOH溶液洗气 。
(4)杂质气体有还原性时:
CO2中的SO2 :通过酸性KMnO4溶液洗气.
11.气体的溶解性排序:H2<O2<CO2<Cl2<H2S<SO2<HCl<NH3。
12.影响气候的气体角色分析:
(1)CO2 、CH4等导致温室效应。
(2)SO2、NO2导致酸雨。
(3)氟氯烃导致臭氧空洞。
(4)有毒、有刺激性的的气体(NO、NO2、NH3、CO、H2S、SO2、Cl2、HCl)都会污染大气。
13.阴离子检验专题:
(1)SO 离子离子检验时,为防止SO 、CO 、PO 等离子的干扰,先将被检验溶液酸化,可以出去SO 、CO 离子,然后在滴入氯化钡溶液,PO 离子不会产生沉淀,只有SO 离子会产生不溶于盐酸的BaSO4沉淀。
(2)SO (HSO3-)离子的检验:滴入稀盐酸,将收集到的有刺激性气味的无色气体通入到品红溶液中,品红溶液褪色,说明溶液中的阴离子是SO (HSO3-)离子。
(3)CO 离子检验:滴入稀盐酸,将收集到无色无味气体通入澄清的石灰水中,澄清的石灰水变浑浊,继续将收集到无色无味气体通入石灰水中,石灰水又变澄清的是CO (HCO )离子。
(4)SiO 离子检验:溶液中滴入过量的盐酸或通入过量的二氧化碳,始终会有胶状无味的白色沉淀生成的是SiO 离子。
(5)AlO2-离子检验:溶液中逐滴滴入盐酸,先看到白色絮状沉淀,后来沉淀溶解,该溶液中不断通入二氧化碳,始终有白色絮状沉淀的溶液中有AlO2-离子。
(6)Cl-离子检验:滴入硝酸银溶液,产生白色沉淀,再滴入硝酸,沉淀不溶解的溶液中含Cl-离子。
14.一种试剂鉴别多种溶液的思考方法:
(1)当被鉴别溶液的阴离子相同阳离子不同时,检验试剂从阴离子角度突破,加入的应该是可溶性强碱溶液。
例如:一次性鉴别分别含有Ag+、NH 、Al3+ 、Mg2+ 、Na+等七种离子的溶液的试剂是氢氧化钠溶液。
(2)当被鉴别溶液的阳离子相同阴离子不同时,检验试剂从阳离子角度突破,加入的应该是可溶性强酸溶液.
例如:一次性鉴别分别含有SO (HSO3-) 、S2- (HS-)、 S2O 、CO (HCO ) 、SiO 、AlO2- 、C6H5O- 、Cl-等八种离子的溶液,鉴别试剂是盐酸。
15. 课本歧化反应归纳:Cl2、NO2、Na2O2与H2O的反应都是歧化反应,H2O既不是氧化剂也不是还原剂,Cl2、NO2、Na2O2既是氧化剂又是还原剂。
16. 氮的固定就是将游离态的氮转变成化合态氮的过程,它分为自然固氮和人工固氮两种。
(1)自然固氮:雷雨放电,将氮气和氧气化合成一氧化氮,豆科植物根瘤菌将游离态的氮转变成化合态的氮。
(2)人工固氮:例如:合成氨。
17.不能由单质之间直接反应制取的是:FeCl2 、CuS ;不能由单质与酸直接反应生成的是:FeCl3 、Cu2S 。
18.纯净物与混合物问题:
(1)气体的液态仍然是纯净物:液氧、液氯、液氮。
(2)复盐、矾类是纯净物:明矾、胆矾、蓝矾、绿矾、皓矾。
(3)新制备的氯水的成分:分子:Cl2 、H2O 、HClO;离子:H+ 、Cl- 、ClO- 、OH-
(4)氨水的成分:分子:NH3 、NH3 ·H2O 、H2O,离子:NH 、 OH-、H+ 。
(5)漂白粉的成分:氯化钙和次氯酸钙,漂白粉的有效成分是次氯酸钙。
(6)王水的成分:浓盐酸和浓硝酸按体积比3:1混合而成。
19.哪些物质中存在单质分子的研究:
(1)氧分子的存在:氧气、液氧、空气中含有氧分子。
(2)氯分子的存在:氯气、液氯、新制备的氯水。
(3)氨分子的存在:氨气、液氨、氨水。
(4)碘分子的存在:固态碘、升华碘、碘水、碘酒。(碘水、碘酒遇淀粉溶液变蓝)
20.应会辨认的物理变化、化学变化:
(1)升华是物理变化:I2的升华。
(2)液体的挥发是物理变化:液Br2的挥发、浓盐酸的挥发、浓硝酸的挥发。
(3)气体的液化是物理变化:NH3的液化、Cl2的液化、SO2的液化、NO2的液化。
(4)下列分离操作是物理变化:过滤、萃取、分液、分馏(石油的分馏)、渗析。
(5)下列漂白是物理变化:活性炭吸附脱色都是物理变化,而二氧化硫、过氧化钠、次氯酸漂白是化学变化。
(6)锅炉的爆炸是物理变化,而可燃性气体与氧化剂燃烧爆炸是化学变化。
(7)钝化是一种化学变化,是铁、铝等金属在常温下遇到冷的浓硫酸或浓硝酸发生化学反应在金属表面生成一种致密的氧化物薄膜,从而阻止酸进一步与金属反应的现象。
21.制备Al(OH)3的方法选择:
(1)实验室用Al2(SO4)3反应制取Al(OH)3,最合适的试剂是氨水;过量的强碱溶解掉部分或全部氢氧化铝,所以不能用强碱溶液作铝盐的沉淀剂。
(2)实验室用NaAlO2反应制取Al(OH)3,最合适的试剂是干冰;过量的强酸溶解掉部分或全部氢氧化铝,所以不能用强酸做偏铝酸盐的沉淀剂。
22.指示剂的颜色变化:
(1)新制备的氯水中滴入紫色石蕊:先变红后褪色,变红是盐酸在起作用,褪色是次氯酸的氧化性在起作用。
(2)浓硫酸中滴入紫色石蕊:先变红后变黑,变红是硫酸的酸性在起作用,变黑是浓硫酸的脱水性在起作用。
(3)亚硫酸中滴入紫色石蕊:变红不褪色,变红是亚硫酸的酸性在起作用,不褪色是由于二氧化硫的漂白性对紫色石蕊不起作用。
(4)浓硝酸中滴入紫色石蕊:先变红后褪色,变红是硝酸的酸性在起作用,褪色是硝酸的氧化性在起作用。
(5)稀硝酸中滴入紫色石蕊:先变红后褪色,变红是硝酸的酸性在起作用,褪色是硝酸的氧化性在起作用。
23.不能共存的气体组:
(1)酸碱性不能共存的气体有:HCl和NH3 。
(2)因为发生氧化还原反应而不能共存的气体有:NO和O2 。
24.二氧化碳的化学性质:
(1)酸酐的通性:
①与水反应生成含氧酸(碳酸):CO2+H2O=H2CO3
②与碱性氧化物反应生成含氧酸盐: CO2+CaO=CaCO3
③与碱反应生成盐和水:
CO2+Ca(OH)2=CaCO3 ↓+H2O; 2CO2+Ca(OH)2= Ca(HCO3)2
(2)弱氧化性:
CO2+C=2CO ; CO2+2Mg=2MgO+C
25.碳酸的化学性质:
(1)滴入紫色石蕊变红。
(2)碱与碳酸反应生成碳酸盐和水(注意:反应物的量不同产物不同)。
H2CO3+Ca(OH)2=CaCO3↓+2H2O ;2H2CO3 + Ca(OH)2=Ca(HCO3)2+2H2O
(3)弱酸盐与碳酸反应生成弱酸和碳酸盐。
①加入碳酸后有沉淀产生,碳酸过量沉淀消失的溶液是:次氯酸钙溶液。
②加入碳酸后有沉淀产生,碳酸过量沉淀不消失的溶液是:硅酸钠溶液、偏铝酸钠溶液。
26.二氧化硅的化学性质:
(1)酸酐:
SiO2+CaO=CaSiO3 SiO2+2NaOH=Na2SiO3 +H2O
(2)弱氧化性: SiO2+C=2CO+Si
(3)特性: SiO2+4HF=SiF4 ↑+2H2O
(4)高熔沸点: SiO2+Na2CO3 = CO2+Na2SiO3 ;SiO2+CaCO3 = CO2+CaSiO3
27.硅酸的不稳定性 H2SiO3 =H2O+ SiO2
28.二氧化硫的化学性质:
(1)酸酐: SO2+H2O=H2SO3 ; SO2+CaO=CaSO3;
SO2+Ca(OH)2=CaSO3 ↓+H2O; 2SO2+Ca(OH)2= Ca(HSO3)2
(2)弱氧化性: SO2+2H2S=3S+2H2O
(3)还原性: 2SO2+O2=2SO3 ;SO2+Cl2+2H2O=H2SO4+2HCl
(4)特性: 漂白性使品红溶液褪色,加热颜色又出现
29.浓硫酸的化学性质:
(1)脱水性: C12H22O11=12C +11H2O
(2)强氧化性:C+2H2SO4(浓)=CO2 ↑+2SO2 ↑+2H2O
(3)酸性和强氧化性:Cu+2H2SO4(浓)=CuSO4+SO2 ↑+2H2O
(4)酸性和难挥发性:NaCl+ H2SO4(浓)=NaHSO4+HCl↑
30.硝酸的化学性质
(1)酸性和强氧化性:Cu+4HNO3(浓)=Cu(NO3)2+NO2 ↑+2H2O
(2)强氧化性:C+4HNO3(浓)=CO2 ↑+4NO2 ↑+2H2O
