大题专攻 高三化学实验探究题
1、某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为
。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ。实验Ⅰ、Ⅱ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② .
2、某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置进行有关实验:
(1)先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
, ;
 ②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
③实验结束后,装置C中的溶液中可能含有的溶质有 ;
(2)事实表明,上述反应全部结束后,硫酸仍有剩余。为定量测定剩余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定剩余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请你写出其中的一种
;
②乙学生设计的方案是:将反应后的溶液冷却后全部移入100mL容量瓶中并加蒸馏水定容,取20ml于锥形瓶中,用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量的浓度。你认为乙学生设计的实验方案能否准确求得余酸的物质的量的浓度
(填“能”或“否”),理由是 。
3、某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:

I.⑴某同学根据数据推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的推测是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________。
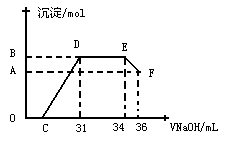 II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴图中OC段没有沉淀生成,此阶段
发生反应的离子方程式为 。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;
⑶B与A的差值为 mol。
⑷B点对应沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL
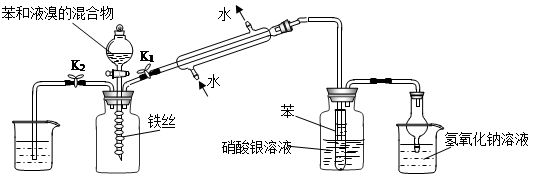 4、某校学生为探究苯与溴发生反应的原理,用如图装置进行实验。
4、某校学生为探究苯与溴发生反应的原理,用如图装置进行实验。
(I) (II) (III) (IV)
根据相关知识回答下列问题:
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(Ⅲ)中可能观察的现象是 。
(2)整套实验装置中能防止倒吸的装置有 (填装置序号)。
(3)反应结束后要使装置I中的水倒吸入装置Ⅱ中。这样操作的目的是
,简述这一操作方法
。
(4)你认为通过该实验后,有关苯跟溴反应的原理方面能得出的结论是
。
5、目前世界上比较先进的电解制碱技术是离子交换膜法,如图为离子交换膜法电解饱和食盐水的原理示意图。
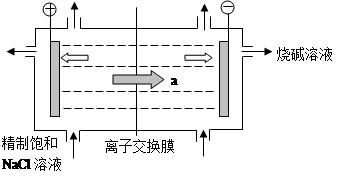
(1)透过交换膜的离子a是 ;
 (2)现有离子交换膜A和B将电解槽分为I、II、Ⅲ三个区域(如下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为 离子交换膜、B为 离子交换膜(填“阳”或“阴”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”或“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。
(2)现有离子交换膜A和B将电解槽分为I、II、Ⅲ三个区域(如下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为 离子交换膜、B为 离子交换膜(填“阳”或“阴”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”或“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。
6、下图是工业制取Cr2O3流程图。已知:溶液A中含Na2CrO4和NaFeO2;D是实验室常用的氧化剂;“氧化碱熔”是指在通入空气条件下跟Na2CO3共熔。

(1)写出框图中有关物质的化学式:B 、D 、F ;
(2)写出有关的反应式:铬铁矿→A 、
E→F 。
7、某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将0.499g X隔绝空气在1000℃以上强热,得到一种红色固体Y,质量为0.316g。Y溶于酸得到另一种红色固体0.141g。
(1)该实验人员认为沉淀X可能含有SO42-。请设计一个简单实验确定这一判断。
(2)通过计算确定X和Y的化学式。
(3)混合时CuSO4和NaOH溶液的体积比为 ;写出X→Y的反应方程式
。
【答案】1、实验Ⅰ:氢氧化铁胶体(或胶体)(1分);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生(2分);Fe3++3SCN-=Fe(SCN)3(1分);Ba2++SO42-=BaSO4↓(1分)。实验Ⅱ:Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO32-有较强的还原性,CO32-没有还原性(1分);
②SO32-水解能力较CO32-小(1分)。
2、①Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O, (2分)
CuSO4 + SO2↑+ 2H2O, (2分)
2Cu+2H2SO4+O2=2CuSO4+2H2O (2分) ②B装置中导气管长进短出 (2分)
③Na2SO3、Na2SO4、NaOH (2分)
(2)①在通入O2之前,用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(2分)
②否 (1分) 用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu2+的蓝色会干扰滴定终点的正确判断(2分)
3、Ⅰ⑴合理 (1分) ⑵NaOH溶液 (1分)
Ⅱ⑴H++OH-=H2O (1分) ⑵ NH4++OH-=NH3·H2O (1分)
⑶0.008 (1分) ⑷0.032mol (2分) 7mL (2分)
4、小试管中有气泡,液体变棕黄色(1分);有白雾出现(1分);广口瓶内溶液中有浅黄色沉淀生成(1分)
(2)III和IV(1分)
(3)反应结束后装置II中存在大量的溴化氢,使I的水倒吸入II中可以除去溴化氢气体,以免逸出污染空气(1分);开启K2,关闭K1和分液漏斗活塞(1分)
(4)苯跟溴能发生取代反应(2分)
5、(6分)(1)Na+(1分)
(2)阳(1分);阴(1分);II(1分);2H2O+2e-=H2+2OH-(1分);H2SO4溶液(1分)
6、(1)B、Fe(OH)3;D、K2Cr2O7;F、Cr2O3(每个2分)
(2)4Fe(CrO2)2+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑(1分)
8Na2CrO4+2Fe2O3+8CO2↑(1分)
Fe2O3+Na2CO3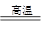 2NaFeO2+CO2↑(1分)
2NaFeO2+CO2↑(1分)
或4Fe(CrO2)2+10Na2CO3+7O2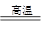 8Na2CrO4+2NaFeO2+10CO2↑(2分)
8Na2CrO4+2NaFeO2+10CO2↑(2分)
4CrO3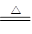 2Cr2O3+3O2(2分)(不配平不给分)
2Cr2O3+3O2(2分)(不配平不给分)
7、(1)把绿色沉淀X用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO42-后(1分),用稀盐酸溶解绿色沉淀(1分),此时再用BaCl2溶液检验,溶解液中有大量白色沉淀生成,则说明沉淀X中有SO42-(1分)
(2)因为Cu2O∶Cu=0.316∶0.141(1分) 可判断Y为Cu2O(1分)
根据硫酸铜溶液跟氢氧化钠溶液混合生成沉淀,可设沉淀组成为mCu(OH)2·nCuSO4,则有(97.55m+159.62n)∶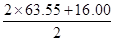 (m+n)=0.499∶0.316(1分)
(m+n)=0.499∶0.316(1分)
即可得m∶n=3∶1(1分)所以X为3Cu(OH)2·CuSO4或Cu4(OH)6SO4(1分)
(3)4∶3(1分)Cu4(OH)6SO4 2Cu2O+3H2O+SO3+O2
2Cu2O+3H2O+SO3+O2
第二篇:实验中探究化学-重结晶实验思考题
与诺贝尔Nobel奖紧密相关的分离技术——重结晶(马荔2011.2)
第一部分 思考题
A组
1、哪些诺贝尔化学奖与分离技术有关?讲一个体现科学精神和能够体现科学研究的故事。
2、化学中分离技术有哪些?简单介绍一下超临界萃取技术和膜分离技术。
3、提纯、重结晶实验中有哪些基本操作,注意事项是什么?
4、“海盐提纯为纯食盐”的实验中用到了哪些化学原理?详细说明。
5、根据下列给出药品,自行设计用结晶提纯的方法得到纯产品并确定杂质已除去。(小组可以在实验室中完成的重结晶实验。)
设计中要求:
(1)步骤尽量详细!(原理、实验中用到的数据、步骤、记录表格等等)
(2)哪一个是需要得到的,哪一个是杂质自行设定
(3)注意要检验杂质是否除去?
(4)实验室提供的主要药品:食盐、味精、白糖、红糖、活性炭、NaCl、CuSO4·5H2O、NH4Cl、(NH4)2SO4、CaCl2、FeCl3、Na2SO4、NaNO3、Na2CO3、NaHCO3、MgCl2、NaAc、Al2(SO4)3、(NH4)2Fe(SO4)2、NaOH、KI、KNO3、ZnCl2、ZnAc2、Na2SO3、Na3PO4、Na2HPO4、CoCl2、NiCl2、AgNO3、MnSO4、KCl、KCr(SO4)2、Na2C2O4、H2C2O4
B组
1、根据你的了解,生活中用到了哪些分离方法?举出至少两个具体事例加以说明
2、重结晶提纯物质的原理是什么?以NaNO3和KCl混合制得KNO3和NaCl为例说明。
3、粗硫酸铜中含有铁杂质,除去其中的杂质并得到硫酸铜晶体,提出设计实验的思路。
4、“海盐提纯为纯食盐”的实验中,你怎样知道杂质已经除去了?实验过程中和得到产品后都是怎样检验的?
5、根据下列给出药品,自行设计用结晶提纯的方法得到纯产品并确定杂质已除去。(小组可以在实验室中完成的重结晶实验。)
设计中要求:
(1)步骤尽量详细!(原理、实验中用到的数据、步骤、记录表格等等)
(2)哪一个是需要得到的,哪一个是杂质自行设定
(3)可以参考实验提纯食盐,注意要检验杂质是否除去?
(4)实验室提供的主要药品:食盐、味精、白糖、红糖、活性炭、NaCl、CuSO4·5H2O、NH4Cl、(NH4)2SO4、CaCl2、FeCl3、Na2SO4、Na2CO3、NaNO3、NaHCO3、MgCl2、NaAc、Al2(SO4)3、(NH4)2Fe(SO4)2、NaOH、KI、KNO3、ZnCl2、ZnAc2、Na2SO3、Na3PO4、Na2HPO4、CoCl2、NiCl2、AgNO3、MnSO4、KCl、KCr(SO4)2、Na2C2O4、H2C2O4
参考资料:
1.实验化学(上册)(第二版),陈虹锦主编,科学出版社;
2.居里夫人传,第十二章、十三章;
3.图书馆中的:无机化学实验、普通化学实验等等
第二部分 设计实验样板参考——氯化钠的提纯
实验目的
1.学习提纯食盐的原理和方法及有关离子的鉴定方法。
2.掌握溶解、过滤、蒸发、浓缩、结晶、干燥等基本操作。
实验原理
粗的无机盐中含有不溶性杂质(如泥沙等)和可溶性杂质,不溶性杂质可通过溶解过滤的方法除去,可溶性杂质主要是Ca2+、Mg2+、K+和SO42-等离子,可以通过两种方法除去。其一是选择适当的试剂使它们生成难溶化合物的沉淀而被过滤除去,如食盐中的Ca2+、Mg2+、SO42-离子;其二可以利用不同温度、不同的量的情况下溶解度的不同而予以去除,如食盐中的K+离子。
首先,可在粗盐溶液中加入稍微过量的BaCl2溶液,先除去SO42-:
Ba2+ + SO42- = BaSO4(s)
将溶液过滤,除去BaSO4沉淀,再在所得滤液(称滤液1,以后类推)中加入NaOH和Na2CO3混合液,以除去Ca2+、Mg2+和过量的Ba2+。
Mg2+ + 2OH- = Mg(OH)2(s)
Ca2+ + CO32- = CaCO3(s)
Ba2+ + CO32- = BaCO3(s)
过滤除去沉淀,滤液2中过量的NaOH和Na2CO3,可以用纯盐酸中和除去。
粗盐中的K+和上述的沉淀剂都不起作用,但由于KCl的含量较少,因此在蒸发浓缩溶液的过程中,NaCl先结晶出来,而KCl则留在母液中。
本实验涉及到溶度积规则分步沉淀方法的应用,涉及到多项无机化学实验的基本操作。
实验步骤
1.粗食盐的提纯
在托盘天平上称取8.0g粗食盐,放在100cm3烧杯中,加水约30cm3,用玻璃棒搅拌,使其溶解。加热溶液至溶液沸腾时,边搅拌边逐滴加入1mol·dm-3BaCl2,至沉淀完全(约需2cm3),继续小火加热5分钟,使BaSO4的颗粒长大而易于沉降和过滤。为了检验沉淀是否完全,可将烧杯从石棉网上取下,待沉淀下降后,用滴管吸取少量上层清液,放在试管中,滴加几滴6mol·dm-3HCl再加几滴1 mol·dm-3BaCl2,如果出现混浊,表示SO42-尚未除尽,需要再加BaCl2溶液。如果不出现混浊,表示SO42-已除尽,用普通漏斗进行过滤。
在滤液1中加入1cm36mol·dm-3NaOH和2cm3饱和Na2CO3,加热至沸,同上述方法检查沉淀是否完全。如果不再产生沉淀,用普通漏斗将溶液过滤。
在滤液2中逐滴加入6mol·dm-3HCl,并用玻棒蘸取液滴在pH试纸上试验,直至溶液呈微酸性为止(pH»6)。将溶液倒入蒸发皿中,用小火加热蒸发,浓缩至稀浆状的稠液为止,但切不可将溶液蒸干。冷却后,用布氏漏斗过滤,尽量将晶体中水分抽干。将晶体转移回蒸发皿中,在石棉网上用小火加热烘干,直至不冒水汽为止。将所得精盐冷至室温,称重。最后把精食盐放入干燥器中以备下次实验测定C1-离子含量用。
产率可按下式计算:
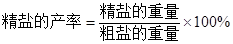
2.产品纯度的检验
取精、粗盐各1克,分别溶于5cm3蒸馏水中(如果过于混浊,将粗盐溶液过滤)。再将二种澄清溶液分别盛于三支小试管中,组成三组,对照检验它们的纯度。
(1)SO42-的检验:在第一组溶液中分别加入2滴6mol·dm-3HCl,使溶液呈酸性,再加入3~5滴1mol·dm-3BaCl2。如有白色沉淀,证明有SO42-存在。
(2)Ca2+的检验:在第二组溶液中分别加入2滴6mol·dm-3HAc,使溶液呈酸性,再加入3~5滴饱和的(NH4)2C2O4溶液。如有白色CaC2O4沉淀生成,证明有Ca2+存在〔1〕。
(3)Mg2+的检验:在第三组溶液中分别加入3~5滴6 mol·dm-3NaOH,使溶液呈碱性,再加入1滴镁试剂I[2],若有天蓝色沉淀生成证明有Mg2+存在。
将以上实验现象列表比较并讨论之。
实验指导
[1]Ca2+与C2O42-反应,生成白色沉淀,为一种弱酸盐这种沉淀难溶于醋酸,易溶于盐酸:
Ca2++C2O42-=CaC2O4(s)
[2]镁试剂I为对硝基苯偶氮间苯二酚,在酸性溶溶中为黄色,在碱性溶液中呈红色或紫色。Mg2+与镁试剂I在碱性介质中反应生成兰色螯合物沉淀。由镁试剂检验Mg2+离子极为灵敏,最低检出浓度为十万分之一。
思考题
1.溶解8.0g食盐加水30cm3的依据是什么?加水过多或过少对实验有什么影响?
2.在沉淀Ca2+、Mg2+离子时为何要加NaOH和Na2CO3的混合液,单独加Na2CO3行吗?为什么?
3.实验中怎样除去过量的沉淀剂BaCl2、NaOH和Na2CO3?
4.提纯后的食盐溶液浓缩时为什么不能蒸干?
5.在检验SO42-时,为什么要加入盐酸溶液?
6.检验Ca2+时,加(NH4)2C2O4生成CaCO3白色沉淀,为何同时要加入HAc?加HCl行吗?
7.若食盐中钾离子的量较大,在分离时要注意什么?
