有机化学期末复习总结
一、有机化合物的命名
命名是学习有机化学的“语言”,因此,要求学习者必须掌握。有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式。
1、 俗名及缩写 : 要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、
甘油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酐、甘氨酸、丙氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等。还应熟悉一些常见的缩写及商品名称所代表的化合物,如:RNA、DNA、阿司匹林、福尔马林、尼古丁等。
2、习惯命名法:要求掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,
掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。
3、系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则。其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视。要牢记命名中所遵循的“次序规则”。
4、次序规则:次序规则是各种取代基按照优先顺序排列的规则
(1)原子:原子序数大的排在前面,同位素质量数大的优先。几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H
(2)饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推。常见的烃基优先次序为:(CH3)3C->(CH3)2CH->CH3CH2->CH3-
(3)不饱和基团:可看作是与两个或三个相同的原子相连。不饱和烃基的优先次序为: -C≡CH>-CH=CH2>(CH3)2CH-
次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名
烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出。
按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基 >丁基>丙基>乙基>甲基。
(1) 、几何异构体的命名:烯烃几何异构体的命名包括顺、反和Z、E两种方法。
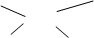
简单的化合物可以用顺反表示,也可以用Z、E表示。用顺反表示时,相同的原子或基团在双键碳原子同侧的为顺式,反之为反式。如果双键碳原子上所连四个基团都不相同时,不能用顺反表示,只能用Z、E表示。按照“次序规则”比较两对基团的优先顺序,较优基团在双键碳原子同侧的为Z型,反之为E型。必须注意,顺、反和Z、E是两种不同的表示方法,不存在必然的内在联系。有的化合物可以用顺反表示,也可以用Z、E表示,顺式的不一定是Z型,反式的不一定是E型。例如:
 CH3-CH2 Br
CH3-CH2 Br
C=C (反式,Z型)
H CH2-CH3
 CH3-CH2 CH3
CH3-CH2 CH3
C=C (反式,E型)
H CH2-CH3
脂环化合物也存在顺反异构体,两个取代基在环平面的同侧为顺式,反之为反式。
双官能团化合物的命名:双官能团和多官能团化合物的命名关键是确定
母体。常见的有以下几种情况:
① 当卤素和硝基与其它官能团并存时,把卤素和硝基作为取代基,其它官能团为母体。
② 当双键与羟基、羰基、羧基并存时,不以烯烃为母体,而是以醇、醛、酮、羧酸为母体。
③ 当羟基与羰基并存时,以醛、酮为母体。
④ 当羰基与羧基并存时,以羧酸为母体。
⑤ 当双键与三键并存时,应选择既含有双键又含有三键的最长碳链为主链,编号时给双键或三键以尽可能低的数字,如果双键与三键的位次数相同,则应给双键以最低编号。
官能团的优先顺序:-COOH(羧基)>-SO3H(磺酸基) > -COOR(酯基)>-COX(卤基甲酰基) > -CONH2 (氨基甲酰基) > -CN (氰基)> -CHO(醛基)> -CO- (羰基)> -OH(醇羟基)> -OH (酚羟基) >-SH (巯基)> -NH2(氨基) > -O- (醚基)> 双键 > 叁键
(4)、杂环化合物的命名 由于大部分杂环母核是由外文名称音译而来,所以,一般采用音译法。要注意取代基的编号。
二、有机化合物的基本反应
1、加成反应:根据反应历程不同分为亲电加成、亲核加成和游离基加成。
(1) 、亲电加成:由亲电试剂的进攻而进行的加成反应。要求掌握不对称烯烃进行
亲电加成反应时所遵循的马氏规则,即试剂中带正电核的部分加到含氢较多的双键碳原子上,而负性部分加到含氢较少的双键碳原子上。烯烃加卤素、卤化氢、硫酸、次卤酸、水,炔烃加卤素、卤化氢、水以及共轭双烯的1,2和1,4加成都是亲电加成反应。烯烃进行亲电加成反应时,双键上电子云密度越大,反应越容易进行。
(2)、亲核加成:由亲核试剂进攻而进行的加成反应。要掌握亲核试剂的概念、亲核加成反应的历程(简单加成及加成─消除)、不同结构的羰基化合物进行亲核加成反应的活性顺序及影响反应活性的因素。羰基化合物与氰氢酸、亚硫酸氢钠、醇、格氏试剂、氨及氨衍生物的加成都是亲核加成反应。 羰基化合物进行亲核加成反应的活性顺序为:
HCHO>CH3CHO>RCHO>C6H5CHO>CH3COCH3>RCOCH3>C6H5COCH3>C6H5COC6H5
(3)、自由基加成:由自由基引发而进行的加成反应。烯烃在过氧化物存在下与溴化氢进行的加成是自由基加成。不对称烯烃与溴化氢进行自由基加成时得到反马氏规则的产物,即氢加到含氢较少的双键碳原子上。
加成反应除上述三种类型之外,还有不饱和烃的催化氢化,共轭二烯的双烯合成等。
2、消除反应 从一个化合物分子中脱去较小分子(如H2O、HX、NH3) 而形成 双键或三键的反应叫消除反应。卤代烃脱卤化氢和醇脱水是重要的消除反应。
(1)、卤代烃脱卤化氢:卤代烃的消除反应是在强碱性条件下进行。不同结构的卤代烃进行消除反应的活性顺序为:三级>二级>一级。要掌握卤代烃进行消除反应时所遵循的查依采夫规则,当卤代烃中不只含有一个β碳时,消除时脱去含氢少的β碳上的氢原子,或者说总是生成双键碳上连有烃基较多的烯烃,亦即仲卤代烷和伯卤代烷发生消去反应时, 主要生成双键上连接烃基最多的烯烃。要注意,卤代烃的消除和水解是竞争反应。
(2)、醇的消除:醇的消除反应在强酸性条件下进行,消除方向也遵循查依采夫规则。要掌握不同结构的醇进行消除反应的活性顺序:叔醇>仲醇>伯醇。
3、取代反应 根据反应历程的不同可分为亲电取代、亲核取代、游离基取代。
⑴、亲电取代:由于亲电试剂的进攻而引发的取代反应称亲电取代反应。苯环上的卤化、硝化、磺化、付氏烷基化和酰基化以及重氮盐的偶合反应等,都是亲电取代反应,萘环和芳香杂环上也能发生亲电取代反应。要注意苯环上有致钝基团时不能进行付氏反应,苯环上进行烷基化时会发生异构化现象。掌握萘环上进行亲电取代反应的规律,第一个取代基主要进入α位,第二个取代基是进入同环还是异环由原取代基的定位效应决定。掌握五员、六员芳香杂环化合物的亲电取代反应以及它们与苯环比较进行亲电取代反应活性的差异,呋喃、噻吩、吡咯进行亲电取代反应的活性比苯大,而吡啶比苯小。
⑵、亲核取代 由亲核试剂的进攻而引起的取代反应称亲核取代反应。卤代烃的水解、醇解、氰解、氨解,醇与氢卤酸的反应,醚键的断裂,羧酸衍生物的水解、醇解、氨解等都是亲核取代反应。卤代烃的亲核取代反应可按两种历程进行,单分子历程(SN1)和双分子历程(SN2),伯卤代烃易按SN2历程反应,叔卤代烃一般按SN1历程反应,仲卤代烃则两者兼而有之。要在理解反应历程的基础上掌握不同卤代烃进行亲核取代反应的活性,SN1反应支链越多活性越强,反应速率越快,SN2反应支链越多,反应活性越弱,反应速率越慢。如:下列化合物按SN1历程反应的活性由大到小排序为:(CH3)3CI > (CH3)3CBr > (CH3)2CHBr。 要注意,在碱性条件下卤代烃的取代和消除是互相竞争的反应,叔卤代烃容易发生消除,伯卤代烃易发生取代,强极性溶剂(如水)有利于取代,而弱极性溶剂(如醇)和强碱(如醇钠)有利于消除,高温有利于消除。
⑶、自由基取代:由自由基的引发而进行的取代称自由基取代。烷烃的卤代,烯烃和烷基苯的α卤代是自由基取代反应。反应条件是高温、光照或过氧化物存在。自由基的稳定性和中心碳原子上所连的烷基数目有关,烷基越多,稳定性越大。自由基的稳定次序为:
三级>二级>一级>·CH3
4、氧化还原反应 包括氧化反应和还原反应两种类型。
⑴、氧化反应 烯、炔、芳烃侧链以及醇、酚、醛、酮等都易发生氧化反应要掌握几种常用的氧化剂,如高锰酸钾、重铬酸钾的硫酸溶液、氧气(空气)、臭氧以及托伦试剂、斐林试剂、次卤酸钠等。掌握氧化反应在实际中的应用,如臭氧氧化可用来推测烯烃的结构,托伦试剂和斐林试剂的氧化可用来鉴别醛和酮等。
⑵、还原反应 不饱和烃的催化氢化、醛、酮、羧酸及酯还原为醇,硝基苯还原为苯胺等都是还原反应。要掌握几种常用的还原剂,如H2/Ni、 Na+C2H5OH、Fe+HCl、NaBH4、、 、LiAlH4、异丙醇/异丙醇铝等,注意后面三种是提供负氢离子的还原剂,只对羰基选择加氢,与双键、三键不发生作用。还要掌握羰基还原为亚甲基的两种方法,注意,进行克莱门森还原时反应物分子中不能存在对酸敏感的基团,如醇羟基、双键等,用伍尔夫─吉日聂尔还原及黄鸣龙改进法时,反应物分子中不能带有对碱敏感的基团,如卤素等。
5、缩合反应 主要包括羟醛缩合和酯缩合。
(1)羟醛缩合 含有α氢的醛在稀碱条件下生成β—羟基醛,此化合物不稳定
受热容易脱水,生成α、β不饱和醛。因此,此反应常用来增长碳链制备α、β不饱和醛。要求掌握羟醛缩合的反应条件。
(2)克莱森酯缩合 含有α氢的酯在强碱条件下发生克莱森酯缩合,两分子酯之间脱去一分子醇生成β酮酸酯。要掌握反应条件及在实际中的应用,有机合成中广泛应用的乙酰乙酸乙酯就是通过此反应制备的。
除了上述五种类型的反应之外,还要求掌握重氮化反应、芳香重氮盐的取代反应、脱羧反应等,注意反应条件、产物及其在实际中的应用。
三、有机化合物的转化及合成方法
要求掌握有机化合物各类官能团之间的转化关系、增长和缩短碳的方法,在此基础上设计简单有机化合物的合成路线。熟练掌握苯进行付氏烷基化、酰基化、炔化物的烃化、羟醛缩合、格氏试剂法等都可以增长碳链;炔化物的烃化、格氏试剂法及芳香重氮盐等在有机合成中应用非常广泛。
1、炔化物的烃化 具有炔氢的炔烃与氨基钠作用得炔钠,炔钠与伯卤代烃反应得到烷基取代得炔烃。此反应可增长碳链,制备高级炔烃。
2、格氏试剂法 格氏试剂在有机合成中应用极为广泛,它与环氧乙烷、醛、酮、酯反应可用来制备不同结构的醇等。这些反应既可增长碳链,又可形成所需的官能团。
3、重氮盐取代法 芳香重氮盐的重氮基可被氢原子、卤素、羟基、氰基取代,由于苯环上原有取代基定位效应的影响而使某些基团不能直接引入苯环时,可采用重氮盐取代的方法。要注意被不同基团取代时的反应条件。
四、有机化学的知识点
1、两类定位基:
邻对位定位基:使新进入的取代基主要进入它的邻位和对位(邻位和对位异构体之和大于60%);同时一般使苯环活化(卤素等例外)。例如—O-,—N(CH3)2,—NH2,—OH,OCH3,—NHCOCH3,—OCOCH3,—R,—X(Cl,Br,I),—C6H5等。
间位定位基:使新进入的取代基主要进入它的间位(间位异构体大于40%);同时使苯环钝化。例如—N(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—NH3等。
2、两类电子基:
吸电子基:使电子云密度减小的基团,如-COOH,-COOR,-NO2,-X,-HSO3,-CHO,-CO-R等。
供电子基:使电子云密度增大的基团,如-R,-OH,-OR,-NH2,-NHCOR等。
3、相同C原子有机物的熔沸点:支链越多沸点越低,对称性越高,熔点越高,如下列化合物沸点由低到高排列为:正戊烷 < 3,3-二甲基戊烷 < 2-甲基己烷 <正庚烷 < 2-甲基庚烷。
五、有机化合物的鉴别
烯烃、二烯、炔烃及三、四元的脂环烃:溴的四氯化碳溶液,溴腿色
含有炔氢的炔烃:硝酸银或氯化亚铜的氨溶液,生成炔化银白色沉淀或炔化亚铜红色沉淀。
卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
醇:与金属钠反应放出氢气(鉴别6个碳原子以下的醇);用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
酚或烯醇类化合物:用三氯化铁溶液产生颜色。苯酚与溴水生成三溴苯酚白色沉淀。
 羰基化合物:2,4-二硝基苯肼,产生黄色或橙红色沉淀;区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;鉴别甲基酮和具有CH3—CH—结构的醇用碘的氢氧化钠溶液,
羰基化合物:2,4-二硝基苯肼,产生黄色或橙红色沉淀;区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;鉴别甲基酮和具有CH3—CH—结构的醇用碘的氢氧化钠溶液,
生成黄色的碘仿沉淀。
甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
胺:区别伯、仲、叔胺有两仲方法
1. 用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
2. 用NaNO2+HCl:
脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。
芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
糖:葡萄糖与果糖:用溴水,葡萄糖能使溴水腿色,而果糖不能。
麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
第二篇:有机化学方程式总结
高中有机化学方程式总结
一、烃
1.甲烷
烷烃通式:CnH2n-2
(1)氧化反应
甲烷的燃烧:CH点燃
4+2O2甲烷不可使酸性高锰酸钾溶液及溴水褪色。
2+2H2O
(2)取代反应
一氯甲烷:CH光
4+Cl2二氯甲烷:CHCl+Cl 光
CH3Cl+HCl
32
三氯甲烷:CH 光
CH2Cl2+HCl
2Cl2+Cl2 CHCl3+HCl(CHCl3又叫氯仿)四氯化碳:CHCl 光
3+ClCCl42.乙烯
+HCl
乙烯的制取:CHCH浓硫酸
32OH 170℃H2C=CH2↑+H2O
烯烃通式:C
nH2n
(1)氧化反应
高温
乙烯的燃烧:H2C=CH2+3O22CO2+2H2乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
O
(2)加成反应
与溴水加成:H
2C=CH2+Br与氢气加成:H 催
化剂 CH2Br—CH2Br
2C=CH2+H2CH3CH3
与氯化氢加成:H△
2C=CH2CH3CH2Cl
与水加成:H
2C=CH2+H2CH3CH2OH
(3)聚合反应
乙烯加聚,生成聚乙烯:n H2C=CH 2 - CH 3.乙炔
n 乙炔的制取:CaC
2+2H2
HC?CH↑+Ca(OH)2(1)氧化反应
乙炔的燃烧:HC点燃
?CH+5O2 4CO2+2H2O
乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应
与溴水加成:HC?CH+Br
2
Br Br
CHBr=CHBr+Br
2CHBr2—CHBr2
与氢气加成:HC?CH+H
2与氯化氢加成:HC H2C=CH2
催化剂
?△ CH2=CHCl
(3)聚合反应
氯乙烯加聚,得到聚氯乙烯:nCH2 2 — n
乙炔加聚,得到聚乙炔:n HC?4.苯
n
苯的同系物通式:CnH2n-6
(1)氧化反应
苯的燃烧:2C+15O点燃
6H62
12CO2+6H2O
图1 乙烯的制取
图2 乙炔的制取
- 1 -
苯不能使溴水和酸性高锰酸钾溶液褪色。 (2)取代反应 ①苯与溴反应
Br
+Br +HBr
(溴苯)
②硝化反应
浓H2SO4 NO2
+HO—NO2 60
+H2O ℃
(硝基苯) (3)加成反应
+3H (环己烷)。
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质: 5.甲苯
- 2 -
(1)氧化反应
甲苯的燃烧:C点燃
7H8+9O2
7CO2+4H2甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
O
(2)取代反应
CH 3
CH3 浓硫酸 N +3HNO—NO32
2
+3H2O
NO2
甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、开矿等。 6.溴乙烷
(1)取代反应
溴乙烷的水解:CBr+H
2H5—2C2H5—(2)消去反应
OH+HBr
溴乙烷与NaOH溶液反应:CH醇
3CH2△ CH2=CH2↑+NaBr+H2O 7.乙醇
(1)与钠反应
乙醇与钠反应:2CH
3CH22CH3CH2ONa+H2↑(乙醇钠)
(2)氧化反应
乙醇的燃烧:2CH催化剂△
3CH2OH+O22CH3CHO+2H2O (乙醛) (3)消去反应
乙醇在浓硫酸做催化剂的条件下,加热到170℃生成乙烯。
注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚。 2C2H5OH 浓硫酸
C2H5—O—C2H5+H2O (乙醚)
8.苯酚
苯酚是无色晶体,露置在空气中会因氧化显粉红色。苯酚具有特殊的气味,熔点140℃
43℃,水中溶解度不大,易溶于有机溶剂。苯酚有毒,是一种重要的化工原料。 (1)苯酚的酸性 OH ONa
+H2O
(苯酚钠)
苯酚钠与CO2反应:
ONa +CO+H — OH
22 +NaHCO3
(2)取代反应 OH
OH +3Br Br—Br
2 ↓+3HBr
(三溴苯酚)
Br
(3)显色反应
苯酚能和FeCl3溶液反应,使溶液呈紫色。
- 3 -
9.乙醛
乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
O (1)加成反应 || 催化剂
乙醛与氢气反应:CH3—C—H+H2CH3CH2OH
△
O (2)氧化反应 || 乙醛与氧气反应:2CH3—C—H+O22CH3COOH (乙酸)
△
乙醛的银镜反应:
△
催化剂
CH3CHO +2Ag(NH3)2CH3COONH4+2Ag+3NH3+H2O (乙酸铵)
注意:硝酸银与氨水配制而成的银氨溶液中含有Ag(NH3)2OH(氢氧化二氨合银), 这是一种弱氧化剂,可以氧化乙醛,生成Ag。有关制备的方程式:
Ag+NH3·H2O===AgOH↓+NH+ 4
AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O △
乙醛还原氢氧化铜:CH3CHO+2Cu(OH)2CH3COOH+Cu2O↓+2H2O
10.乙酸
(1)乙酸的酸性 乙酸的电离:CH3COOH(2)酯化反应
CH3COO+H
-
+
+
O
||
浓硫酸
CH3—C—OH+C2H5—OH CH3—C—OC2H5+H2O (乙酸乙酯)
△
注意:酸和醇起作用,生成酯和水的反应叫做酯化反应。 11.乙酸乙酯
乙酸乙酯是一种带有香味的物色油状液体。 (1)水解反应
无机酸
CH3COOC2H5+H2CH3COOH+C2H5OH
(2)中和反应
CH3COOC2H5CH3COONa+C2H5OH
附加:烃的衍生物的转化
- 4 -
(1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定 (6)制硝基苯(50-60℃)
〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。 3.能与Na反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。 4.能发生银镜反应的物质有:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。 5.能使高锰酸钾酸性溶液褪色的物质有:
(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物 (2)含有羟基的化合物如醇和酚类物质 (3)含有醛基的化合物
(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等) 6.能使溴水褪色的物质有:
(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成) (2)苯酚等酚类物质(取代) (3)含醛基物质(氧化)
(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应) (5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)
(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。)
7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。 8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。 9.能发生水解反应的物质有
卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。 10.不溶于水的有机物有: 烃、卤代烃、酯、淀粉、纤维素 11.常温下为气体的有机物有:
分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。 12.浓硫酸、加热条件下发生的反应有:
苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解 13.能被氧化的物质有:
含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。 大多数有机物都可以燃烧,燃烧都是被氧气氧化。 14.显酸性的有机物有:含有酚羟基和羧基的化合物。
15.能使蛋白质变性的物质有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等) 17.能与NaOH溶液发生反应的有机物: (1)酚: (2)羧酸:
(3)卤代烃(水溶液:水解;醇溶液:消去) (4)酯:(水解,不加热反应慢,加热反应快)
- 5 -
(5)蛋白质(水解)
18、有明显颜色变化的有机反应: 1.苯酚与三氯化铁溶液反应呈紫色; 2.KMnO4酸性溶液的褪色; 3.溴水的褪色;
4.淀粉遇碘单质变蓝色。
5.蛋白质遇浓硝酸呈黄色 颜色反应
- 6 -
