名词解释
1.蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。
2.蛋白质的四级结构:蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用称为蛋白质的四级结构。
3.结构域:结构域是生物大分子中具有特异结构和独立功能的区域,分子量较大的蛋白质常可折叠成多哥结构较为紧密的区域,并各行其功能,称为结构域。
4.蛋白质变性:在某些物理或化学因素作用下蛋白质的特定空间构象被破坏,从有序变为无序,从而导致其理化性质改变和生物活性丧失,称为蛋白质的变性。
5.核酸的一级结构:指构成核酸的核苷酸或脱氧核苷酸的排列顺序,即核苷酸序列。
DNA变性:在某些理化因素(温度,PH,离子强度等)作用下,DNA双链互补碱基对之间的氢键发生断裂,事双链解离为单链,这种现象称为DNA变性。
6.核酸的分子杂交:在DNA的复性过程中,不同种类的DNA或RNA单链存在一定的碱基配对关系,从而可以形成杂化双链,两条单链可以分别来自DNA或RNA,这样的现象称为核酸的分子杂交。
7.hnRNA:即核内不均一RNA,是真核生物基因转录过程中产生的mRNA初级产物,具有不稳定,大小不一,分子量大的特点。
8.酶的活性中心:指酶分子中与酶活性密切相关的化学基团在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合并将底物转化为产物。这样的区域称为酶的活性中心。
9.同工酶:指能催化相同的化学反应,但酶蛋白的分子结构,理化性质乃至免疫学性质不用的一组酶。
10.酶的竞争性抑制:指某些酶的抑制剂与酶的底物结构相似,可与底物竞争酶的活性中心,从而阻碍酶和底物结合成中间产物。这样的抑制作用称为酶的竞争性抑制作用。
11.酶的共价修饰:酶蛋白肽链上的一些基团与某种化学基团发生可逆的共价结合,从而改变酶的活性的过程称为酶的共价修饰。
12.糖酵解:在机体缺氧条件下,葡萄糖经过一系列酶促反应生成丙酮酸进而还原生成乳酸的过程称为糖酵解,也称糖的无氧氧化。
13.糖的有氧氧化:葡萄糖在有氧条件下彻底氧化生成水和二氧化碳的反应过程称为糖的有氧氧化,是糖氧化供能的主要方式。
14.TAC:是需氧生物体内普遍存在的代谢途径,因为在这个循环中几个主要的中间代谢物是含有三个羧基的柠檬酸,所以叫做三羧酸循环,又称为柠檬酸循环。
15.糖异生:机体将非糖化合物(乳酸、甘油、生糖氨基酸等)转变为葡萄糖或糖原的过程称为糖异生,肝和肾是进行糖异生的主要器官。
16.脂肪动员:指储存在脂肪细胞中的甘油三酯被酯酶逐步水解为有利脂肪酸和甘油,释放入血液,通过血液运输至其他组织氧化利用的过程。
17.脂酸β氧化:脂酸在氧化分解时,在脂酸β—氧化多酶复合体的有序催化下,脂酰基的β—碳原子上进行脱氢、加水、再脱氢和硫解的连续反应,生成一分子比原来少2个碳原子的脂酰CoA及1分子乙酰CoA,称为脂酸的β—氧化
18.酮体:包括乙酰乙酸、β—羟丁酸和丙酮,是脂酸在肝细胞分解氧化时产生的中间产物。
血浆脂蛋白:血浆中的TG、PL、Ch、CE等与载脂蛋白结合生成的复合体,称为血浆脂蛋白。
19.生物氧化:糖、脂肪、蛋白质等营养物质在生物体内进行的氧化称为生物氧化。
20.呼吸链:在线粒体内膜上由递氢体或递电子体组成的按序排列的能将氢传递给氧生成水的氧化还原体系称为呼吸链。
21.氧化磷酸化:由代谢物脱下的氢,线粒体氧化呼吸链电子传递释放能量,偶联驱动ADP磷酸化生成ATP的过程称为氧化磷酸化,又称偶联磷酸化。
22.P/O比值:指氧化磷酸化过程中,每消耗1/2摩尔O2所生成ATP的摩尔数(或一对电子通过氧化呼吸链传递给氧所生成的ATP分子数)
23.必需氨:体内需要而又不能自身合成,必需由食物提供的氨基酸,称为必需氨基酸。
24.转氨基作用:指在转氨酶的作用下,可逆的把一一氨基酸脱去氨基生成相应的α—酮酸。而另一个α—酮酸得到氨基生成氨基酸的过程。
25.联合脱氨基:指转氨酶与L—谷氨酸脱氢酶协同作用,即转氨基作用和谷氨酸的氧化脱氨基偶联进行,把氨基酸转变成NH3以及相应α—酮酸的过程。
26.一碳当量:指某些氨基酸分解代谢过程中产生的含有一个碳原子的有机基团。
27.核苷酸的从头合成途径:指由磷酸核糖、天冬氨酸、甘氨酸、谷氨酰胺、一碳单位及CO2等简单物质为原料,经过多步酶促反应合成嘌呤核苷酸的过程。
28.核苷酸的补救途径:指利用体内现成的嘧啶碱基或嘧啶核苷酸为原料,经过嘧啶磷酸核糖转移酶或嘧啶核苷激酶等简单反应,合成嘧啶核苷酸的过程。
29.抗代谢物:指某些嘌呤、嘧啶、叶酸以及某些氨基酸类似物具有通过竞争性抑制或“以假乱真”等方式,干扰和阻断核苷酸正常合成代谢,从而进一步抑制核酸、蛋白质合成以及细胞增殖的作用。
30.信号转导:指细胞以多种方式感受内外环境信号,并进行加工,通过检测、放大、整合,使细胞的代谢途径、基因转录、基因复制、细胞分裂等进行改变,以随时保证个体与环境统一的过程。
31.化学通讯:多细胞生物中由细胞分泌的可溶性化学物质(蛋白质或小分子物质)作用于周围或相距较远的同类或其他类细胞(靶细胞),调节其功能,这种通讯方式成为化学通讯。
32.受体:是细胞膜上或细胞内能识别外源化学信号并与之结合的成分,其化学本质是蛋白质,个别糖脂也具有受体作用。
33.第二信使:cAMP、cGMP、DAG、IP3、Ca2+、NO、CO、H2S等这类在细胞内传递信息的小分子化合物称为第二信使。
34.生物转化:指机体将非营养物质在体内进行代谢转变,使其水溶性增强,极性增强,易于通过胆汁或尿液排出体外,这一过程称为生物转化作用。
35.胆色素:是体内铁卟啉类化合物分解代谢的主要产物,包括胆绿素、胆红素、胆素原和胆素。
36.结合胆红素:又称肝胆红素,在肝与葡糖糖醛酸结合转化的胆红素称为结合胆红素。
选填
1.TCA(三羧酸循环):是一个由一系列酶促反应构成的循环反应系统,在该反应过程中,首先由乙酰CoA与草酰乙酸缩合生成含3个羧基的柠檬酸,再经过4次脱氢、2次脱羧,生成4分子还原当量和2分子CO2 ,重新生成草酰乙酸的循环。
2.三种可逆性抑制的动力学参数变化
竞争性抑制作用:Km变大,Vm不变。
非竞争性抑制作用:Km不变,Vm减小。
反竞争性抑制作用:Km变小,Vm减小。
3.酶活性的调节方法:酶的变构调节、酶的化学修饰、酶原的激活。
4.糖酵解途径的限速酶:6-磷酸果糖激酶-1、丙酮酸激酶、己糖激酶。
5.胆固醇的代谢转变:胆汁酸、类固醇激素。
6.两种联合脱氨基:转氨基作用与谷氨酸氧化脱氢基作用的联合、转氨基作用与嘌呤核苷酸循环的联合。
7.痛风症:是一种嘌呤代谢障碍性疾病,其基本生化特征是高尿酸血症,由于尿酸的溶解度很低,当尿酸超过8mg/dL时,则尿酸盐结晶沉积于软组织、软骨及关节等处,形成通风性关节炎,或在肾脏中沉积形成肾结石。治疗通风有效的别嘌呤醇主要抑制黄嘌呤氧化酶。
8.乳酸循环:在肌肉中葡萄糖经糖酵解生成乳酸,乳酸经血液运到肝脏,肝脏将乳酸异生成葡萄糖。葡萄糖释入血液后又被肌肉摄取。意义:避免损失乳酸、防止乳酸堆积造成中毒。
9.糖异生途径的限速酶:丙酮酸羧化酶、磷酸烯醇式丙酮酸羧激酶、果糖二磷酸酶、葡萄糖磷酸酶。
10.蛋白质空间构象的正确形成:除一级结构为决定因素外,还需一类称为分子伴侣的蛋白质参与。
11.米曼式方程式:V=Vmax[S]/Km+[S].
12.B族维生素在体内的活性形式:维生素B2(FAD/TPP)、维生素B1(CoA)、 维生素B12(磷酸吡哆醛、磷酸吡哆胺) 、维生素B6(生物素)。PP
13.脂酸β氧化:脂酸活化为脂酰CoA,经肉碱转运进入线粒体,在线粒体内进行脱氢、加水、再脱氢、硫解四步连续反应的过程。限速酶:肉碱脂酰转移酶Ⅰ.
14.氨的转移形式:丙氨酸、谷氨酰胺。
15:嘌呤碱在体内的分解代谢:人体内嘌呤碱最终分解生成尿酸,随尿排出体外。
16:蛋白质的含氮量:各种蛋白质的含氮量很接近,平均为16%--每克样品含氮克数×6.26×100=100g样品中蛋白质含量
17.20种标准氨基酸:甘氨酸:Gly,丙氨酸:Ala,缬氨酸:Val,亮氨酸:Leu,异亮氨酸:Ile,普氨酸:pro,丝氨酸:Ser,半胱氨酸:Cys,蛋氨酸(甲硫氨酸):Met,天冬酰胺:Asn,谷氨酰胺:Gln,苏氨酸:Thr,苯丙氨酸:Phe,色氨酸:Trp,酪氨酸:Tyr,天冬氨酸:Asp,谷氨酸:Glu,赖氨酸:Lys,精氨酸:Arg,组氨酸:His
18.Pro的两性解离:由于所有氨基酸都含有碱性的α-氨基和酸性的α-羟基,可在酸性溶液中与质子结合成正电荷的阳离子(﹣NH3+)也可以在碱性溶液中与氢氧根结合,失去质子变成带负电荷的阴离子(-COOH`)因此氨基酸是一种两性电解质,具有两性解离的特性
19.DNA的碱基组成规律:①腺嘌呤与胸腺嘧啶的摩尔数相等,而鸟嘌呤与胞嘧啶的摩尔数相等A-T,C-G②不同生物种属的DNA碱基组成不同③同一个体不同器官、不同组织的DNA具有相同的碱基组成。
20:磺胺药的抑菌作用:磺胺药是一种竞争性抑制剂,磺胺药物类似对氨基苯基酸,会抑制细菌叶酸的合成。
22.单糖与多糖:多糖:淀粉,糖元,纤维素;单糖:葡萄糖,果糖,半乳糖
23.肝糖原分解与肌糖原酵解:肝糖原在糖原磷酸化酶作用下非还原末端分解下一个葡萄糖残基,生成1-磷酸葡萄糖,再转变为6-磷酸葡萄糖,后者由肝脏中的葡萄糖-6-磷酸酶水解成游离的葡萄糖释放入血。肌糖原由于缺乏一种酶(肌肉中无分解6-磷酸葡萄糖的磷酸酯酶),肌糖元不能直接分解成葡萄糖,必须先分解产生乳酸,经血液循环到肝脏,再在肝脏内转变为肝糖元或分解成葡萄糖。
24.糖代谢中重要的中间产物丙酮酸,乙酰CoA,柠檬酸,草酰乙酸,磷酸烯醇式丙酮酸
25.血浆脂蛋白的功能1.维持血浆胶体渗透压2.维持正常的pH 3.运输作用4.免疫作用5.催化作用6.营养作用7.凝血、抗凝血作用8.血浆蛋白质异常引起一些临床疾病(风湿病,肝疾病……)
26.氧化磷酸化的调节:①ADP/ATP的比值(基本因素,ADP/ATP的比值增高时,氧化磷酸化速度加快)②甲状腺③呼吸链抑制剂(阻断某一环节的电子传递,从而抑制氧化磷酸化)④解偶联剂(能使氧化磷酸化偶联过程脱离)⑤氧化磷酸化抑制剂(对电子传递及ADP磷酸化均有抑制作用)⑥线粒体DNA突变
27.呼吸链中电子传递体排列顺序NADH氧化呼吸链中复合体Ⅰ,复合体Ⅲ,复合体Ⅳ 琥珀酸氧化呼吸链中复合体Ⅱ,复合体Ⅲ,复合体Ⅳ
28.三类氧化磷酸抑制剂①呼吸链抑制剂阻断氧化磷酸化的电子传递过程(鱼藤酮)②解偶联剂破坏电子传递建立的跨膜质子电化学梯度(二硝基苯酚)③ATP合酶抑制剂同时抑制电子传递和ATP的生成(寡霉素)
29.体内的一碳单位有:甲基、甲烯基、甲炔基、甲酰基、亚氨甲基。体内载体\四氢叶酸。
30.嘌呤核苷酸从头合成的特点:①嘌呤核苷酸是在磷酸核糖分子上逐步合成的。②在核苷一磷酸 (NMP) 水平,生成AMP 和GMP 。③AMP的合成需1个GTP;GMP的合成需1个ATP。(原料:磷酸核糖、氨基酸、一碳单位、CO2)嘧啶核苷酸从头合成的特点:①先合成嘧啶环,然后连接5-磷酸核糖。②在核苷三磷酸 (NTP) 水平,生成CTP。
31.乙酰辅酶A的来源与去路:乙酰CoA是葡萄糖、脂肪酸和氨基酸分解代谢中共同的中间产物,可以通过TAC和呼吸链彻底氧化。
32.Ac-cAMP-PKA信号转导途径:该通路以靶细胞内cAMP浓度改变和激活PKA为主要特征,是激素调节物质代谢的主要途径。
33.G蛋白偶联受体:这类受体的细胞内部分总是与异源三聚体G蛋白结合,受体信号转导的第一步反应都是活化G蛋白。是由一条肽链组成的糖蛋白。
34.血红素的生物合成:基本原料:甘氨酸、琥珀酰CoA和Fe2+.。合成的起始和终末阶段均在线粒体进行,中间阶段在细胞质中进行。过程:①ALA的合成②胆色素原的合成③尿卟啉原语粪卟啉原的合成④血红素的生成。合成调节:ALA合酶;ALA脱水酶与亚铁螯合酶;促红细胞生成素。
35.蛋白质的基本组成单位:氨基酸
36.只要测定生物样本中N得含量就推出pro含量。
37.pro电泳:通过蛋白质在电场中泳动而达到分离各种蛋白质的技术。
38.DNA与RNA分子组成的差异:脱氧的区别
39.DNA二级结构的要点:是双螺旋结构①反向平行、右手螺旋的双链结构②DNA双链之间形成了互补碱基对③疏水作用力和氢键共同维持着DNA双螺旋结构的稳定。
40.一碳单位转移酶的辅酶成分是生物素和四氢叶酸
41.糖酵解的第二阶段丙酮酸→乳酸
42.胆固醇在体内的代谢去路是转化为胆汁酸和类固醇激素,还可以转化为维生素D3的前体
43.脂酸β氧化限速酶 脂酰CoA进入线粒体是脂酸β氧化的主要限速步骤,肉碱酯酰转移酶Ⅰ是脂酸β氧化的限速酶。
45.一碳单位载体是四氢叶酸
47.体内氨的来源 (1)氨基酸脱氨基作用和氨类分解 (2)肠道吸收的氨 (3)肾小管上皮细胞分泌的氨。 去路 (1)肝脏合成尿素 (2)以铵盐形式随尿排除体外 (3)合成谷氨酰胺 (4)合成非必须氨基酸
49.体内脱氧核苷酸的合成 从头合成和补救合成
50.体内dTMP的合成 dTMP是由脱氧尿嘧啶核甘酸(Dump)经甲基化而生成的。
51.痛风症的治疗 临床上常用别嘌呤醇治疗痛风症。
52.通过膜受体起调节因素的激素:
53.生物转化的两相反应:氧化反应是最多见的生物转化第一相反应;结合反应是生物转化的第二相反应。
1.蛋白质的一级结构与核酸的关系
氨基酸的排列顺序决定蛋白质的一级结构,核酸决定了氨基酸的排列顺序。
2.在国内近几年的毒奶粉事件中为什么向奶粉中添加三聚氰胺?
三聚氰胺化学式C3H6N6,氮元素的质量分数为66.6%,蛋白质的氮元素的质量分数约为16%,由于食品和饲料工业蛋白质含量测试方法的缺陷,三聚氰胺也常被不法商人用作食品添加剂,以提升食品检测中的蛋白质含量指标。
3.酶原激活的概念及生理意义。
酶原是无活性酶的前体,酶原向酶的转化过程称为酶原的激活,酶原的激活实际上是酶的活性中心形成或暴露的过程。生理意义:消化管内蛋白酶以酶原形式分泌,不仅保护消化器官本身不受酶的水解破坏,而且保证酶在其特定的部位与环境发挥其催化作用。此外,酶原还可以视为酶的贮存形式。
4.Km和Vm的意义。
Km的意义:①Km值等于酶促反应速率为最大速率一半时的底物浓度。②在一定情况下,Km值近似于ES的解离常数Ks。Km值可用来表示酶对底物的亲和力。此时,Km值愈大,酶与底物的亲和力愈小;Km值愈小,酶与底物的亲和力愈大。Ks值和Km值得含义不同,不能互相代替使用,③Km值是酶的特性常数之一,只与酶的结构、酶所催化的底物和外界环境有关,与酶的浓度无关。
Vm的意义:Vm值是酶完全被底物饱和时的反应速度。如果酶的总浓度已知,便可以根据Vm计算酶的转换数。其定义是:当酶被底物充分饱和时,单位时间内每个酶分子(或活性中心)催化底物转变为产物的分子数。对于生理性底物,大多数酶的转换数在1—10四次方之间。
5.体内对限速酶的主要调节方式。
⑴酶活性调节:① 酶原激活②变构调节③共价修饰
⑵酶含量调节:①溶酶体组织的非特异性降解②由泛素识别结合待分解蛋白,特殊泛素结合降解酶催化蛋白降解
6.血糖来源与去路
来源:①食物经消化吸收的的葡萄糖②肝糖原分解③糖异生
去路:①氧化功能②合成糖原③转变为脂肪及某些非必需氨基酸④转变为其他糖类物质
7.TAC的生理意义。
一、TAC循环是3大营养素的最终代谢通路。其作用在于通过4次脱氢为氧化磷酸化反应生成ATP提供还原当量。二、TAC循环是糖,脂肪,氨基酸代谢的枢纽,为生物合成提供小分子前体。
8、胆固醇逆向转运的基本过程及作用。
胆固醇逆向转运是指将肝外组织细胞内的胆固醇,通过血液循环转运到肝,在肝细胞中进行代谢转化。胆固醇逆向转运分为三个步骤
(1) 第一步是胆固醇从肝外组织细胞中移出: HDL是胆固醇从细胞内移出不可缺少的的接受体。
(2) 第二步是载运胆固醇的酯化及胆固醇酯的转运: 从肝细胞或小肠细胞分泌的新生HDL为盘状,其表面有载脂蛋白AI,后者为LCAT的激活剂。新生的HDL进入血液后在LCAT的作用下,将其表面的卵磷脂第2位的脂酰基转移到胆固醇羟基上,生成胆固醇酯可进入HDL的内核,随着胆固醇酯的不断增多,新生的HDL变成成熟的HDL3,随着HDL3不断接受酯化的胆固醇,HDL3转变成HDL2。与此同时HDL中的胆固醇酯可在CETP的作用下,转移给VLDL生成LDL。
(3) 第三步是HDL被肝细胞摄取: 肝细胞膜上存在HDL受体。血浆中胆固醇酯90%来自HDL,其中约20%通过肝脏HDL受体清除。被肝细胞摄取的胆固醇可以用来合成胆汁酸或直接通过胆汁排出体外。
机体通过胆固醇逆向转运,将外周组织中衰老细胞膜中的胆固醇转运到肝脏并代谢排出体外。
9、体内ATP的生成方式。
氧化磷酸化是指在呼吸链电子传递过程中偶联ADP磷酸化,生成ATP,又称为偶联磷酸化。底物水平磷酸化与脱氢或脱水反应偶联,生成底物分子的高能键,使ADP (GDP) 磷酸化生成ATP (GTP) 的过程。不经电子传递。
10、从蛋白质营养价值角度分析小儿偏食的危害。
食物中蛋白质的营养高低决定于所含必需氨基酸的种类和数量以及各种氨基酸的比例与人体蛋白质的接近程度。单一食物易出现某些必需氨基酸缺乏,营养价值较低,如果将几种营养价值较低的蛋白质混合起来,则必需氨基酸可以互相补充从而提高营养价值,此称蛋白质的互补作用。小儿偏食易导致某些必需氨基酸不足,食物蛋白质使用效率较低,影响小儿的生长发育。
11、体内氨基酸代谢库的来源和去路
来源:①食物蛋白质的消化吸收。②组织蛋白质的分解。③转氨基作用生成非必须氨基酸。
去路:①脱氨基作用生成α-酮酸和NH3 。②脱氨基作用生成胺类和CO2。③代谢转变为嘌呤、嘧啶、肌酸等含氮化合物。
12、G蛋白偶联受体介导的信号转导的基本模式。
主要过程包括:①配体与受体结合;②受体激活G蛋白;③G蛋白激活或抑制下游效应分子;④效应分子改变细胞内第二信使的含量与分布;⑤第二信使作用于相应的靶分子,使之构象发生改变,从而改变细胞的代谢过程及基因表达等功能。
计算题
1.试计算1mol乳酸在心肌细胞中彻底氧化为二氧化碳和水时,产生ATP的数量。
解:心肌细胞中,线粒体外的NADH用苹果酸—天冬氨酸穿梭系统进入线粒体进行氧化磷酸化,生成2.5个ATP。
乳酸→丙酮酸 1NADP(外)2.5ATP
(1)丙酮酸→乙酰CoA 1NADP(内)2.5ATP(乳酸变为乙酰CoA生成5molATP)
(2)异柠檬酸→a-酮戊二酸,生成1NADP
a-酮戊二酸→琥珀酸CoA ,生成1NADP
琥珀酸CoA→琥珀酸,生成1GTP
琥珀酸→延胡索酸 ,生成1FADH2
苹果酸→草酰乙酸 ,生成1NADH (1mol乙酰CoA生成10molATP)
综上:2.5+2.5+2.5+2.5+1+1.5+2.5=15
所以1mol乳酸生成15molATP。
2.试计算1mol软脂酸(16碳饱和脂肪酸)在体内彻底氧化产生ATP的数量。
解(1):软脂酸→脂酰CoA 消耗2ATP;
(2)经过一次脱氢、加水、脱氢、硫解,转化为乙酰CoA和14碳酯酰CoA,生成1NADH和1FADH,经过7次上述步骤,生成8乙酰CoA和7NADH+7FADH。
1乙酰CoA氧化生成10ATP。
综上:8*10+7*1.5+7*2.5-2=106
3.试计算1molβ羟基丁酸在肝外组织中彻底氧化时产生ATP的数量。
解:(1)β-羧丁酸彻底氧化分解的代谢过程:
β-羟丁酸脱氢酶
Ø 
 β-羟基丁酸 乙酰乙酸(2.5分子ATP)(2分)
β-羟基丁酸 乙酰乙酸(2.5分子ATP)(2分)
NAD+ NADH+H+
Ø 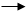 乙酰乙酸 乙酰CoA (有琥珀酰CoA存在时,无能量转化)
乙酰乙酸 乙酰CoA (有琥珀酰CoA存在时,无能量转化)
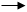 乙酰乙酸 乙酰CoA(有ATP时,消耗1ATP生成AMP,相当于消耗2ATP)(3分)
乙酰乙酸 乙酰CoA(有ATP时,消耗1ATP生成AMP,相当于消耗2ATP)(3分)
2分子乙酰CoA进入三羧酸循环,生成20分子ATP(3分)
(2)一分子β-羟丁酸彻底分解 可生成20.5或22.5分子ATP(4分)
4.为什么复合体Ⅱ不是氧化磷酸化的偶联部位?(FADH2和Q10的E0分别为-0.06V和0.045V,F=96.5kJ/V/mol)
解:FADH2~Q10(传递2个电子)
ΔG= -n F ΔE
n=2,F=96.5kJ/V/mol,ΔE=0.045-(-0.06)=0.105V
所以ΔG= -20.265kJ/mol
生成1molATP需能约为30.5kJ/mol,所以复合体二中的反应不足以产生ATP,所以不是氧化磷酸化的偶联部位。
5.丙氨酸彻底氧化成CO2和H2O的途径如下:
丙氨酸首先脱氨生成丙酮酸
丙酮酸氧化脱羧生成乙酰CoA,此反应脱下一对H进入呼吸链产生2.5个ATP
乙酰CoA进入TCA循环彻底氧化生成CO2和H2O,并产生10分子ATP,其中经过4次脱氢,生成3分子NADH+H和1分子FADH2,一次底物水平磷酸化。
所以1mol丙氨酸完全氧化共可以产生12.5molATP
6.米氏方程V=Vmax[S]/(Km+[S]),V为反应速度,Vmax为初速度,[S]为底物浓度,Km为半初速度是的底物浓度(一般为常数)
问答题
1. 以丙氨酸为例说明生糖氨基酸转化为葡萄糖的过程。
答:(1)ALT催化:丙氨酸+α-酮戊二酸→丙酮酸+谷氨酸
(2)丙酮酸羧化酶催化:丙酮酸→草酰乙酸,后者还原为苹果酸
(3)苹果酸出线粒体:苹果酸→草酰乙酸;磷酸烯醇式丙酮酸羧激酶催化草酰乙酸→磷酸烯醇式丙酮酸;后者沿糖酵解途径逆行至1,6-双磷酸果糖
(4)果糖双磷酸酶-1催化:1,6-双磷酸果糖→6-磷酸果糖
(5)6-磷酸果糖→6-磷酸葡萄糖,经葡萄糖-6-磷酸酶催化生成葡萄糖
2.以天冬氨酸为例说明生糖氨基酸转化为葡萄糖的过程。
答:(1)天冬氨酸+α-酮戊二酸→草酰乙酸+谷氨酸
(2)磷酸烯醇式丙酮酸羧激酶催化草酰乙酸→磷酸烯醇式丙酮酸;后者沿糖酵解途径逆行至1,6-双磷酸果糖
(3)果糖双磷酸酶-1催化:1,6-双磷酸果糖→6-磷酸果糖
(4)6-磷酸果糖→6-磷酸葡萄糖,经葡萄糖-6-磷酸酶催化生成葡萄糖
3.试述油脂转变为糖元的反应过程,ATP消耗与限速酶。
答:(1)甘油→α-磷酸甘油→磷酸二羟丙酮→3-磷酸甘油醛
(2)3-磷酸甘油醛与磷酸二羟丙酮缩合生成1,6-FBP,后者经果糖双磷酸酶-1催化生成F-6-P
(3)F-6-P→G-6-P→G-1-P→UDPG→Gn+1,限速酶是糖原合酶、甘油激酶、果糖二磷酸酶-1;ATP的消耗:(1+2.5)×2+1+1=9
4.试述酮体生成,利用,及生理意义
答:酮体包括乙酰乙酸、β-羟丁酸和丙酮。
酮体生成。①乙酰乙酰硫解酶催化:2分子乙酰CoA→乙酰乙酰CoA。②HMG-CoA合成酶催化:乙酰乙酰CoA+乙酰CoA→HMG-CoA+CoA。③HMG-CoA裂解酶催化:HMG-CoA→乙酰乙酰CoA+乙酰CoA。④β-羟丁酸脱氢酶催化:乙酰乙酸+NAD+→β-羟丁酸+NADH+H+。⑤乙酰乙酸→丙酮+CO2。
酮体氧化。①β-羟丁酸脱氢酶催化:β-羟丁酸+NADH+H+→乙酰乙酸+NAD+。②乙酰乙酸硫激酶催化:乙酰乙酸+CoA+ATP→乙酰乙酸CoA+AMP+PPi。③琥珀酰CoA转硫酶催化:乙酰乙酸+琥珀酰CoA→乙酰乙酰CoA+琥珀酸。④硫解酶催化:乙酰乙酰CoA→2分子乙酰CoA。⑤乙酰CoA进入三羧酸循环和氧化呼吸链彻底氧化成CO2、H2O和ATP
5.从营养物代的角度解释为什么在减肥过程中减少糖的摄入
答:因为糖能为脂肪(三酯酰甘油)的合成提供原料,即糖能转变成脂肪。
(1)葡萄糖在细胞质中经糖酵解途径分解生成丙酮酸,其关键酶有己糖激酶、6-磷酸果糖激酶-1、丙酮酸激酶。
(2)丙酮酸进入线粒体在丙酮酸脱氢酶复合体催化下氧化脱羧成乙酰CoA,后者与草酰乙酸在柠檬酸合酶催化下生成柠檬酸,再经柠檬酸-丙酮酸循环出线粒体,在细胞质中裂解为乙酰CoA,后者作为合成脂酸的原料。
(3)细胞质中的乙酰CoA在乙酰CoA羧化酶催化下生成丙二酸单酰CoA,再经脂酸合成酶系催化合成软脂酸。
(4)细胞质中经糖酵解途径生成的磷酸二羟丙酮还原成α-磷酸甘油,后者与脂酰CoA在脂酰转移酶催化下生成三酯酰甘油(脂肪)。
由上可见,摄入大量糖类物质可转变为脂肪储存于脂肪组织,因此减肥者要减少糖类物质的摄入量。
6.两条呼吸链中电子传递体的排列顺序以及氧化磷酸化的耦联部位。
答:(1)NADH氧化呼吸链:NADH→FMN(Fe-S)→CoQ→Cyt b→Cyt c1→Cyt aa3→O2。
(2)琥珀酸氧化呼吸链:琥珀酸→FAD(Fe-S) →CoQ→Cyt b→Cyt c1→Cyt c→Cyt aa3→O2。
(3)耦联部位有三个:NADH→CoQ;CoQ→Cyt c;Cyt aa3→O2。
7.试述人体内氨的来源于去路及鸟氨酸循环的主要过程。
答:血氨的来源:①氨基酸脱氨生成的氨②肠道吸收的氨③肾小管分泌的氨;血案的去路:①合成尿素②用于合成非必要氨基酸和一些含氮化合物③生成铵盐随尿怕四处④合成谷氨酰胺。
鸟氨酸循环的主要过程:①NH3、CO2和ATP缩合生成氨基甲酰磷酸②氨基甲酰磷酸与鸟氨酸反应生成瓜氨酸③瓜氨酸与天冬氨酸反应生成精氨酸代琥珀酸④精氨酸代琥珀酸裂解成精氨酸与延胡索酸⑤精氨酸水解释放尿素并在省城鸟氨酸
8.试胰高血糖素升高血糖为例阐明胰高血糖素调节糖原代谢的级联反应过程。
答:胰高血糖素+膜受体→胰高血糖素-受体复合物
↓
无活性的G蛋白→活性G蛋白
↓
无活性AC→活性AC
↓
ATP→cAMP
↓ 活性糖原合酶
无活性PKA→活性PKA→↓
↓ 无活性糖原合酶
无活性磷酸化酶b激酶→有活性磷酸化酶b激酶
↓
无活性磷酸化酶b→有活性磷酸化酶b
↓
糖原→Gle
