生物化学考点小结
第一部分 蛋白质
一、氨基酸的结构与分类
A、氨基酸的通式
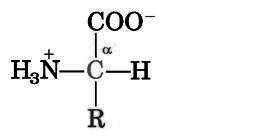
1、 构成蛋白质的氨基酸有20种 ,均为?-氨基酸(脯氨酸除外)
2、α-氨基酸有两种构型: D构型和L构型,是与甘油醛或乳酸相比较而决定的
3、 蛋白质中的氨基酸都是L-型
4、 共同点为在同一碳原子上有羧基、氨基、和氢;不同点是侧链R基不同
B、20种氨基酸的分类
1、 按照侧链R基团结构
a、脂肪族氨基酸
(1)酸性氨基酸:Asp、Asn、Glu、Gln
(2} 碱性氨基酸:Arg、Lys
(3)中性氨基酸:Gly、Ala、Val、Leu、Ile、Ser、Thr、Cys、Met
b、芳香族氨基酸:Phe、Tyr
c、杂环氨基酸:His、Trp、Pro
2、按照侧链R基团极性

3、根据生物体的需要
(1)必需氨基酸:Lys、Val、 Ile、Leu 、Phe 、Met 、Trp、Thr
(2)半必需氨基酸:Arg、 His
(3)非必需氨基酸:其余氨基酸
4、特殊性质的氨基酸
Gly R = H 无侧链,无空间位阻,柔性大,无手性C
Ala R = -CH3 小,可在蛋白质内部和表面
Val,Ile,Leu R大,位阻大,
易在蛋白质中固定某一位置,利于折叠
Pro 亚氨酸,使肽链形成一个转角,改变主链方向。
常暴露于蛋白质表面
Cys -SH,易形成二硫键,与金属离子配位结合。
通常藏在蛋白质内部
Asp Glu 2 -COOH 相应的酰胺为 Asn Gln
His 咪唑基 可接受H+或供H+
Lys,Arg 2个 -NH2,带正电荷,存在蛋白质表面,
可形成离子键。
Lys R长,可自由伸展,与蛋白质结合功能有关
Arg 藏在内部
二、氨基酸的结构和性质
1、氨基酸的理化性质
(1)氨基酸的光学性质:旋光性和紫外吸收
(2)氨基酸在水溶液中或在晶体状态时主要时以两性离子的形式存在
氨基酸在水中的两性离子既能像酸一样放出质子,也能像碱一样接受质子,氨基酸具 有 酸碱性质,是一类两性电解质
2、氨基酸的等电点 pI
不同pH时氨基酸以不同的离子化形式存在
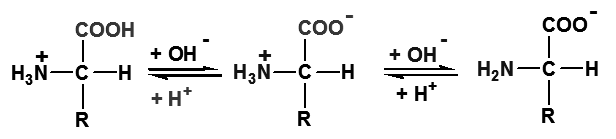
氨基酸所带净电荷为“零”时,溶液的pH值称为该氨基酸的等电点(isoelectric point), 以pI表示
1、当溶液的 pH=pI 时,氨基酸主要以两性离子形式存在
2、 pH<pI 时,氨基酸主要以正离子形式存在
3、 pH>pI 时,氨基酸主要以负离子形式存在
A、等电点的计算
1、中性氨基酸:pI=(pK1+pK2)/ 2
2、酸性氨基酸:pI=(pK1+pKR)/ 2
3、碱性氨基酸:pI=(pKR+pK3)/ 2
B、氨基酸的酸碱性质
1、 在等电点以上的任何pH值,氨基酸带净负电荷,在电场中将向正极移动
2、 在低于等电点的任何pH值,氨基酸带净正电荷,在电场中将向负极移动
3、 在一定pH范围内,氨基酸溶液的pH值离等电点越远,氨基酸所携带的净电荷越大
三、习题
用强酸性阳离子交换树脂分离下列每对氨基酸,当用pH7.0的缓冲液洗脱时,下述每对氨基酸中先从柱上洗脱下来的是那种氨基酸?
(1)天冬氨酸和赖氨酸,(2)精氨酸和甲硫氨酸,
(3)谷氨酸和缬氨酸, (4)甘氨酸和亮氨酸
答 案
1、Asp净电荷为负,Lys静电荷为正,Lys与树脂磺酸基相反离子吸附作用大,故 Asp> Lys
2. Arg净电荷为正,Met静电荷接近零,故 Met> Arg
3. Glu净电荷为负,Val净电荷接近零,故 Glu >Val
4. Gly和Leu净电荷都接近零,但Leu的非极性侧链与树脂骨架之间的非极性相互作用大,故 Gly >Leu
四、肽
1、肽是由两个或两个以上的氨基酸通过肽键连接而形成的化合物,氨基酸之间脱水后形成的键称肽键(酰胺键)
2、肽链书写方式:N端→C端,游离α-氨基在左,游离α-羧基在右,氨基酸残基之间用 “-”表示肽键
3、命名:根据氨基酸组成,由N端→C端命名
4、肽的化学性质与氨基酸相似,如两性解离、等电点等,但肽有与氨基酸不同的特殊反应
(1)、双缩脲反应 :双缩脲 + 碱性CuSO4溶液 紫色
(2)肽键的紫外吸收 210~230nm
五、蛋白质
1、蛋白质平均含N量为16%,这是凯氏定氮法测蛋白质含量的理论依据:
蛋白质含量=蛋白质含N量/(16%)=蛋白质含N量*6.25
2、蛋白质分子量的估算: 110*氨基酸数(kDa)。
3、、蛋白质的水解
a、酸水解:多数氨基酸稳定,不引起消旋作用;Trp完全被破坏,羟基氨基酸部分分解,Gln和Asn的酰胺基被水解 ?
b、碱水解:Trp稳定;多数氨基酸被不同程度破坏,且产生消旋现象,Arg脱氨
c、酶水解:不产生消旋作用,也不破坏氨基酸,但需多种酶协同作用
优点: 不破坏任何氨基酸
缺点: 水解不彻底
最常见的蛋白水解酶有以下几种:
胰蛋白酶、糜蛋白酶、胃蛋白酶、嗜热菌蛋白酶、
羧肽酶和氨肽酶
4、蛋白质变性
1) 变性是指蛋白质受物理或化学因素的影响,使蛋白质分子原有的特定的空间结构发生改变,从而引起蛋白质理化性质的改变,肽链从紧密有序结构→松散无序的结构
2)变性因素:
化学:酸、碱、有机溶剂、蛋白变性剂(尿素、盐酸胍)、重金属盐等
物理:加热、紫外线、X-射线、超声波、剧烈震荡等
3)变性蛋白质的主要特征
蛋白质分子中次级键断裂,构象破坏,但不涉及共价键的破坏,一级结构不变,一些侧链基团暴露,可滴定基团增加,生物活性全部或部分丧失
一些物理化学性质的改变:变性蛋白质的溶解度降低、扩散系数减小而粘度增加
5、蛋白质的复性(renaturation)
除去变性因素后,有的变性蛋白质又可恢复其天然构象和生物活性。
6、蛋白质的分离和纯化
总目标:增加制品的纯度(purity)或比活力(specific acivity), 以增加单位蛋白质重量中所要蛋白质的含量或生物活性,设法除去变性的或不要的蛋白质,并且希望所得蛋白质的产量达到最高值
一般可以分为前处理、粗分级分离和细分级分离3步
1)目标蛋白质的分离纯化程序主要包括:
1、 材料的选择;
2、 组织匀浆或高压破碎细胞获取粗提取液;
3、 蛋白质初步提纯;
4、 选择一种或几种合适的方法除去杂蛋白,直至完全纯化;
5、 目标蛋白的鉴定。
在目标蛋白质的整个分离纯化过程中要在较低温度下(0-4℃)操作,注意使用蛋白酶的抑制剂,避免使用剧烈条件。
2)主要分离方法
a、凝胶色谱法(也称分子排阻色谱):根据分子大小分离蛋白质混合物最有效方法之一
b、等电点沉淀法:蛋白质分子在等电点时,净电荷为零,分子之间的静电排斥力最小,容易聚集形成沉淀。
c、盐溶:中性盐可以增加蛋白质的溶解度。盐溶作用主要是由于蛋白质分子吸附某种盐类离子后,带电层使蛋白质分子彼此排斥,而蛋白质分子与水分子间的相互作用却加强,因而溶解度增高。
d、盐析:当溶液的离子强度增加到一定数值时,蛋白质溶解度开始下降。当溶解度增加到足够高时,很多蛋白质可以从水溶液中沉淀出来,这种现象叫盐析。盐析作用主要是蛋白质在高浓度的中性盐溶液中,水化层被破坏和表面电荷被中和,发生沉淀。常用的盐为硫酸铵。
随着盐浓度的增加,蛋白质疏水表面进一步暴露,由于疏水作用蛋白质聚集而沉淀。因此最先沉淀的是蛋白质表面疏水残基最多的蛋白质。
e、离子交换色谱法:
常用的是阳离子交换树脂,具有带负电荷的固定相和带正电荷的交换相,带正电荷的蛋白质颗粒与H+进行离子交换而被吸附在树脂上。正电荷多的蛋白质与树脂结合较强,正电荷少的蛋白质与树脂结合较弱。用不同浓度的阳离子洗脱液洗脱(如NaCl),通过Na +的离子交换作用,分离带不同电荷的蛋白质
f、电泳法:根据蛋白质的相对分子质量不同,所带电荷不同,来分离不同的蛋白
7、蛋白质的一级结构
1)蛋白质的一级结构是指蛋白质多肽链中氨基酸的排列顺序(sequence),一级结构的主要连接键是肽键,通常将二硫键也归属于一级结构
2)蛋白质的序列具有方向性,一般书写顺序是从N-端到C-端, 其主要作用是决定蛋白质分子的高级结构和功能
3)蛋白质一级结构的测定步骤
1蛋白质中肽链的拆离(亚基与分子间二硫键)
2肽链分子内二硫键的断裂
3肽链氨基酸组成分析
4氨基酸末端分析
5肽链的部分降解及肽片断的分离
6肽段氨基酸组成分析及末端分析
7肽段序列重叠
8二硫键的定位
8、蛋白酶的水解专一性:
胰蛋白酶(trypsin):只断裂Lys、Arg残基的羧基参与形成的肽键
胰凝乳蛋白酶(糜蛋白酶, chymotrypsin):只断裂Phe、Trp和Tyr等疏水氨基酸残基的羧基端肽键。
胃蛋白酶(pepsin):与胰凝乳蛋白酶类似,要求断裂点两侧的残基都是疏水性氨基酸
9、4种羧肽酶的来源和专一性

10、蛋白质的二级结构
蛋白质中多肽链主链自身盘绕折叠形成的在一维方向上有规律性的结构
1)基本类型:α-螺旋、β-折叠、β-转角、无规则结构
2)稳定二级结构的作用力:氢键?
(1) ?α-螺旋
结构要点:
(1) 肽键平面为单位,以?-碳原子为转折盘旋形成右手螺旋,螺旋的每圈有3.6个氨基酸,螺旋间距离为0.54nm,每个残基沿轴旋转100?,上升0.15nm
(2) 主链原子构成螺旋的主体,侧链在其外部,直径约为0.5nm
(3) 每个肽键的羰基氧与远在第四个氨基酸氨基上的氢形成氢键(共形成n-4个氢键),所有肽键都能参与链内氢键的形成,氢键的方向与中心轴大致平行, 具有偶极距,是稳定螺旋的主要作用力
(4) Pro的N上缺少H,不能形成氢键,经常出现在?-螺旋的端头,它改变多肽链的方向并终止螺旋
(2)?β-折叠
由两条或者多条几乎完全伸展的肽链平行排列,通过链间的氢键交联而成的锯齿状的折叠构象。常为两条或两条以上伸展的多肽链侧向聚集在一起形成扇面状,故又称β- 折叠片或β- 片层
结构特点:
(1) 相邻肽键平面的夹角为110? ,呈锯齿状排列;侧链R基团交错地分布在片层平面的两侧
(2) 2~5条肽段平行排列构成,肽段之间可顺向平行(均从N-C),也可反向平行
(3)由氢键维持稳定,其方向与折叠的长轴接近垂直
(3) ?β-转角
肽链出现180?回折的转角处结构称为β- 转角
结构特点:
第一个残基的C=O与第四个残基的N-H形成氢键,常见于连接反平行β-折叠片的端头(如Gly与Pro),多位于球状蛋白质分子表面,约占全部残基的四分之一
(4) 无规卷曲(Random coil)
没有确定规律性的肽键构象
特点:
常见于球状蛋白质分子中,在其它类型二级结构肽段之间起连接作用,有利于整条肽链盘曲折叠


11、结构域
结构域通常是几个超二级结构的组合,对于较小的蛋白质分子,结构域与三级结构等同,即这些蛋白为单结构域;较大的蛋白质分子或亚基往往由两个以上结构域缔合而成三级结构
12、 维系蛋白质结构的作用力
维系蛋白质结构的作用力
1. 肽键,共价键,维系蛋白质一级结构
2. 二硫键,共价键,维系蛋白质三级结构
3. 次级键,非共价键,维系蛋白质空间结构











 次级键的种类:氢键、疏水相互作用、离子键和范德华力
次级键的种类:氢键、疏水相互作用、离子键和范德华力
稳定蛋白质三维结构的作用力

? 氢键对维持二级结构特别重要;
?疏水作用对维持三级结构特别重要。
蛋白质三级结构的其它特点:
1、许多在一级结构上相差很远的氨基酸碱基在三级结构上相距很近。
2、 三级结构是蛋白质发挥生物活性所必须的。
3、所有具有高度生物学活性的蛋白质几乎都是球状蛋白。
4、球状蛋白的三级结构很密实,大部分的水分子从球形蛋白的核心中被排出, 这使得极性基团间以及非极性基团间的相互用成为可能。
13、蛋白质的四级结构(Quaternary structure)
许多蛋白质是由两个或两个以上独立的球状蛋白质通过非共价键结合成的多聚体,称为寡聚蛋白。寡聚蛋白中的每个独立的球状蛋白质称为亚基(subunit),亚基一般由一条肽链构成,也称为单体(monomer)。蛋白质的四级结构是指亚基的种类、数量以及各个亚基在寡聚蛋白质中的空间排布和亚基间的相互作用。
四级结构的特点:
亚基单独存在时无生物活性,只有相互聚合成特定构象时才具有完整的生物活性
亚基之间以非共价键结合,容易彼此解离
一级结构规定了亚基间的结合方式,四级结构的形成遵从“自我装配”的原则
大多数寡聚蛋白质分子的亚基的排列是对称的,对称性是四级结构蛋白质最重要的性质之一
第二部分 酶
1、酶:具有催化能力的生物大分子,包括蛋白质、核酸等。
酶促反应:酶催化的生物化学反应。
底物:在酶催化下发生化学变化的物质
2、 酶促反应的特点:
酶促反应具有高效性;酶促反应具有高特异性;酶促反应具有温和性
3、 酶的命名
1)习惯命名法
以酶的底物和反应类型命名,有时还加上酶的来源。
2)系统命名法
系统名称包括底物名称、构型、反应性质,最后加一个酶字。
4、 酶的分类:
氧化还原酶、转移酶、水解酶、裂解酶、异构酶、合成酶;+1(核酸酶)
5、 酶的化学组成与结构
1)酶的本质就是蛋白质
2)某些RNA有催化活性
3)酶的结构类别
A、组成分类法:单纯蛋白质酶类+结合蛋白质酶类(酶蛋白质+辅因子(金属离子、金属有机物、小分子有机物))
B、特征分类法:单体酶+寡聚酶+多酶复合体
4) 结合酶(全酶)= 酶蛋白 + 辅因子
酶的催化专一性主要决定于酶蛋白部分(底物专一性)
酶的催化类型主要决定于辅因子(反应专一性)
5) 维生素
大多数辅酶的前体是维生素,主要是水溶性B族维生素
维生素一般习惯分为脂溶性和水溶性两大类。其中脂溶性维生素在体内可直接参与代谢的调节作用,而水溶性维生素是通过转变成辅酶对代谢起调节作用。
脂溶性维生素:维生素A,D,E,K均溶于脂类溶剂,不溶于水,在食物中通常与脂肪一起存在,吸收它们,需要脂肪和胆汁酸。
6)酶分子的结构
A、活性中心或活性部位:酶分子中直接与底物结合,并和酶催化作用直接有关的部位。
结合基团,与底物进行结合;催化基团,将底物进行催化。
组成酶活性中心的氨基酸侧链基团主要有Glu和Asp的-COOH,
Lys的ε-NH2,His的咪唑基,Ser的-OH,Cys的-SH,Tyr的
侧链基团
7种AA频率最高:Ser, His, Cys, Tyr, Asp, Glu 和 Lys
B、酶的必需基团(essential group):参与构成酶的活性中心和维持酶的空间构象所必需的基团
这些基团若经化学修饰使其改变,则酶的活性丧失。
7)活性中心的特点:
(1) 活性部位在酶分子的总体中只占相当小的部分,通常只占整个酶分子体积的1% ~ 2%
(2) 酶的活性部位是一个三维实体
(3) 酶活性部位的结构互补性
(4) 酶活性部位的位置
酶的活性部位位于酶分子表面的一个裂缝(Crevice)内,底物分子(或一部分)结合到裂缝内并发生催化作用
(5) 酶活性部位的柔性或可运动性
(6) 酶和底物之间的作用力
酶与底物之间通过次级键相互识别和结合,如氢键、离子键、范德华力、疏水相互作用
8)研究酶活性部位的方法
1、切除法
应用专一性蛋白水解酶将酶分子的肽链切除一部分,然后测定其剩余部分的活性。
2、 酶分子侧链基团的化学修饰法(共价修饰)
酶活性中心氨基酸残基所含的官能团如巯基、羟基、咪唑基、氨基、羧基和胍基等是多种酶活性中心的必需基团,当这些基团被化学修饰后,酶的催化活性将降低甚至消失
3、 X-射线晶体结构分析法
4、 定点突变法(site-directed mutagenesis)
根据蛋白质结构研究结果,采用定点突变技术改变编码蛋白质基因中的DNA序列,研究酶活性部位的必需氨基酸
6、 酶的分离、纯化和活力的测定
1)酶活力:指酶催化一定化学反应的能力,可以用酶促反应速度来表示,两者呈线性关系。
2)酶促反应速度:以单位时间底物浓度的减少或产物浓度的增加来表示。
测定酶活力时,为了保证所测定的速率是初速率,以底物浓度的变化在起始浓度的5%(或小于10%)以内的速率为初速率
在测定酶活力的时候,往往使底物浓度足够大,这样整个酶反应对底物来说是零级反应,对酶来说是一级反应,这样测得的速率就比较可靠地反映酶的含量。
3)酶的转换数(turnover number, TN, 等于催化常数Kcat)是指一定条件下单位时间内每个酶分子转换底物的个数。大多数酶对它们天然底物的转换数的变化范围为1-10000/s
4)酶的比活力(specific activity):酶学研究及生产中经常使用,指每mg蛋白所含的酶活力单位数。比活力大小可以代表酶的纯度,对同一种酶,比活力越大,酶的纯度越高;比活力大小也可用来比较每单位质量蛋白质的催化能力, 对同一种酶,比活力越大,酶催化能力越强。比活力(U/mg) = 总活力/酶总量
5)回收率和纯化倍数
回收率=每次总活力/第一次总活力
纯化倍数=每次比活力/第一次比活力
6)酶的分离、纯化需要注意的几点是:
(1)选材 (2)尽可能低温操作(0~4℃)
(3)在分离提纯过程中,不能剧烈搅拌
(4)提纯溶剂中加一些保护剂如加少量EDTA、β-巯基乙醇或蛋白酶抑制剂PMSF。
为什么?
加少量EDTA防止重金属对酶的破坏;
含巯基的酶提取中加少量β-巯基乙醇可防止被氧化;
加入少量蛋白酶抑制剂PMSF等防止内源蛋白酶对酶的水解作用。
7、酶作用机制
1)酶催化作用的本质是酶的活性中心与底物分子通过短程非共价力(如氢键,离子键和疏水键等)的作用,形成ES过渡态,使底物的价键状态发生形变或极化,激活底物分子和降低过渡态活化能。
2)酶高效催化的机理
A、邻近效应和定向效应
8、酶的作用动力学(kinetics)
1)影响酶促反应速度的因素:
底物浓度、酶浓度 、 pH、温度、激活剂、抑制剂。
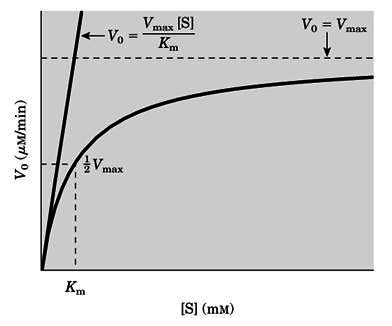
2)米氏方程
V: 反应速率,
Vmax: 酶完全被底物饱和时的最大反应速率
[S]: 底物浓度
Ks: ES的解离常数
?
在底物浓度低时,反应速率与底物浓度成正比,表现为一级反应特征;
当底物浓度达到一定值时,几乎所有的酶都与底物结合后,反应速率达到最大值,此时再增加底物浓度,反应速率不再增加,表现为零级反应;
当反应速率达到最大速率一半时,Km=[S],即米式常数是反应速率达到最大速率一半时的底物浓度,单位为mol/L。
(2)Km是酶的一个特征物理常数,只与酶的性质有关,与酶的浓度无关,通过测定Km值可以鉴别酶
(3)如果一种酶能催化几种不同的底物,对每种底物都有一个特定的Km值,其中Km值最小的称该酶的最适底物
(4)Km与Ks:Km不等于Ks(Ks =[ES]/[E][S]),只有在特殊情况下即: k2>>k3,Km=Ks。在Km=Ks 时,Km可表示酶和底物的亲和力, Km越小,E对S的亲合力越大,Km越大,E对S的亲合力越小。
3)米氏常数的求法
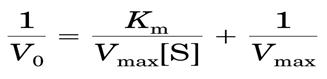 双倒数作图法(Lineweaver-Burk作图法)
双倒数作图法(Lineweaver-Burk作图法)
4)激活剂对酶反应速度的影响
凡是能提高酶活性的物质,称为酶的激活剂(activator)
5)抑制剂对酶作用的影响
凡使酶的某些基团的化学性质改变而导致酶的催化活性降低或丧失的物质,叫酶的抑制剂(inhibitor)
抑制剂使酶的催化活性降低或丧失而不引起酶蛋白变性的作用称为抑制作用(inhibition)
酶的抑制剂一般具备两个方面的特点:
a. 在化学结构上与被抑制的底物分子或底物的过渡状态相似
b. 能够与酶的活性中心以非共价或共价的方式形成比较稳定的复合体或结合物
类型:不可逆抑制作用;可逆抑制作用
(1) 不可逆抑制作用
定义:抑制剂与酶的必需基团以共价键结合而使酶活性丧失,不能通过透析、超滤等物理方法除去抑制剂而使酶复活。
由于被抑制的酶分子受到不同程度的化学修饰,故不可逆抑制也就是酶的修饰抑制
(2)可逆抑制作用
定义:抑制剂与酶以非共价键结合而引起酶活力降低或丧失,能通过透析、超滤等物理方法除去抑制剂而使酶复活

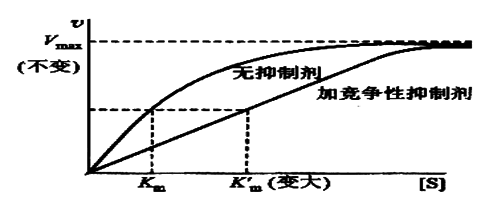
A、竞争性抑制作用
定义:抑制剂(I)和底物(S)竞争酶的结合部位,从而影响底物与酶的正常结合
B、非竞争性抑制作用
定义:抑制剂和底物同时与酶分子结合,两者没有竞争作用
C、反竞争性抑制作用
定义:酶只有与底物结合后,才能与抑制剂结合,即 ES+I ? ESI, ESI ? P。反竞争性抑制作用多见于多底物反应中,而在单底物反应中比较少见。
(3)可逆抑制作用动力学
(1) 竞争性抑制
双倒数式:
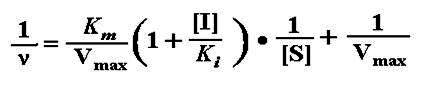
有竞争性抑制剂存在时,Km值增大(1+[I]/Ki)倍,且Km值随[I]的增高而增大;
在[E]固定时,当[S] ﹥﹥ Km (1+[I]/Ki), Km (1+[I]/Ki)项可忽略不计,则v= Vmax,即最大反应速度不变
(2)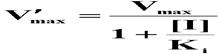
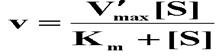 非竞争性抑制作用的速度方程
非竞争性抑制作用的速度方程
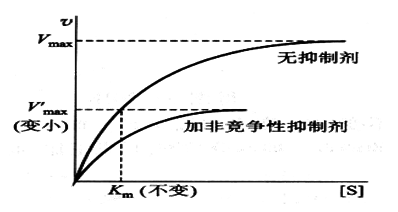
有非竞争性抑制剂存在时,v值减小(1+[I]/Ki)倍,且v值随[I]的增高而降低;
Km值不变。
(3)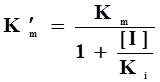 反竞争性抑制作用动力学方程讨论
反竞争性抑制作用动力学方程讨论

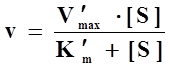 动力学方程 :
动力学方程 :

附:同工酶:
催化相同的化学反应,但其蛋白质分子结构、理化性质和免疫性能等方面都存在明显 差异的一组酶
第三部分 核酸
1、核酸的发现
1868年,瑞士青年科学家米歇尔(F.Miescher)从包裹伤口绷带的脓细胞的细胞核中提取到一种可溶于稀碱而不溶于稀酸,并含磷量之高超过任何当时已经发现的有机化合物的强酸性物质,当时就称它为核素(nuclein)
2、核酸的种类、分布和特点
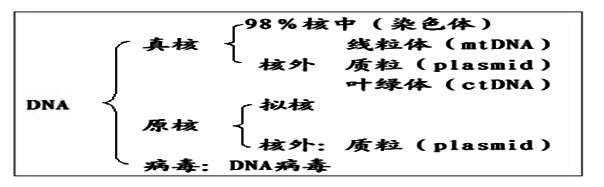
?DNA: 通过复制传递遗传信息至子代,主要的遗传物质
环状双链DNA: 原核生物染色体、细胞器及质粒DNA
线型双链DNA: 真核核内染色体DNA
病毒DNA有环状、线性、单链、双链之分
RNA:转运RNA(tRNA):翻译氨基酸, 转运到核糖核蛋白体
信使RNA(mRNA):将DNA遗传信息传递到核糖核蛋白体
核糖RNA(rRNA):核糖核蛋白体主要部分,参与蛋白合成
3、核酸的组成:
成分:碱基,戊糖,磷酸;单位(结构单元):核苷酸
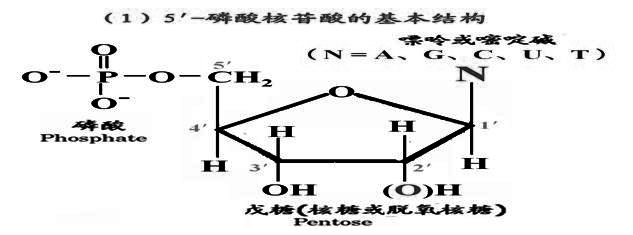
4、核酸的结构:
一)核酸的一级结构
由四种不同的核苷酸单元按特定核苷酸顺序(碱基顺序)组合而成的线性结构聚合物。核酸的碱基顺序是核酸的一级结构。
5、DNA双螺旋结构的要点
(1)主链(backbone):由脱氧核糖和磷酸基通过酯键交替连接而成。主链有二条, 相互平行而走向相反,围绕同一中心轴形成右手双螺旋结构。碱基平面与纵轴垂直,磷酸与核糖在外侧,糖环平面与纵轴平行,双螺旋就是针对二条主链的形状而言的。
(2)碱基对(base pair):位于螺旋的内侧, 垂直于螺旋轴通过糖苷键与主链糖基相连。同一平面的碱基在二条主链间形成碱基对。DNA结构中的碱基对与Chatgaff的发现正好相符。
两条链通过碱基配对,由疏水作用和氢键维系在一起,A与T,G与C结合,由一条链通过碱基互补决定另一条链。
(3)大沟和小沟:双螺旋表面凹下去的较大和较小沟槽。
(4)结构参数:双螺旋平均直径为2nm,相邻碱基对平面的间距0.34nm,两核苷酸间夹角为36?,每一圈10对核苷酸,螺距为3.4nm
(5)碱基在一条链上的排列顺序不受任何限制。但根据碱基配对原则,当一条多核苷酸链的序列被确定后可决定另一条互补连的序列。表明遗传信息由碱基的序列所携带
6、稳定DNA双螺旋结构的化学键
(1)互补碱基对之间的氢键
(2)双螺旋结构内部形成的疏水区,消除了介质中水分子对碱基之间氢键的影响。
(3)碱基堆积力包括疏水作用力和范德华力
(4)磷酸基上的负电荷与介质中的阳离子之间形成的离子键 ,降低了DNA链之间的排斥力
7、比较蛋白质α-螺旋和DNA双螺旋结构中的氢键,包括它在稳定这两种结构中的作用
在蛋白质多肽链α-螺旋中多肽主链上羰基氧与酰胺基的氢之间形成氢键,大体上与螺旋轴平行。残基的侧链从主链中伸出,不出现在螺旋内,不参与螺旋内的氢键形成。螺旋中众多氢键累积可稳定螺旋的结构,特别是蛋白质疏水的内部,没有水分子竞争氢键的形成。
在DNA分子中,氢键的形成不涉及糖-磷酸骨架,大体上与螺旋轴垂直,每个碱基对可形成两个或三个氢键。允许一条链对另一条链起模板的作用,碱基堆积力对螺旋的稳定作用更大
8、DNA的双螺旋结构的意义
揭示了DNA作为遗传物质的稳定性特征
确认了碱基配对原则,这是DNA复制、转录和反转录的分子基础,亦是遗传信息传递和表达的分子基础。
奠定了生物化学和分子生物学乃至整个生命科学飞速发展的基石。
 9、
9、

10、DNA和基因的关系
DNA的基本功能是以基因的形式荷载遗传信息,并作为基因复制和转录的模板。它是生命遗传的物质基础,也是个体生命活动的信息基础。
基因从结构上定义,是指DNA分子中的特定区段,其中的核苷酸排列顺序决定了基因的功能。
11、.非共价键有哪几种?论述这些非共价键在稳定核酸和蛋白质构象中的重要作用
非共价键主要有氢键、离子键、范德华力、疏水相互作用
氢键:氢键是稳定蛋白质二级结构的主要作用力。氢键是维持DNA双螺旋结构的横向作用力。
离子键:在生理pH下,蛋白质中酸性氨基酸的侧链可解离成负离子,碱性氨基酸的可解离成正离子。在大多数情况下这些氨基酸残基都分布在球状蛋白质分子的表面,与介质水分子发生电荷-偶极之间的相互作用,形成排列有序的水化层,这对稳定蛋白质的构象有一定的作用。在生理条件下,DNA带有大量的负电荷,吸引着各种阳离子如多胺、组蛋白、Mg2+等形成离子键,消除了自身各部位之间因负电荷而产生的斥力,增加了DNA分子的稳定性。
疏水相互作用:水介质中球状蛋白质的折叠总是倾向于把疏水残基埋在分子内部,疏水相互作用是稳定蛋白质三级结构和四级结构的主要作用力。DNA中芳香碱基的π电子之间相互作用,使碱基发生缔合,碱基有规律层层堆积,在DNA内部形成一个疏水核心区,有助于氢键形成,是维持DNA双螺旋结构稳定的纵向作用力。
范德华力:包括吸力和斥力。非共价键结合原子或分子相互靠得太近时产生斥力;非共价键结合原子处于一定距离时范德华吸力会达到最大。范德华力相互作用数量大且具有加和效应和位相效应,是稳定蛋白质和核酸构象不可忽视的一种作用力
12、DNA双螺旋模型建立的重要意义在于:
A. 证明了遗传物质是DNA,而不是蛋白质
B、揭示了DNA的结构奥秘,为解决“DNA是如何遗传的”这一难题提供了依据
C、表明DNA的两条链反向平行排列,呈右手螺旋结构
D、表明DNA的3个连续的核苷酸组成1个遗传密码
13、核酸的性质:
DNA为白色类似石棉样的纤维状物
大都呈酸味,肌苷酸、鸟苷酸具有鲜味
溶于水,不溶于乙醇、氯仿等有机溶剂。DNA钠盐在水中为10g/L,呈黏性胶体溶液。 RNA钠盐在水中溶解度可达40g/L。
在酸性溶液中,DNA、RNA易水解,在中性或弱碱性溶液中较稳定,DNA在碱中变性,但不水解,RNA水解。
DNA溶液的粘度很大,抗剪切力差,而RNA溶液的粘度小得多。核酸发生变性或降解后其粘度降低。
加热条件下,D-核糖+浓盐酸+苔黑酚 绿色
D-2-脱氧核糖+酸+二苯胺 蓝紫色
14、核酸的变性和复性与分子杂交
1)、 变性
稳定核酸双螺旋的次级键断裂,空间结构破坏,变成单链结构的过程。核酸的一级结构(碱基顺序)保持不变。
变性表征
生物活性部分或全部丧失、粘度下降、浮力密度升高、紫外吸收(260nm)增加(增色效应)
变性因素 pH(>11.3或<5.0)
变性剂(脲、甲酰胺、甲醛)
低离子强度 加热
融点(Tm)
DNA双螺旋结构发生一半变性时的温度,又叫做熔解温度、变性温度、解链温度
2)、复性
变性核酸的互补链在适当的条件下,重新缔合成为双螺旋结构的过程称为复性
DNA复性后,一系列性质将得到恢复,但是生物活性一般只能得到部分的恢复,具有减色效应
将热变性的DNA骤然冷却至低温时,DNA不可能复性。变性的DNA缓慢冷却时可复性,因此又称为“退火”。
退火温度=Tm-25℃
3)、 分子杂交与印渍技术
不同来源的单链核酸(DNA或RNA),只要它们具有大致相同的碱基序列,经过退火处理,就能重新形成杂种双螺旋,这一现象称为分子杂交(molecular hybridization)。
15、DNA的复制和RNA的转录
1)中心法则的几个基本概念
复制:以亲代DNA或RNA为模板,根据碱基配对的原则,在一系列酶的作用下,生成与亲代相同的子代DNA或RNA的过程。
转录:以DNA为模板,按照碱基配对原则合成RNA,即将DNA所含的遗传信息传给RNA,形成一条与DNA链互补的RNA的过程
翻译:以mRNA为模板,将mRNA的密码解读成蛋白质的氨基酸顺序的过程
逆转录:以mRNA为模板,在逆转录酶的作用下,生成DNA的过程
2)以DNA为模板的DNA复制
A、DNA复制是半保留的(semiconservative replication)
B、DNA复制起点和方向的多样性
C、DNA复制是半不连续复制
DNA双螺旋的两条链是反向平行的,而合成方向只能是5‘?3’。所以在DNA复制时,1条链的合成方向和复制叉的前进方向相同,可连续复制,称为前导链;而另一条链的合成方向和复制叉的前进方向正好相反,不能连续复制,只能分成几个片段合成,称为滞后链。滞后链的片段叫作冈崎片段,它们合成后再连接起来
D、DNA复制需要多种酶协同作用
E、DNA的合成步骤
解旋:由拓扑异构酶解除DNA的超螺旋结构
?解链:由解链酶使双链DNA解开
?识别起点并生成引物:以DNA为模板在引物酶作用下完成
?DNA的生成:在RNA引物3’末端按碱基互补原则经DNA聚合酶III催化生成
?切除引物:由DNA聚合酶I催化切除引物即冈崎片段
?补齐封口:DNA聚合酶I按碱基互补原则沿5’—3’方向填补两个冈崎片段之间的缺口, 在DNA连接酶催化下最终形成模板链的新的互补链
16、复制的忠实性
DNA复制具有高度精确性,在大肠杆菌的细胞DNA复制中其错误率约为1/109~1/1010,即每109~1010个核苷酸才出现一个错误。这么高的精确性的保证主要与下列因素有关:
DNA聚合酶的高度专一性(严格遵循碱基配对原则,错配率仅为7x10-6 )
DNA聚合酶的校对功能(错配碱基被3’-5’外切酶切除)使碱基的错配几率又降低100~1000倍
DNA的损伤修复系统
起始时以RNA作为引物

