××级××专业毕业生实习报告分析报告
××年××月××日至××月××日,××系××专业毕业生进行了为期三周的集中实习工作,实习地点主要是各××公司的××部门。实习结束后,按照要求,绝大部分同学均写出了符合要求的实习报告。
从实习报告来看,有以下几点值得表扬:
一、从实习态度上,大部分同学的实习态度比较端正,思想认识比较到位。 很多同学在实习报告中,都指出了这次实习是对大家三年学习生活的集中检验。通过实习,大部分同学认识到,在学校学习的知识仅仅是打好了理论基础,在实践中需要学习的知识实在是太多了。很多同学都指出,这次实习在他们的思想上引起了很大的震动,大家不再以天之骄子自居,很多知识都需要从头学起,工作中很多人都可以当自己的老师。同时,很多同学也形成了良好的就业心态。因此,总体上说,这次实习收到了较好的效果。
二、从实习报告的内容上,可以看出达到了预期的实习目的。
本次实习的内容主要要求同学们深入到××公司的第一线,熟悉××业务的××、××、××等环节,特别是要求跟着实习单位的指导教师熟悉××业务,了解××工作的酸甜苦辣。从同学们的实习报告上看,上述目的在大部分同学身上都体现了出来。
二、从实习报告的格式上,大部分同学都能按照要求撰写。
实习报告中,要求应有对实习工作的综述、自己在实习中的心得体会、自己在实习工作中取得的经验教训等内容。从实习报告来看,大部分同学都能按照要求撰写,对实习单位进行了简要地介绍,对实习指导教师指导态度进行了中肯的表扬,对自己的思想变化进行了详细的描述。更有一部分同学在实习报告中深
刻剖析了自己的思想根源,分析了自己在工作中的优势和劣势,认识到了此次实习非常重要,是自己从学生迈向社会的纽带和桥梁。
三、从实习报告的质量上,大部分同学的实习报告质量较好。
大部分同学的实习报告,均能做到叙事条理清晰,分析问题深刻,中心思想明确,重点内容突出,思想认识到位,就业心态端正。而且在格式要求上,都能按照要求的格式进行撰写,在规定的时间内能如数上交。很多同学都谈到了此次实习的重要性,特别是在人际关系上,在实习中,有处理不好的问题,指导教师会随时指出,而将来如果参加工作后,就没有这么好的机会了。恐怕需要自己碰了好多壁后才能说“吃一堑,长一智”。更有一些同学的实习报告堪称优秀,行文流畅,有理有据,不仅在文章中剖析了自己的思想根源,更能开拓视野,从行业或社会的角度来看待、分析问题,体现出了较高的思辨水平和理论联系实际的能力。
但是有些同学的实习报告,明显可以看出是敷衍之作,内容单薄,格式不一,叙事不清,用词混乱,从头到尾看不出任何自己的思想。希望这些同学在以后的工作中能脚踏实地,实事求是,认真做事,否则,将会对自己的将来发展有不利的影响。
××
第二篇:分析实习报告
实 习 报 告
一、实习目的及要求 目 录
分析化学课程实习是不可缺少的实践性教学环节。根据教学大纲要求,通过两周的实习,学生应了解试样的采集、保存和制备方法,了解试样的常规分析项目及质量技术指标,掌握常见分析检测方法及其操作,熟悉有关仪器设备的使用方法,并初步具有分析解决实际遇到的具体问题的能力。实习中应注重培养和提高动手能力,进一步巩固和深化课堂理论知识,达到理论与实践相辅相成,融会贯通,为今后参加工作奠定一定基础,并通过实习培养学生良好的职业道德观和团队分工协作精神。
要求明确课程实习目的和任务;实习方案经指导老师审阅通过后才能进行下一步实习工作;认真实习,如实填写实习记录本;每一组同学既要合作,又要独立完成分析检测工作。
二、实习内容
根据给出的试样(水样、铁矿石、全脂乳粉等)查找资料,了解常规分析项目、分析方法及质量技术指标,选择其中的3-4个项目写出实习方案,并进行分析检测(包括溶液的配制等准备工作),实习结束后写出实习报告,并对结果进行分析。
三、实习安排
实习时间:根据教学安排,课程实习于18周开始,为时两周。
实习地点:3-505
12月19日 召开分析课程实习动员大会
12月19~20日 预习网上查找资料,领取实验器材与药品
12月21日 配制实验所需溶液
1
12月22~26日 铁矿石的各成分的具体实验分析
12月27日 整理仪器药品
四、赤铁矿中全铁含量的测定——重铬酸钾法
1 原理 在盐酸介质中,用SnCl2-TlCl3将试液中的Fe(Ⅲ)还原为Fe(Ⅱ), 钨酸钠作指示剂,当无色钨酸钠溶液变为蓝色(钨蓝)时,表示Fe(Ⅲ)已还原完全。用重铬酸钾溶液氧化过量的三氯化钛至钨蓝刚好消失,最后以二苯胺磺酸钠作指示剂,用重铬酸钾标准溶液滴定至呈稳定的紫红色即为终点。滴定反应如下:
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++ 7H2O
为了消除蒸馏水、试剂纯度的影响,应同时做空白实验校正。
2 适用范围
本标准适用于铁矿石、铁精矿、烧结矿和球团矿中全铁童的测定。
测定范围:20%以上。
含矾量大于0.5%的样品,不宜采用本法。
3 主要仪器
分析天平,烘箱,电炉,容量瓶(1000mL,100mL),50mL酸式滴定管等。 4 试剂
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。
4.1 盐酸 1.19g/mL
4.2 盐酸(1+9):1体积浓盐酸(4.1)与9体积水混合
4.3 硫酸(ρ1.84 g/mL)
4.4 硫酸(5+95):5体积浓硫酸(1.84g/mL)与95体积水混合
4.5 磷酸(ρ1.70 g/mL)
4.6 三氯化钛溶液(15%~20%)
4.7 三氯化钛溶液(1+19):将市售三氯化钛溶液(4.6)用(1+9)盐酸稀释20倍,用时现配。
4.8 硫磷混酸:边搅拌边将200mL硫酸(4.3)慢慢注入500mL水中加300mL磷酸(4.5) 混匀。
4.9 0.5%二苯胺磺酸钠溶液:称取0.5g二苯胺磺酸钠溶解于100mL水中,如溶液浑浊,可滴加少量HCl溶液。
4.10 0.05mol/L硫酸亚铁铵溶液:称取19.7g硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O溶解于(5+95)硫酸中,定量转入1L容量瓶中,用(5+95)硫酸稀释至刻度,混匀。
4.11 25%钨酸钠溶液:称取25g钨酸钠溶于适量水中,加5mL磷酸(4.5) 用水稀释至100mL,混匀。
2
4.12 6%氯化亚锡溶液:称取6g氯化亚锡,溶解于20mL热盐酸(3.1)中,加水稀释至100mL,混匀,加一锡粒(也可不加),贮于棕色瓶中。
4.13 0.00833 mol/L重铬酸钾标准溶液:称取2.4518g预先在150℃烘干2h并在干燥器中冷却至室温的重铬酸钾(基准或优质纯试剂),溶解在适量水中,定量移入1000mL容量瓶中,用水稀释至刻度,混匀。 5 测定步骤
5.1样品分解
铁矿石属于较难分解的矿物,分解速度很慢,分析试样应通过200目筛,或试样粒度不大于0.074mm。
准确称取铁矿石粉0.15~0.20g三份,分别置于锥形瓶中,加少量水使试样湿润,加入20mL浓HCl,在通风柜中用电炉低温加热分解试样,加热过程中不断摇动(若有带色不溶残渣,可滴加20~30滴SnCl2助溶),直至样品分解完全(锥形瓶底部无黑色颗粒,仅剩余白色的SiO2)。试样分解完全后,用少量水吹洗表面皿及锥形瓶壁,总体积不得超过30mL。
5.2样品还原
试液于电炉上低温加热至近沸,趁热边摇动锥形瓶边滴加6%SnCl2 还原Fe3+(先快后慢)至溶液呈浅黄色。加100mL蒸馏水(此时控温在50—60oC,温度过高可用流水冷却),25%钨酸钠指示剂15滴,边摇动锥形瓶边滴加(1+19)TiCl3溶液将试液还原至蓝色(钨蓝),滴加0.00833 mol/L重铬酸钾标准溶液氧化过量TiCl3至蓝色刚好消失(不计数)。
5.3样品滴定
将样液流水冷却至室温,以水稀释至溶液体积约为150ml, 加入15mL硫磷混酸,0.5%二苯胺磺酸钠指示剂4滴,用0.00833 mol/L重铬酸钾标准溶液滴定至呈稳定的紫红色即为终点,准确记录消耗的重铬酸钾标准溶液体积。
滴定中颜色变化:无色 →绿 →紫。
5.4空白实验
按上述步骤进行操作(空白溶液不加铁矿石粉),在150ml水溶液中准确加入6.00mL 0.05mol/L硫酸亚铁铵溶液,加15mL硫磷混酸溶液,0.5%二苯胺磺酸钠指示剂4滴,立即用重铬酸钾标准溶液滴定至紫红色终点,记下消耗重铬酸钾标准溶液的体积V1。再向溶液中准确加入6.00mL硫酸亚铁铵溶液,仍以重铬酸钾标准溶液滴定至紫红色终点,记下消耗重铬酸钾标准溶液的体积V2。则(V1-V2)即为空白实验消耗重铬酸钾标准溶液的体积V0。
6 计算
c(V?V0)?55.85?6?10?3
wFe??100 m
3
式中:V ——滴定试液时消耗重铬酸钾标准溶液的体积,mL;
V0——滴定空白实验消耗的重铬酸钾标准溶液体积,mL; c——重铬酸钾标准溶液的浓度,mol/L; m——试料质量,g;
55.85——铁的摩尔质量,g/mol; 6——重铬酸钾标准溶液与铁的相关系数。 数据记录与处理
空白实验消耗重铬酸钾标准溶液的体积V0:2.80 mL c——重铬酸钾标准溶液的浓度,0.00833mol/L
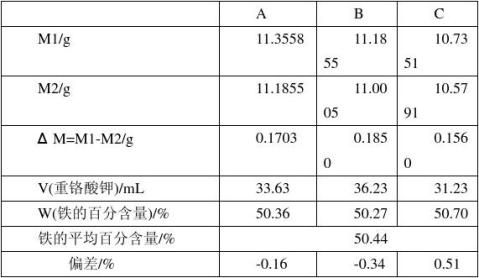
查资料可知: 赤铁矿石TFe≥52%;小于国家标准 7 注意事项
7.1 铁还原后的溶液应立即冷却,及时滴定,久置会使亚铁离子被空气氧化。 7.2 近终点时滴定剂要慢慢地加入,过量K2Cr2O7可破坏指示剂的氧化型。 8 主要参考资料
GB/T 6730.5-1986 铁矿石化学分析方法 三氯化钛-重铬酸钾容量法测定全铁量。 9 实验小结
(1)所测得含铁量小于国家标准可能是因为铁矿石未完全溶解,溶液中有黑色未溶沉淀,可能是火开的太大使盐酸大量挥发而溶解不了。
(2)铁矿石溶解过程中加入了过多的氯化亚锡,使溶液成了无色,而影响了实验结果。
(3)盐酸具有挥发性在加热过程中应该盖上表面皿。
五、铁矿石中湿存水的测定——重量法
4
1 原理
铁矿石中含有一定的水分,本法是应用重量法测定铁矿石中的水分含量。 在一定温度(100~105℃)和压力(常压)下,将样品放在烘箱中加热干燥,除去挥发的水分,干燥前后样品的质量之差即为样品的水分含量。
2 适用范围
本法适用于铁矿石、铁精矿、烧结矿和球团矿中水分含量的测定。
3 仪器与样品
分析天平,烘箱(附温度自控器)等。
铁矿石颗粒(粒度小于20mm)。
4 测定步骤
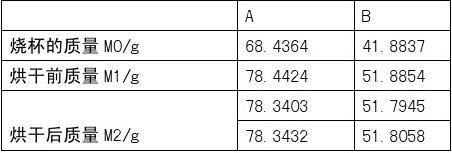
4.1 烧杯(或玻璃皿)的准备
取100mL烧杯(或玻璃皿)两个,洗净,放入105±2℃烘箱中,干燥1h后取出,在干燥器中冷却至室温后称量,记下质量(m0)。
4.2 称取样品
称取10.00g粒度小于20mm的铁矿石样品两份,分别置于已恒重的烧杯(或玻璃皿)中。
4.3 样品干燥
将烧杯(或玻璃皿)中的样品铺平,放入105±2℃烘箱中,干燥2h后取出,趁热称量;记下质量。
将称量后的试样再次放入烘箱中,每烘30min取出,趁热称量一次质量,直至恒重(两次称量的质量之差不大于0.01g)为止。
5 计算
w水分=m1?m2=铁矿中存水的质量与铁矿石质量之比 m1?m0
式中:w水分——铁矿石样品中水分的质量分数;
m0——烧杯(或玻璃皿)的质量,g;
m1——烘干前烧杯(或玻璃皿)+样品的质量,g;
m2——烘干后烧杯(或玻璃皿)+样品的质量,g;
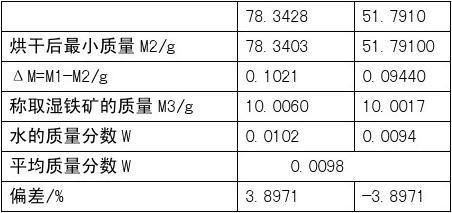
取两份样品的算术平均值作为分析结果,分析结果计算到小数点后第三位。 数据记录与处理
5
实
铁矿石的
数为A=0.0098=0.98%,小于国家标准的8%。
6 注意事项
4.1 注意铁矿石试样的选取,粒度应小于20mm,以便于干燥。
4.2 烘箱的温度要控制在105±2℃。
7主要参考资料
GB/T 6730.2-1986 铁矿石化学分析方法 重量法测定水分含量。
8 实验小结
(1)本次实验的关键是烧杯的恒重,以及铁矿石中的水分的充分烘干及恒重。
(2)铁矿石烘干的温度和时间都得控制好。
(3)本次试验中水分含量的质量分数为0.98%。
(4)铁矿石中水分的含量与下列因素有关:温度,湿度,铁矿石的种类等
(5)实验测得水分很少主要是因为样本本来就是已经干燥过储存在干燥器中的。
(6)烘箱中有很多湿气重的物品同时在烘干,从而影响了实验结果。 验测定的水质量分
六、铁矿石中镍含量的测定——丁二酮肟光度法
1 原理
试样以盐酸、硝酸分解,硫酸冒烟除去氮的低价氧化物,盐酸溶解盐类,过滤除去酸不溶物后得试液。
pH8~9时,镍与丁二酮肟生成红色配合物沉淀,用三氯甲烷萃取,稀盐酸溶液反萃取后,在NaOH介质中,用过硫酸铵作氧化剂,使镍与丁二酮肟生成稳定的酒红色配合物,在分光光度计上波长460nm处测量其吸光度,标准曲线法定量。
铁钛等离子用酒石酸掩蔽,显色液中钴大于0.1mg,铜大于0.2mg,锰大于
1.5mg对测定有干扰,此实验中不予考虑。
6
2 适用范围
本法适用于铁矿石、铁精矿、烧结矿、球团矿中镍量的测定。
测定范围:0.005~0.10%。
3 主要仪器
722型分光光度计,125mL分液漏斗,容量瓶等。
4 实验试剂
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。
4.1 盐酸ρ1.19g/mL
4.2 盐酸(1+23)
4.3 硝酸ρ1.42g/mL
4.4 硝酸(1+3)
4.5 硫酸(1+1)
4.6 氢氧化铵溶液(1+1)
4.7 过硫酸铵
4.8 盐酸羟胺
4.9 三氯甲烷
4.10 酒石酸钠溶液(25%)
4.11丁二酮肟(1%)乙醇溶液
4.12 乙二胺四乙酸二钠(EDTA)溶液(0.1%):用(1+1)氢氧化铵调至pH6~7。
4.13 镍显色液:称取8g NaOH溶于100mL水中,加5g酒石酸钾钠,搅拌使其溶解,冷却,加入0.5g丁二酮肟,搅拌使其溶解完全。
4.14 镍标准溶液
4.14.1 镍贮备液(500.0μg/mL):称取0.3181g氧化镍(基准试剂)溶于20mL硝酸(4.3)中,加2mL(1+1)硫酸,加热至冒SO3白烟5min以上,冷却,用水溶解盐类,冷却至室温后,定量转入500mL容量瓶中,用水稀释至刻度,混匀。此溶液1.00mL含500.0μg镍。
4.14.2 镍标准溶液(5.0μg/mL):分取5.00mL镍贮备液(500.0μg/mL)于500mL容量瓶中,用水稀释至刻度,混匀,此溶液1.00mL含5.0μg镍。
5 测定步骤
5.1 称样
一般试样粒度应小于100μm。
称取0.20~0.30g试样,精确至0.0002g。
5.2 空白试验
7
随同试样进行空白试验,所用试剂须取自同一试剂瓶。
5.3 试样处理
5.3.1 分解
将试样(5.1)置于250ml烧杯中,加少量水湿润,加15mL盐酸(4.1),低温加热至微沸数分钟,加5mL硝酸(4.3),4mL硫酸(4.5),加热至冒SO3白烟5min以上,取下稍冷,加5mL盐酸(4.1)和30mL水,加热溶解盐类,并煮沸2~3min,用中速滤纸过滤,洗涤,滤液收集于100mL容量瓶中,用水稀释至刻度,混匀,试液备用。
5.3.2分离,显色
根据试样含镍量分取10.00~20.00mL试液两份,置于两个125mL分液漏斗中,分别作显色液和参比液。
显色液:加5mL酒石酸溶液(4.10),混匀,加0.5g盐酸羟胺(4.8),摇动使其溶解,用水稀释至总体积为60~70mL,加入一小片刚果红试纸,用氢氧化铵(4.6)调至试纸变红,并过量15滴(此时应为pH8~9),加5mL丁二酮肟乙醇溶液(4.11),混匀,冷却。分别用10mL, 5mL三氯甲烷(4.9)萃取两次(每次振荡1min),合并有机相于另一分液漏斗中,弃去水相。用10mL EDTA溶液(4.12)洗涤有机相,振荡30 s,待分层后,将有机相放人另一分液漏斗中(尽量把有机相放尽,切不可把EDTA洗涤液放下去),水相中再加3mL三氯甲烷(4.9),振荡30s,分层后,合并有机相,弃去水相。分别用10mL, 5mL盐酸(4.2)两次反萃取有机相(每次振荡30s),弃去有机相,合并水相于50mL容量瓶中,加0.5g过硫酸铵(4.7),立即加入10mL镍显色液(4.13),混匀,放置10min后,用水稀释至刻度,混匀。
参比液(空白试验):同显色液操作,仅用5mL乙醇代替5.0mL丁二酮肟溶液。
5.4测量
将部分溶液移人3cm比色皿中,以随同试样空白为参比,于分光光度计460nm波长处测量其吸光度。从工作曲线上查出相应的镍量。
5.5 工作曲线的绘制
移取0.00,2.00,4.00,6.00,8.00,10.00mL镍标准溶液(4.14.2),分别置于6个125mL分液漏斗中,以下按5.3.2进行操作(但不必加盐酸羟胺)。将部分溶液移人3 cm比色皿中,以试剂空白为参比,于分光光度计460 nm波长处测量其吸光度。以镍量为横坐标,吸光度为纵坐标绘制工作曲线。
6 分析结果的计算
按下式计算样品中镍的质量分数:
8
wNi?
mV11
?6
mV1?101?A
式中:m1——从工作曲线上查得的镍量,μg;
m——测定时称取的样品量,g; V——试液总体积,mL; V1——分取试液体积,mL;
A是按GB 6730.3-86《铁矿石化学分析方法 重量法测定分析试样中吸湿水量》测定得到的水分质量分数,如使用预干燥试样,则A=0。
实验记录与处理
镍标准溶液的浓度为5.0μg/mL
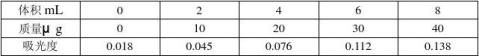
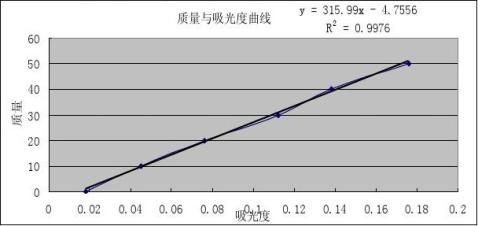
显色液的吸光度:0.233 根据Y=315.99X-4.7556=68..8701μg
参比液的吸光度:0.020 根据Y=315.99X-4.7556=1.5642μg
所以15 mL的显色液中含有镍的含量为:68.8701μg-1.5642μg=67.3059μg 根据公式可得:式中:m1——从工作曲线上查得的镍量,67.3059μg; 式中m——测定时称取的样品量,20.8133-20.5637=0.2496g;
V——试液总体积,100mL; V1——分取试液体积,15mL; 测定得到的水分质量分数A=0.0098 故该铁矿中镍的质量分数为:0.1815%
7 主要参考资料
GB/T 6730.39-1986 铁矿石化学分析方法 丁二酮肟光度法测定镍量。 8 实验小结
9
(1)该实验的关键是配制好一系列溶液,配制好了溶液后,再经过一系列的处理得到所需的待测溶液,然后才能进行吸光度的测量。
(2)分光度光度使用时得先预热,按其操作要求操作。
(3)使用药品是得特别小心,因为有的溶液有毒,有的对手有很大的伤害。 七、铁矿石中钙含量的测定——高锰酸钾容量法
1 原理
试样经盐酸,硝酸分解,过滤;以氢氧化铵将铁,铝,鈦等沉淀为氢氧化物,锰则以过硫酸铵氧化为水合二氧化锰与氢氧化物同时过滤除去,此时,磷以磷酸铁形式同时被分离。然后,使钙呈草酸钙沉淀,硫酸溶解后,以高锰酸钾标准溶液滴定,借此测定钙量。
2 适用范围
本法适用于铁矿石、铁精矿、烧结矿、球团矿中钙量的测定。
测定范围:1.50~15.0%。
3 试剂
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。
3.1 过硫酸铵。
3.2 盐酸(ρ1.19g/mL)。
3.3 盐酸(1+1)。
3.4 盐酸(5+95)。
3.5 硝酸(ρ1.42g/mL)。
3.6 硫酸(1+1)。
3.7 氢氧化铵(1+1)。
3.8 氢氧化铵(1+3)。
3.9 硝酸铵溶液(2%)。
3.10 草酸铵饱和溶液。
3.11 草酸铵溶液(0.25%)。
3.12 硝酸银溶液(0.1%)。
3.13 甲基红指示剂(0.1%):称取0.1g甲基红,溶于60mL乙醇中,以水稀释至100mL,混匀。
3.14 高锰酸钾标准溶液c(KMnO4)=0.02mol/L
3.14.1 配制:称取3.2g高锰酸钾,以适量水溶解,加热至微沸,冷至室温,以G3垂融漏斗过滤于1000mL棕色容量瓶中,用水稀释至刻度,混匀,与阴暗处放置一周后标定。
3.14.2 标定:称取0.2000g预先在105C烘干1h的草酸钠基准试剂;置于 10
400mL烧杯中,加约100mL水,25mL硫酸(3.6),加热至80~90C,以所配高锰酸钾溶液滴定至微红色并保持30s不褪色为终点。同时标定3份,取平均值,并须减空白试验值。
3.14.3 计算:
c=m/(0.335×V)
式中:c——高锰酸钾标准溶液浓度,mol/L;
m——称取草酸钠的质量,g;
V——标定时消耗高锰酸钾标准溶液的体积,mL;
0.335——1mL高锰酸钾标准溶液(1mol/L)相当于草酸钠的质量,g。
4 试样
4.1一般试样粒度应小于100﹪μm,如试样中结合水或易氧化物质含量高时,其粒度应小于160μm。
4.2试样量:称取0.5000g试样
5 分析步骤
5.1测定数量
同一试样,在同一试验室,应由同一操作者在不同时间内进行2-4次测定。
5.2空白试验
随同试样做空白试验,所用试剂必须取自同一试剂瓶。
5.3测定步骤
5.3.1试样的分解
将试样(4.2),置于300mL烧杯中,加入20mL盐酸(3.2),低温加热微沸约10min,使酸可溶物分解完全。加3到5mL硝酸(3.5)①,于低温蒸干。冷却,加10mL盐酸(3.2),微热使可溶性盐类溶解,加50mL热水,煮沸,用中速滤纸(加少许纸浆)过滤于另一个300mL烧杯中,用擦棒擦尽杯壁,以热盐酸(3.4)洗尽,并洗滤纸3~4次,再以热水洗5~6次,滤液与洗液合并作试液供测定用。
注:①如为烧结矿,加硝酸后,再加5mL高氯酸(ρ1.67g/mL)蒸发至发生浓厚白烟,直至成湿盐状,冷却后再继续操作。
②试样含氟,分解试样时,应改用200~300mL聚四氟乙烯(PTFE)烧杯,在加硝酸(2.6)后,再加5~10mL高氯酸(ρ1.67g/mL)加热蒸发至发生浓厚白烟,并保持约5分钟,冷却,以尽可能少的水冲洗杯壁,并继续加热至发生浓厚白烟,直至呈湿盐状。冷却后再继续操作。
③如试样含钡量大于1.0%,当加入50mL热水后,再加0.5mL硫酸(2.8),煮沸,冷至室温,用中速滤纸(加少量纸浆)过滤于另一个300mL烧杯中。以下按5.2.1中相应步骤进行。
5.3.2分离
11
将合并后的溶液以热水稀释至150-200mL,加热至溶液清亮,使熔融物及可能生成的硫酸钙溶解(钛量高时产生浑浊无防)。煮沸,取下,在搅拌下滴加氢氧化铵(3.7)至氢氧化物沉淀出现,再改用氢氧化铵(3.8,含磷量高时滴加速度要缓慢)调至pH=5~6(以精密pH试纸检查,下同),加约0.5g过硫酸铵(3.1)煮沸,使锰呈水合二氧化锰沉淀,并保持微沸约十分钟,以破坏过剩的过硫酸铵(如试样含锰量小于0.1%,且不含稀土时,则不必除锰)继续调溶液酸度至pH 5-6,煮沸,取下,重新检查溶液pH,如有下降,须再滴加少量氢氧化铵(3.8)。立即以快速滤纸(12.5cm)过滤,并以热硝酸铵(3.9)洗烧杯及沉淀各两次,滤液及洗液收集于500mL烧杯中。将滤纸展开,贴于原烧杯内壁,以热盐酸(3.4)将沉淀冲洗入烧杯中,补加5~10mL盐酸(3.3),加热至沉淀溶解①,以水稀释至约150mL,煮沸,按前述相同步骤再沉淀一次,过滤,洗净烧杯,并洗沉淀4-5次,两次滤液合并②,弃去沉淀。
合并后的溶液浓缩至约200mL,加3~4滴甲基红指示剂(3.13),用盐酸(3.3)酸化,并过量5mL,然后加20mL草酸铵(3.10),煮沸,取下(如溶液红色消失,再补加数滴甲基红指示剂),缓慢滴加氢氧化铵(3.7)至溶液呈黄色,过量3~4滴,加热至沸,于低温保温约2小时。用慢速滤纸过滤,以温草酸铵(3.11)洗烧杯1~2次,洗沉淀5~6次③,再以温水将烧杯充分洗净,并洗沉淀至无游离草酸根[以硝酸银溶液(3.12)检查]。
注:①如试样含锰量较高,再将氢氧化物沉淀冲洗入原烧杯并补加5-10mL盐酸(3.3)溶解沉淀时,可加数滴亚硝酸钠(2%)助溶。
②如试样含稀土,将两次滤液合并后的溶液浓缩至250mL,加20mL氢氧化铵(2+10)煮沸(使残留稀土于此时全部沉淀),取下。待沉淀下降后以快速滤纸过滤于500mL烧杯中以温硝酸铵(3.9,pH约为10),洗净烧杯,并洗沉淀5~6次,弃去沉淀,将溶液浓缩至200mL。
③如试样中钙与镁的含量均在3%以上,则应两次沉淀草酸钙,操作如下:将过滤并以温草酸铵溶液(3.11)洗涤后的沉淀,以热盐酸(3.4)自滤纸上容解并虑入原烧杯中,再加20mL热盐酸(3.3)注于滤纸上,继续以热盐酸(3.4)充分洗涤,使草酸钙全部被溶解滤下。然后将溶液稀释至200mL,加3-4滴甲基红指示剂(3.13)及20mL草酸铵(3.10)煮沸,取下。以下按5.3.2中相应步骤进行第二次沉淀。
5.3.3滴定
将沉淀连同滤纸置于原烧杯中,加150~200mL沸石、15mL硫酸(3.6),讲滤纸贴附于杯壁上部,搅拌使沉淀溶解,立即以高锰酸钾标准溶液(3.14)滴定至微红色后,再将滤纸浸入溶液中,充分搅拌,继续滴定至微红色出现并保持30s不消失为终点。
12
6 分析结果的计算
6.1按下式计算钙的质量分数:
cV?0.10021wCa??
m1?A
式中:c——高锰酸钾标准溶液的浓度,mol/L;
V——消耗高锰酸钾标准溶液的体积,mL; m——试样量,g; A——吸湿水质量分数;
0.1002——1.00mL高锰酸钾标准溶液(1mol/L)相当于钙的质量,g。 6.2按下式计算CaO的质量分数
wCaO=1.3992×wCa
数据记录与处理
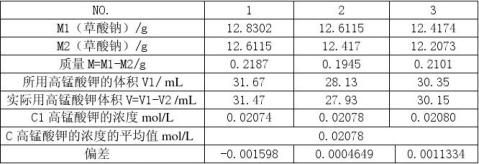
高锰酸钾标准溶液c(KMnO4)=0.02mol/L; 空白实验值V2:0.20ml
表一:高锰酸钾标准溶液浓度的计算
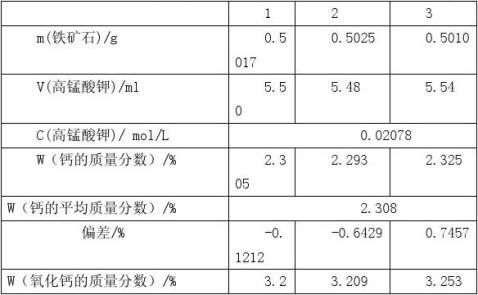
表二:钙的质量分数的计算
故试验中所用的高锰酸钾浓度为:0.02078 mol/L
13
cV?0.10021? m1?A
(式中A=0.009965)可以计算出铁矿石中含钙的质量分数为2.308% 计算公式:wCa?
利用公式wCaO=1.3992×wCa
可以计算出该铁矿石中含氧化钙的质量分数为3.229 %.与查的的标准0.18%相差比较大
7 主要参考资料
GB/T 6730.13-1986 铁矿石化学分析方法 高锰酸钾容量法测定钙量
8 实验小结
(1)实验数据与标准相差较大可能是草酸根没有用硝酸银检验是否洗涤干净。
(2).实验数据有误差,可能的原因是在最后过滤时,没用慢速滤纸,滤液中观察到少量白色沉淀没滤出来。
(3).实验过程需小火保温2小时,可能火有点大,水蒸的太干了,影响了实验结果。
( 4).在两次从滤纸上溶解沉淀时未完全转移,从而影响了实验结果。
八、实习心得与体会
分析该铁矿石的其含铁量比标准的52%小一点,只有50.44%,含水量为0.98%,可能是因为试样本身已经经过干燥处理,含镍量为0.1815%,含氧化钙的量为3.229 %.与标准0.18%相差大,可能是操作的不严谨造成的。
通过这次分析课程实习对铁矿石的分析,从预习查找铁矿石分析各成
分的种类及其含量的合格标准范围,到看实习讲义及实验前的准备工作,包括领器材与药品,溶液的配制与标定,这些都需要自己整理与计算出来,以前做专业基础实验时,这些都是老师准备好的,我们只管做,更全面的了解了实验的全过程,及实验的各步骤的原理。
在每天按计划分析各成分时,由于没有标准,谁也不知道含量到底是多少,没有像以前实验时还可以有个差不多的标准,所以有时候做起来感觉总是不对,与一组的人数据相差很大,所以这更要求我们要一步一步按要求来,不能偷懒。
实验结束后就是整理实验台面,才做实验是没怎么注意台面的干净于整洁, 14
最后做完实验时来整理,一片狼藉,花了好大功夫才整理干净,这就要求我们在平时做实验时要注意整理,用完的仪器马上就要洗好,取完的药品买上要放回原处,称量纸要自己用完就带走丢到垃圾箱,试验完废液倒入废液缸等。
15
