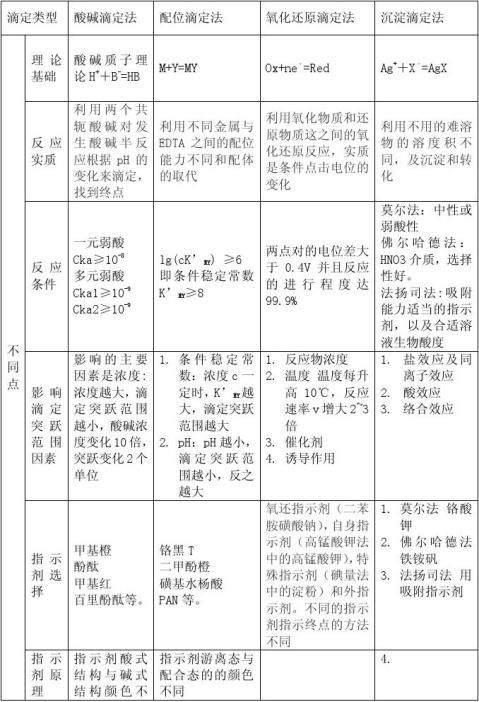
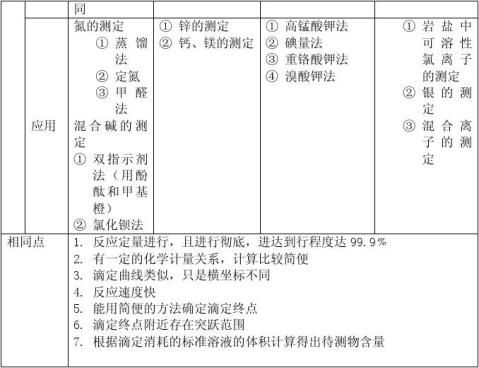
四大滴定总结
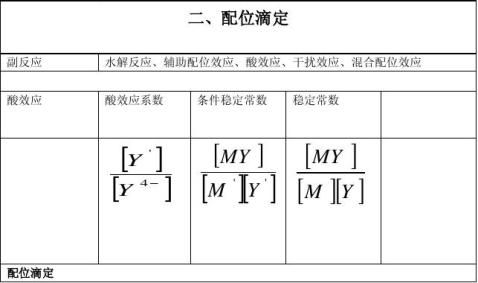
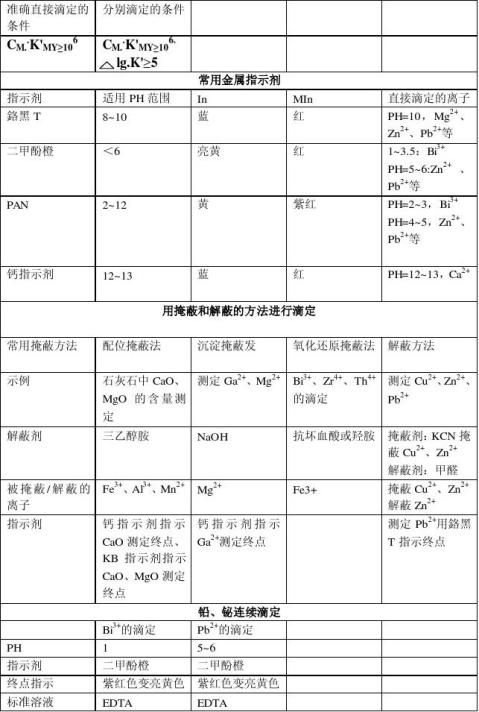
分析化学中的四大滴定即:酸碱滴定,氧化还原滴定,配位滴定,沉淀滴定。
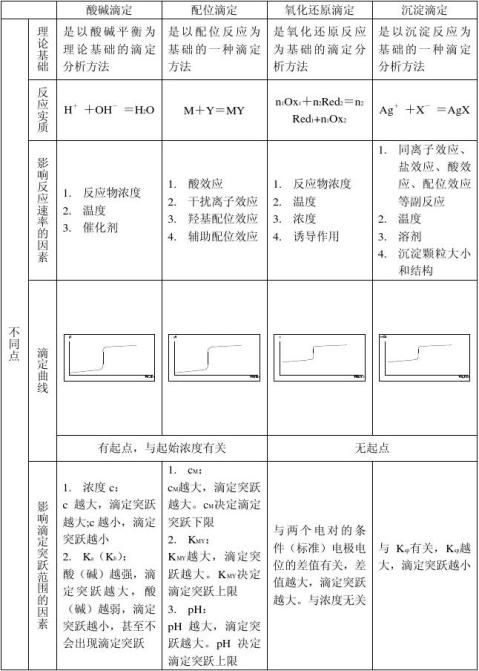
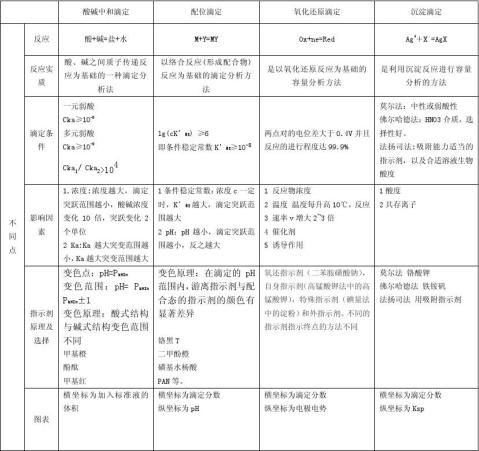
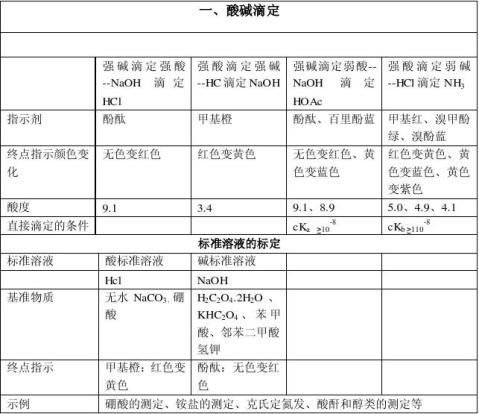
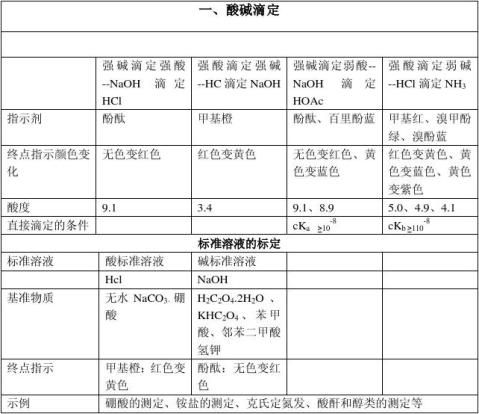
一酸碱滴定
1原理
酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。 基本反应为 H+ + OH- = H2O
也称中和法,是一种利用酸碱反应进行容量分析的方法
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。 [2]
2滴定曲线

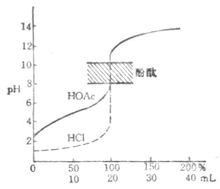
强碱滴定弱酸
滴定反应为:
以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L)
用NaOH滴定HOAc的滴定曲线
为例,滴定曲线如下图:
滴定开始前 pH=2.88
滴入NaOH 液19.98ml时 pH=7.75
化学计量点时 pH=8.73
滴入NaOH液20.02ml时 pH=9.70
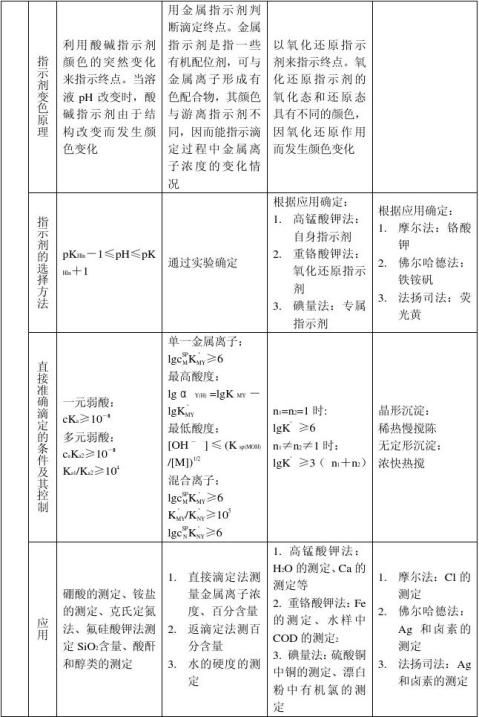
指示剂的选择
(1)只能选择碱性指示剂(酚酞或百里酚酞等),不能选用酸性范围内变色的指示剂(如甲基橙、甲基红等)。因为突跃范围较小,pH值在7.75~9.70之间;计量点在碱性区。
(2)弱酸被准确滴定的判决是C·Ka>10-8。因为Ka愈大,突跃范围愈大。而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃范围也愈大。
3酸碱指示剂
用于酸碱滴定的指示剂,称为酸碱指示剂。是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用类型
指示剂名称 范围 酸色 中性色 碱色
甲基橙 3.1-4.4 红 橙 黄
甲基红4.4-6.2 红 橙 黄
溴百里酚蓝 6.0-7.6 黄 绿 蓝
酚酞 8.2-10.0 无色 浅红 红
紫色石蕊 5.0-8.0 红 紫 蓝
…… …… 余下全文

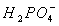 既可以是酸,又可以是碱,这类物质称为两性物质。
既可以是酸,又可以是碱,这类物质称为两性物质。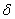 i表示
i表示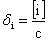
 式中:i为某种型体
式中:i为某种型体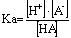
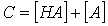 (二)弱酸(弱碱)各型体的分布系
(二)弱酸(弱碱)各型体的分布系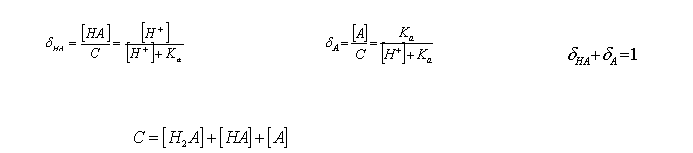
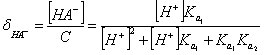
 二元弱酸
二元弱酸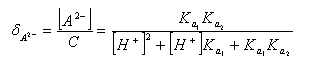
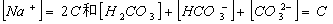 1、质量平衡(物料平衡):在一个化学平衡体系中,某一组分的分析浓度等于该组分各种存在型体的平衡浓度之和,称为质量平衡
1、质量平衡(物料平衡):在一个化学平衡体系中,某一组分的分析浓度等于该组分各种存在型体的平衡浓度之和,称为质量平衡 2、电荷平衡:在一个化学平衡体系中,正离子电荷的总和与负离子电荷的总和相等,称为电荷平衡
2、电荷平衡:在一个化学平衡体系中,正离子电荷的总和与负离子电荷的总和相等,称为电荷平衡 得质子产物 参考水准 失质子产物
得质子产物 参考水准 失质子产物


 NH
4
+ —→ NH
3
NH
4
+ —→ NH
3

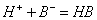 ;
;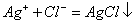 :
: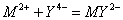 ;
;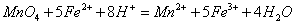
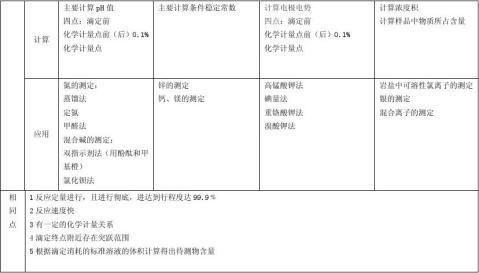
 含量、酸酐和醇类的测定等;
含量、酸酐和醇类的测定等;