大学化学实验
报告本
(一)
姓名: 赵蕾
实验室: 乙313
周次: 周一
实验柜台: 61
指导老师: 章文伟
硫酸亚铁铵的制备
一.实验目的
1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质
3. 掌握水浴、减压过滤等基本操作
4. 学习pH试纸、吸管、比色管的使用
5. 学习用目测比色法检验产品质量。
二.原理
铁屑溶于稀硫酸生成硫酸铁。硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
…… …… 余下全文
大学化学实验
报告本
(一)
姓名: 赵蕾
实验室: 乙313
周次: 周一
实验柜台: 61
指导老师: 章文伟
硫酸亚铁铵的制备
一.实验目的
1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质
3. 掌握水浴、减压过滤等基本操作
4. 学习pH试纸、吸管、比色管的使用
5. 学习用目测比色法检验产品质量。
二.原理
铁屑溶于稀硫酸生成硫酸铁。硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
…… …… 余下全文
实验报告
高三(5)班郭嘉麟
【实验目的】制备(NH4)2SO4·FeSO4·6H2O,了解复盐的特性。
【实验原理】Fe + H2SO4= FeSO4 + H2↑
FeSO4 +(NH4)2+ 6H2O= (NH4)2 SO4Fe SO4·6H2O
将制得的硫酸亚铁溶液与等物质的量的(NH4)2SO4在溶液中混合,经加热浓缩、冷却后得到溶解度较小的硫酸亚铁铵晶体。 【实验用品】Fe屑,10 %Na2CO3溶液,3 mol·L-1 H2SO4,(NH4)2SO4,蒸馏水,无水乙醇,锥形瓶,玻璃棒,漏斗,烧杯,胶头滴管,酒精灯,石棉网,铁架台,蒸发皿,滤纸,量筒,托盘天平
【实验流程图】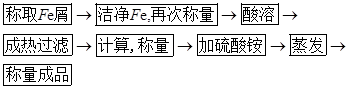
【实验步骤】
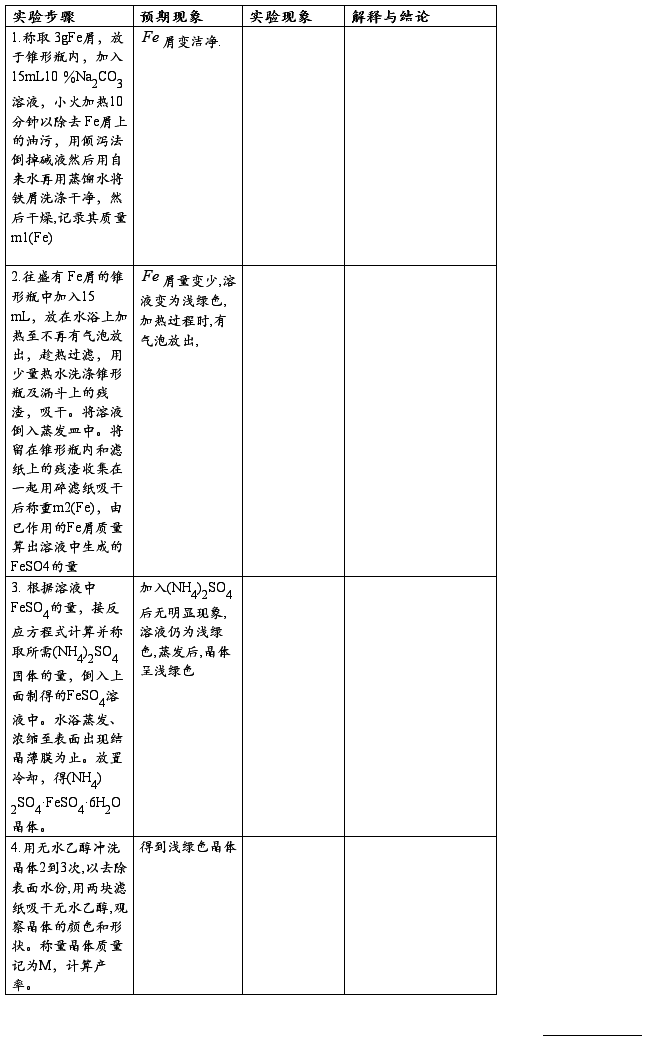
【实验数据记录与处理】

【实验心得】
…… …… 余下全文
无机化学制备实验报告
实验名称: 硫酸亚铁铵的制备 成绩及教师签名:
实验日期: 专业: 班级: 实验室: 号: 姓名:
实验目的:1. 学习水浴加热、减压过滤、蒸发浓缩等操作。
2. 了解复盐的一般特征和制备方法。

 制备原理(简述):
制备原理(简述):

 简单流程(框图):
简单流程(框图):
 实验过程主要现象:
实验过程主要现象:

实验结果:①产品外观: ; ②理论产量: ;
…… …… 余下全文
实验三 硫酸亚铁铵的制备
一 实验目的:
1. 学会利用溶解度的差异制备硫酸亚铁铵;掌握硫酸亚铁、硫酸亚铁铵复盐的性质。
2. 掌握水浴、减压过滤等基本操作;学习pH试纸、吸管、比色管的使用;学习限量分析。
二 实验原理:
1.铁屑溶于H2SO4,生成FeSO4: Fe + H2SO4 =FeSO4 + H2↑
2. 通常,亚铁盐在空气中易氧化。例如,硫酸亚铁在中性溶液中能被溶于水肿的少量氧气氧化并进而与水作用,甚至析出棕黄色的碱式硫酸铁(或氢氧化铁)沉淀。若往硫酸亚铁溶液中加入与FeSO4相等的物质的量(mol)的硫酸铵,则生成复盐硫酸亚铁铵。硫酸亚铁铵比较稳定,它的六水合物(NH4)2SO4·FeSO4·6H2O不易被空气氧化,在定量分析中常用以配制亚铁离子的标准溶液。像所有的复盐那样,硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO4或(NH4)2SO4的溶解度都要小。蒸发浓缩所得溶液,可制得浅绿色的硫酸亚铁铵(六水合物)晶体。 FeSO4与(NH4)2SO4等物质的量作用,生成溶解度较小的硫酸亚铁铵:
FeSO4 + (NH4)2SO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O
硫酸亚铁铵比较稳定,定量分析中常用来配制亚铁离子的标液;和其他复盐一样,硫酸亚铁铵的溶解度比它的每一组分要小。
3.比色原理:Fe3+ + n SCN- = Fe(SCN)n(3-n) (红色) 用比色法可估计产品中所含杂质 Fe3+的量。Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。所以,只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。
…… …… 余下全文

广州大学化学化工学院
本科学生综合性、设计性实验报告
实验课程 普通化学实验D
实验项目 硫酸亚铁铵的制备及质量检验
专业 生物科学 班级生科111班
学号1114100058 姓名王衣
指导教师 贾玉江
开课学期 20## 至 20## 学年一学期
时 间 2011 年 11 月 13 日
…… …… 余下全文
硫酸亚铁铵的制备及纯度检验
一、教学要求
1.了解复盐的一般特性
2.学习复盐(NH4)2SO4·FeSO4·6H2O的制备方法。
3.熟练掌握水浴加热、过滤、蒸发、结晶等基本无机制备操作。
4.学习产品纯度的检验方法。
二、预习内容
1、常用玻璃(瓷质)仪器 :烧杯、蒸发皿、布氏漏斗等的使用方法;
2、实验室用的纯水、检验用的无氧水;
3、预习无机制备的一些基本操作:水浴加热,蒸发,浓缩,结晶,减压过滤等;
4、查物质的溶解度数据表;温度对溶解度的影响;
5、复盐的性质,(NH4)2SO4·FeSO4·6H2O的制备方法;
6、(NH4)2SO4·FeSO4·6H2O纯度检验的方法。
三、实验原理
硫酸亚铁铵 (NH4)2SO4·FeSO4·6H2O) 商品名为莫尔盐,为浅蓝绿色单斜晶体。一般亚铁盐在空气中易被氧化,而硫酸亚铁铵在空气中比一般亚铁盐要稳定,不易被氧化,并且价格低,制造工艺简单,容易得到较纯净的晶体,因此应用广泛。在定量分析中常用来配制亚铁离子的标准溶液(思考题1)。
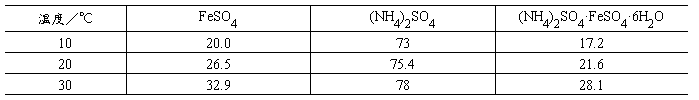
和其他复盐一样, (NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分FeSO4或(NH4)2SO4的溶解度都要小。利用这一特点,可通过蒸发浓缩FeSO4与(NH4)2SO4溶于水所制得的浓混合溶液制取硫酸亚铁铵晶体(思考题2)。三种盐的溶解度数据列于表1。
表1 三种盐的溶解度(单位为g/100g H2O)
本实验先将铁屑溶于稀硫酸生成硫酸亚铁溶液:
 Fe+H2SO4 FeSO4+H2↑
Fe+H2SO4 FeSO4+H2↑
再往硫酸亚铁溶液中加入硫酸铵并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵晶体。
…… …… 余下全文
