—配位滴定法
〖实验目的〗
(1)了解水的硬度的表示方法。
(2)掌握EDTA法测定水中钙、镁含量的原理和方法。
(3)正确判断铭黑T和钙指示剂的滴定终点。
〖实验用品〗
仪器:酸式滴定管、容量瓶、移液管、锥形瓶、烧杯、细口试剂瓶、量筒。
药品: EDTA、CaCO3、MgCl2·H2O、固体pH=10氨性缓冲溶液、HCl水溶液、NaOH溶液
络黑T指示剂:将1g铬黑T指示剂与100g干燥的纯NaC1混合,研细备用。
钙指示剂:将1g钙指示剂与100g干燥的纯NaC1混合,研细备用。
试样:自来水、矿泉水
〖实验原理〗
水的总硬度通常是指水中钙、镁的总量。各国对水的硬度表示方法有所不同。我国采用Ca2+、Mg2+总量折合成CaO来计算水的硬度,硬度单位以度(°)表示,一个硬度单位代表1L水中含10mgCaO。
一般饮水的总硬度不得超过25°,各种工业用水对硬度有不同的要求,如酿酒以硬水为宜,锅炉用水则必须是软水。因此,测定水的总硬度有很重要的实际意义。
用EDTA法测定水的总硬度,即在PH=10的氨性缓冲溶液中,以络黑T(EBT)作为指示剂,用EDTA标准溶液直接滴定水中的Ca2+、Mg2+,直到溶液由酒红色变为纯兰色,即为终点。反应式如下:
滴定前:EBT+M(Ca2+,Mg2+)=M-GEBT
(兰色) (酒红色)
滴定开始到等量点前:M+EDTA=M-EDTA
等量点:M-EBT+EDTA=M-EDTA+EBT
(酒红色) (兰色)
滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽,Ca2+、pb2+、Zn2+等重金属离子可用KCN、Na2S或巯基乙酸予以掩蔽。
2+2+铬黑T与Ca络合较弱,所呈颜色不深,终点变化不明显。当水样中的Mg的含量较低时(一
般要求相对Ca2+来说须有5% Mg2+存在),用铬黑T指示剂往往得不到敏锐的终点。这时,可在加铬黑T前于被滴定液中加入适量Mg—EDTA溶液(也可在标定前于EDTA溶液中加入适量Mg2+),使终点变色敏锐。
…… …… 余下全文
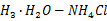 缓冲溶液,铬黑T试剂,钙指示剂,滴定管,25 mL移液管,锥形瓶6个
缓冲溶液,铬黑T试剂,钙指示剂,滴定管,25 mL移液管,锥形瓶6个
