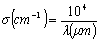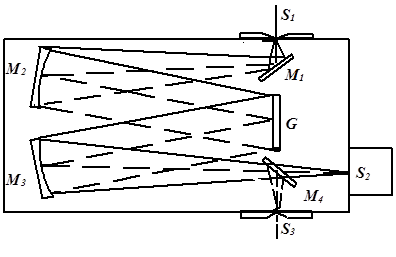仪器分析实验----光谱分析
实验一:光谱分析
食质(检测)2010级02班 钟凯成 学号:20105782
一、实验目的:
1、了解主要光学仪器(AAS,AFS,V2S等)的结构;
2、了解原子吸收分光光度计的基本结构和基本方法;
3、紫外吸收曲线的绘制。
二、实验原理:
原子吸收分光光度法又称原子吸收光谱法。它是基于物质所产生的基态原
子蒸气对特定谱线吸收作用来进行定量的一种方法。在高温下试样中的待测元
素的化和物解离而产生代测元素的基态原子。当光源发出的光辐射通过含有基
态原子的蒸气层时,待测元素的基太原子对入射光产生选择性吸收,,即吸收
其特征波长的辐射线,同时,原子由基态跃迁到激发态,光源发出的光强度由
于被吸收而明显减弱,即伴随有吸收光源的产生。此吸收过程符合比耳吸收定
律。
既: I=I0e-K.N.L
式中 K---吸收系数; N---自由原子总数;L---吸收层厚度
其吸光度值A可用下式表示:A=2.303KNL
此式表明,吸光度A与自由原子数N成正比,在一定条件下,N正比于待
测元素的浓度c,则A也正比于待测元素的浓度c。因此,以标准系列法做出标
准曲线后,测的样品溶液吸光度的大小,可从标准曲线上找到相应的浓度值,
再求得待测元素的含量。
三、基本操作技术:
1、样品处理
<1>无机物: 干法, 湿法, 微波
<2>有机物: 分离, 萃取, 显色(衍生)
2、器皿洗涤(原子光谱分析):
1
仪器分析实验----光谱分析
稀硝酸浸泡过夜——洗涤液洗涤——清洗——自然晾干备用
3、实验用水:
蒸馏水、双蒸水、超纯水
4、苯及其衍生物紫外吸收曲线绘制
四、实验仪器简单介绍。
1、原子吸收分光光度计
原子吸收分光光度计一般由四大部分组成,即光源(单色锐线辐射源)、试样 原子化器、单色仪和数据处理系统(包括光电转换器及相应的检测装置)。
…… …… 余下全文

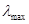 相同,然而其摩尔吸光系数
相同,然而其摩尔吸光系数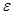 或比吸光系数E
或比吸光系数E 值是有差别的。因此需利用
值是有差别的。因此需利用