实验三 配合物的生成、性质和应用
一、实验目的
1.了解配合物的生成和组成。
2.了解配合物与简单化合物合复盐的区别。
3.了解配位平衡及其影响因素。
4.了解螯合物的形成条件及稳定性。
5.熟悉过滤盒试管的使用等基本操作。
二、实验原理
由中心离子(或原子)与配体按一定组成和空间构型以配位键结合所形成的化合物称配合物。配位反应是分步进行的可逆反应,每一步反应都存在着配位平衡。
M + nR  MRn
MRn 
配合物的稳定性可由K稳 (即Ks)表示,数值越大配合物越稳定。增加配体(R)或金属离子(M)浓度有利于配合物(MRn)的形成,而降低配体和金属离子的浓度则有利于配合物的解离。如溶液酸碱性的改变,可能引起配体的酸效应或金属离子的水解等,就会导致配合物的解离;若有沉淀剂能与中心离子形成沉淀的反应发生,引起中心离子浓度的减少,也会使配位平衡朝离解的方向移动;若加入另一种配体,能与中心离子形成稳定性更好的配合物,则同样导致配合物的稳定性降低。若沉淀平衡中有配位反应发生,则有利于沉淀溶解。配位平衡与沉淀平衡的关系总是朝着生成更难解离或更难溶解物质的方向移动。
配位反应应用广泛,如利用金属离子生成配离子后的颜色、溶解度、氧化还原性等一系列性质的改变,进行离子鉴定、干扰离子的掩蔽反应等。
三、仪器和试剂
仪器:试管、离心试管、漏斗、离心机、酒精灯、白瓷点滴板。
试药:H2SO4 (2mol·L-1)、HCl (1mol·L-1)、NH3·H2O (2, 6mol·L-1)、NaOH (0.1, 2mol·L-1) 、CuSO4 (0.1mol·L-1, 固体)、HgCl2 (0.1mol·L-1)、KI (0.1mol·L-1)、BaCl2 (0.1mol·L-1)、K3Fe (CN)6 (0.1mol·L-1)、NH4Fe (SO4)2 (0.1mol·L-1)、FeCl3 (0.1mol·L-1)、KSCN (0.1mol·L-1)、NH4F (2mol·L-1)、(NH4)2C2O4 (饱和)、AgNO3 (0.1mol·L-1)、NaCl (0.1mol·L-1)、KBr (0.1mol·L-1)、 Na2S2O3 (0.1mol·L-1,饱和)、Na2S (0.1mol·L-1)、FeSO4 (0.1mol·L-1)、NiSO4 (0.1mol·L-1) 、CoCl2 (0.1mol·L-1)、CrCl3 (0.1mol·L-1)、EDTA (0.1mol·L-1)、乙醇 (95%)、CCl4、邻菲罗啉 (0.25%)、二乙酰二肟(1%)、乙醚、丙酮。
四、实验内容
1.配合物的生成和组成
(1)配合物的生成
在试管中加入0.5g CuSO4·5H2O (s), 加少许蒸馏水搅拌溶解,再逐滴加入2mol·L-1的氨水溶液,观察现象,继续滴加氨水至沉淀溶解而形成深蓝色溶液,然后加入2mL 95%乙醇,振荡试管,有何现象?静置2分钟,过滤,分出晶体。在滤纸上逐滴加入2 mol·L-1NH3·H2O溶液使晶体溶解,在漏斗下端放一支试管承接此溶液,保留备用。写出相应离子方程式。
现象:有浅蓝色沉淀碱式硫酸铜生成:Cu2++ 2NH3·H2O=Cu2(OH)2SO4+2NH4+
继续滴加沉淀溶解加入乙醇,现象和解释: 析出Cu(NH3)4 SO4(蓝色)
(2)配合物的组成
将上述溶液分成2份,在一支试管中滴入2滴0.1mol·L-1BaCl2溶液,另一支试管滴入2滴0.1mol·L-1NaOH溶液,观察现象,写出离子方程式。
现象:第一支有白色沉淀SO42- +Ba2+=BaSO4
第二支无现象
另取两支试管,各加入5滴0.1mol·L-1CuSO4溶液,然后分别向试管中滴入2滴0.1mol·L-1 BaCl2溶液和2滴0.1mol·L-1NaOH溶液,观察现象,写出离子方程式。
第一支有白色沉淀SO42- +Ba2+=BaSO4
第二支有蓝色沉淀Cu2+ + OH- =Cu(OH)2
比较二实验结果,分析该配合物的内界和外界组成,写出相应离子方程式。
内界:【Cu(NH3)4 】2+ 外界:SO42-
2.配合物与简单化合物、复盐的区别
(1)在一支试管中加入10滴0.1mol·L-1FeCl3溶液,再滴加2滴0.1mol·L-1KSCN溶液,观察溶液呈何颜色?【Fe(SCN)3】血红色
(2)用0.1mol·L-1K3Fe(CN)6)溶液代替FeCl3溶液,同法进行实验,观察现象是否相同。不同无现象Fe(CN)6)3+ 配离子存在于溶液中。
(3)如何用实验证明硫酸铁铵是复盐,请设计步骤并实验之。
提示:取3支试管,各加入5滴0.1mol·L-1NH4Fe(SO4)2溶液,分别用相应方法鉴定NH4+、Fe3+、SO4 2-的存在。加盐酸,NaOH,硝酸钡验证
3.配位平衡及其移动
(1)配合物的取代反应
在一支试管中,加入10滴0.1mol·L-1FeCl3溶液和1滴0.1mol·L-1KSCN溶液,观察溶液颜色。向其中滴加2mol·L-1NH4F溶液,溶液颜色又如何?再滴入饱和 (NH4)2C2O4溶液,溶颜色又怎样变化?简单解释上述现象,并写出离子方程式。
【Fe(SCN)3】血红色;血红色变浅至无色【Fe(F)6】3-;无色变为黄绿色 Fe(C2O4)33-
生成稳定常数更大的配离子
(4) 配位平衡与沉淀平衡
在一支离心试管中加入2滴0.1mol·L-1AgNO3溶液,按下列步骤进行实验:
①逐滴加入0.1mol·L-1NaCl溶液至沉淀刚生成;
②逐滴加入6mol·L-1氨水至沉淀恰好溶解;
③逐滴加入0.1mol·L-1KBr溶液至刚有沉淀生成;
④逐滴加入0.1mol·L-1Na2S2O3溶液,边滴边剧烈振摇至沉淀恰好溶解;
⑤逐滴加入0.1mol·L-1KI溶液至沉淀刚生成;
⑥逐滴加入饱和 Na2S2O3溶液,至沉淀恰好溶解;
⑦逐滴加入0.1mol·L-1Na2S溶液至沉淀刚生成;
写出每一步有关的离子方程式,比较几种沉淀的溶度积大小和几种配离子稳定常数大小讨论配位平衡与沉淀平衡的关系。象和解释
AgBr Ag(S2O3)23- AgI Ag(CN)2 - Ag2S
浅黄色沉淀 溶解 黄色沉淀 溶解 黑色沉淀
K = Ksp × K稳
(3) 配位平衡与氧化还原反应
取两支试管各加5滴0.1mol·L-1的FeCl3溶液及10滴CCl4,然后往一支试管滴入2mol·L-1 NH4F溶液至溶液变为无色,另一支试管中滴入几滴蒸馏水,摇匀后在两支试管中分别再滴入5滴0.1mol·L-1KI溶液,振荡后比较两试管中CCl4层颜色,解释现象并写出离子方程式。
Fe(C2O4)33- +I - 无现象
2Fe3+ +2I - == I2+ 2Fe2+ (四氯化碳层的颜色为棕色)
(4)配位平衡与酸碱平衡
①取2支试管,各加入少量自制的硫酸四氨合铜溶液,一支逐滴加入1mol·L-1HCl溶液,另一支滴加2mol·L-1NaOH溶液,观察现象,说明配离子[Cu(NH3)4]2+在酸性和碱性溶液中的稳定性,写出有关的离子方程式。
②在一支试管中,先加入10滴0.1mol·L-1FeCl3溶液,再逐滴滴加2mol·L-1NH4F溶液至溶液颜色呈无色,将此溶液分成两份,分别逐滴加入1mol·L-1HCl和2mol·L-1NaOH溶液,观察现象,说明配合物离子[FeF6]3-在酸性和碱性溶液中的稳定性,写出有关的离子方程式。
Cu(NH3)42+ + 4H+ === Cu2+ +4NH4+ 颜色变浅
6.配合物的应用
(1)取两支试管各加10滴自制的[Fe(SCN)6] 3-、[Cu(NH3)4]2+,然后分别滴加0.1mol·L-1 EDTA溶液,观察现象并解释。现象和解释:
褪色 形成EDTA的螯合物
[Fe(CNS)6]3- + y4- == [FeY]- + 6CNS-
[Cu(NH3)4]2+ + Y4- == [CuY]2- + 4NH3
(2)在小试管中(或白瓷点滴板上),滴加一滴0.1mol·L-1FeSO4溶液及3滴0.25%邻菲罗啉溶液,观察现象,此反应可作为Fe2+离子的鉴定反应。
现象和解释: 生成桔红色的溶液(反应方程式)
(3)在试管中加入2滴0.1mol·L-1NiSO4溶液及一滴2mol·L-1NH3·H2O和2滴二乙酰二肟溶液,观察现象,此反应可作为Ni2+离子的鉴定反应。
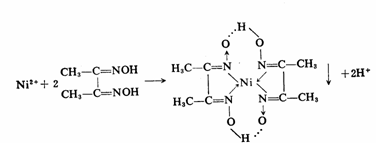
H+离子浓度过大不利于Ni2+离子生成内络盐,而OH-离子的浓度也不宜太高,否则会生成氢氧化镍沉淀。合适的酸度是pH为5~10。
在白色点滴板上滴1滴0.2mo1.L-1硫酸镍溶液,1滴0.1mo1.L-1氨水和1滴1% 二乙酰二肟溶液,观察有什么现象
现象和解释: 生成鲜红色的沉淀(反应方程式见上)
五、注意事项
1.在性质实验中一般来说,生成沉淀的步骤,沉淀量要少,即刚观察到沉淀生成就可以;使沉淀溶解的步骤,加入试液越少越好,即使沉淀恰好溶解为宜。因此,溶液必须逐滴加入,且边滴边摇,若试管中溶液量太多,可在生成沉淀后,离心沉降弃去清液,再继续实验。
2.NH4F试剂对玻璃有腐蚀作用,储藏时最好放在槊料瓶中。
3.注意配合物的活动性是指配合物在反应速度方面的性能。Cr-EDTA配合物的稳定性相当高(lgKs = 21),但反应速度较慢。在室温下很少发生反应,必须在EDTA过量且加热煮沸下才能形成相应配合物。
1. 银氨配合物不能贮存,因放置时(天热时不到一天)会析出有强爆炸性的氮化银Ag3N沉淀。为了破坏溶液中的银氨配离子,可加盐酸,使它转化为氯化银,回收氯化银。
2. 溴化银、碘化银与硫代硫酸钠溶液反应时,硫代硫酸钠浓度不能较大,否则碘化银也会溶解。一般情况下1 mo1·L-1以下的硫代硫酸钠不会使碘化银溶解,2 mo1·L-1的硫代硫酸钠会使碘化银部分溶解,饱和硫代硫酸钠会使碘化银全部溶解。
六、思考题
1.试总结影响配位平衡的主要因素。影响配位平衡的因素:配离子的稳定性;难溶物的溶度积;氧化还原性;溶液的酸碱性
2.配合物与复盐的区别是什么?
3.实验中所用EDTA是什么物质?它与单基配体相比有何特点?
4.为什么Na2S不能使K4Fe(CN)6产生FeS沉淀,而饱和的H2S溶液能使[Cu(NH3)4]2+溶液产生CuS沉淀? 用K = Ksp* K稳 解释
第二篇:配合物的合成与表征
5-(3-吡啶基)四唑-2-乙酸根与Zn(II)配合物的合成与表征报告
班级:09化学(师范)
学号:150109118
姓名:蔡福东
目录
1. 前言... 1
1 配位化合物... 2
1. 1 配位化合物的组成... 2
1. 2 配合物的种类... 2
2 配位化学发展简史... 3
3 配位化学的今天... 6
2. 实验部分... 7
2.1药品... 7
2.2仪器... 7
2.3合成方法... 7
3. 结果与讨论... 7
3.1 结构分析... 7
3.2 红外光谱... 7
3.3 荧光光谱... 8
4. 小结... 9
摘要:近几十年来, 配位化学在许多新的领域发展的很迅速,在分子识别领域利用也很广范。本文主要分析5-(3-吡啶基)四唑-2-乙酸乙酯水解与硝酸锌反应后得到的配合物晶体。通过结构分析,红外光谱,荧光光谱三种方式分别对生成的配合物晶体进行分析,得到这种新配合物三维结构,结晶学参数,含有主要的基团以及反射光谱,具体的确定该新晶体。
关键词:5-(3-吡啶基)四唑-2-乙酸乙酯,Zn(NO3)2,红外光谱,荧光光谱
1. 前言
配位化学已有300 年的发展历史, 近十几年来先后开辟了许多新领域, 如大环配位化合物、超分子化学、分子识别、功能性配合物、卟啉类配合物、瞬变现象和C60配合物等, 配位化学在这些领域中的最新成就表明配位化学已成为当代化学的前沿领域之一, 它和物理化学、有机化学、生物化学、固体化学和环境化学相互渗透, 使其成为贯通众多学科的交叉点.
1 配位化合物
1. 1 配位化合物的组成
配位化合物( Coordination Compounds) 旧称络合物( Complex Compound) , 是指独立存在的稳定化合物进一步结合而成的复杂化合物. 从组成上看, 配合物是由可以给出孤电子对或多个不定域电子的一定数目的离子或分子( 称为配体) 和具有接受孤电子对或多个不定域电子的空位的原子或离子( 称为中心原子) 按一定的组成和空间构型所形成的化合物.
1. 2 配合物的种类
从配位原子看, 总共约有14 个元素可以作为配位原子, 它们主要属于周期表的ⅤA、ⅥA、ⅦA 族, 及H- 离子和有机配体中的C 原子. 这些元素是: H、C、N、O、F、P、S 、Cl、As、S e、Br 、Sb、Te、I[ 2] . 配体按原子数多少可分为单原子配体( 如X- 离子) 和多原子配体( 如OH- 、SO2-3 、CO、NO-2 等) . 多原子配体按配位原子不同可分为单齿配体和多齿配体. 有一种特殊的多齿配体称为冠醚( 如18-冠-6) .另有一类具有双环或三环的冠醚称为穴醚( 如穴醚[ 3, 2,2] ) .从中心原子看, 有些具有2 个或多个中心原子的配合物称为双核配合物或多核配合物. 在多核配合物中, 连接2 个中心原子的配体称为成桥基团. 此外, 金属原子还可以通过金属键自己连成簇, 称为金属簇配合物( 如{M ( OOCCH3) 2·H2O} 2) .
2 配位化学发展简史
国外文献上最早记载的配位化合物是普鲁士蓝, 其化学结构是FeⅢ4 [ FeⅡ ( CN) 6] 3 , 发现于1704 年, 距今已有300 年历史了. 最早关于配合物的研究是1798 年法国塔索尔特( Tassert ) 关于黄色氯化钴( [ Co( NH3) 6] Cl3) 的研究. 他在CoCl2 溶液中加NH3 ·H2O 后没有得到Co ( OH) 3, 而是得到了桔黄色结晶, 起初认为是一种复合物( CoCl3·6NH3) , 但他在该桔黄色结晶的溶液中加碱后得不到NH3 气体, 也检查不出Co3+ 离子的存在, 可见Co 3+ 与NH3 是紧密结合在一起的, 而加AgNO3 后却得到了AgCl 沉淀, 证明Cl- 是游离的. 塔索尔特的报道引起了一些化学家开始研究这类化合物. 因为当时的原子价理论不能解释这类化合物, 故称之为复杂化合物, 即络合物. 在此后的100 多年里, 人们用测定摩尔电导的方法研究这类物质的性质, 从而推导出每个化合物分子中所含的离子数. 结果发现, 有的是非离子型的, 如PtCl4· 2NH3( 现为PtCl4( NH3) 2) ; 有的是1∶1 型的, 如PtCl4 ·3NH3 ( 现为[ Pt Cl3( NH3) 3] Cl) ; 有的是1∶ 2 或2∶ 1 型的, 如CrCl3·5NH3 ( 现为CrCl ( NH3 ) 5Cl2 ) 和PtCl4 · 2KCl ( 现为K2[ PtCl6] ) ; 有的是1 ∶ 3 型的, 如CoCl3 · 6NH3 ( 现为Co ( NH3) 6Cl3 ) ; 有的是1∶ 4 型的, 如PtCl4·6NH3 ( 现为Pt( NH3) 6Cl4 ) 等等. 这一时期, 许多实验事实的积累为配位化学奠定了实验基础, 但理论上一直无法解释. 直到1893 年, 瑞士苏黎世大学年轻的化学家维尔纳( Wer ner ) ,时年26 岁, 提出了现在常称之为维尔纳配位理论的学说. 维尔纳的配位理论奠定了配位化学的理论基础, 真正意义的配位化学从此得以建立. 但是, 维尔纳的理论对于主价和副价的本质仍然无法解释.1923 年, 英国化学家西奇维克( Sidgwick ) 提出有效原子序数法则( EAN) , 揭示了中心原子电子数与配位数之间的关系. 有效原子序数是指中心原子的电子数加上配体中配位原子给予的电子数之和. 如果配合物的有效原子序数等于中心原子同一周期的稀有气体原子的序数, 则该配合物是稳定的. 该法则只能解释部分配合物的实验事实,也有许多例外, 因此不是一个普遍的法则. 由于1910 年-1940 年间红外光谱、紫外光谱、X 射线、电子衍射与磁学测量等许多现代研究方法应用于配合物的研究, 人们才进一步了解配合物的结构. 1940 年, 美国加里福尼亚理工学院的鲍林( Linus Pauling ) 教授在他的著作《T he Nat ur e ofthe Chemical Bond》中提出了著名的价键理论( VBT) , 配合物成键本质才基本清楚. 价键理论概念明确、模型具体,其假定与化学工作者所熟悉的化学键概念相一致, 易为人们所接受, 能反映配合物的大致面貌, 说明配合物的某些性质. 但是价键理论也存在以下缺陷: 一是只能定性解释配合物某些性质; 二是对Cu2+ 配合物的解释有些勉强; 三是只讨论配合物的基态性质, 对激发态无法解释. 1929 年贝特( Bethe) 和1932 年范弗里克( Van Vleck) 的工作奠定了晶体场理论( CFT) 的基础. 这个理论是在静电理论的基础上考虑了中心原子的轨道在配体静电场中的分裂. 后来这个理论得到了很大的发展. 20 世纪50 年代, 化学家哈特曼( H. Har tman) 等人将晶体场理论用于解释配合物光谱, 欧格耳( Org el) 用于解释配合物的稳定性, 都取得了很好的效果. 但是, 晶体场理论认为配位键完全具有离子键性质而无共价键成分, 因此模型过于简单, 不能解释电子云伸展效应.1935 年, 范弗里克把分子轨道理论(M OT ) 用于配合物化学键的研究中, 补充了晶体场理论的不足, 因此将分子轨道理论和晶体场理论相互配合起来处理配合物, 称为配位场理论( LFT) . 配位场理论认为金属所有的s、p 、d 或f 原子轨道以及配位体的轨道在成键中处于相同的地位.在考虑中心离子的价电子在有效核电荷场的中心离子势场和配位体静电场中的运动时, 特别要考虑下列3 种微扰作用, 即金属离子中价电子间的静电作用、配位场对金属离子电子的作用和电子的自旋轨道相互作用. 即使如此,要严格地求解这3 项微扰所建立的量子化学薛定谔方程式也是不可能的, 通常根据上述3 项微扰作用的大小而分成3 类方案处理. 配位场作用较强时为强场方案, 静电作用强时为弱场方案. 第一过渡金属常采用弱场或强场方案; 第二、三过渡金属常采用强场方案; 而对f 电子被屏蔽的稀土或锕系配合物, 则宜采用自旋-轨道耦合方案. 在实际应用中, 只要计算时精确而完整, 则不同方案会得到相同结果. 由于配位场理论既保留了晶体场理论的具体模型而使计算简捷, 又吸收了分子轨道理论的统一整体, 因而在配合物的结构和性质方面得到了广泛的应用.
目前三大化学键流派中, 价键理论着重于2 个相邻原子间的相互作用, 从而特别适用于定域体系; 在分子轨道理论中则强调分子是一个统一的整体而未重视个别原子的成键特性, 从而特别适用于离域体系; 配位场理论则重于中心离子而配体只起微扰作用, 因而特别适用于离子晶体和配合物[4] .
3 配位化学的今天
近几十年来, 配位化学得到了长足的发展, 先后开辟了许多新的领域. 如: 大环配位化合物; 超分子化学; 分子识别; 功能性配合物; 卟啉类配合物; 瞬变现象; C60配合物。
2. 实验部分
2.1药品
5-(3-吡啶基)四唑-2-乙酸乙酯,氢氧化钾,硝酸锌
2.2仪器
水浴锅,显微镜(型号:402375,江南新兴),红外仪,荧光仪
2.3合成方法
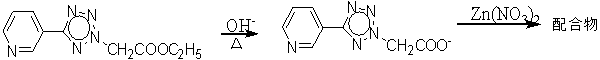
5-(3-吡啶基)四唑-2-乙酸乙酯0.0233g加入4d氢氧化钾,6d水,封膜,水浴78℃两小时,加3.5mL硝酸锌0.0149g水浴78℃ 15min,过滤,滤液静置。
3. 结果与讨论
3.1 结构分析
见表-1,表-2,表-3,图1,图2
3.2 红外光谱
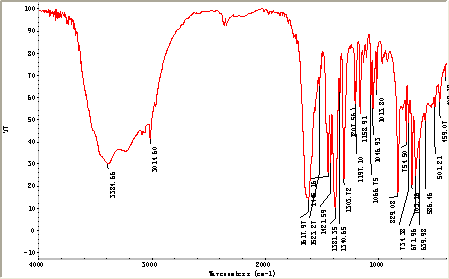
分析:上图中在3384.66cm-1处出现一个宽而强的吸收峰,是由OH引起的;羧酸的吸收峰在1710cm-1 附近,但由于羧酸的酸性质子被阳离子取代,生成羧 酸盐,使羧酸的羧基的特征谱带消失,代之出现的是 1445.16cm-1 和 1421.59cm-1的两个谱带;红外谱图在1617.97 cm-1有一很强的吸收峰,是由于C=N双键引发的。由红外光谱看来,可初步判断该配合物中含有OH基,—COO-,C=N基
3.3 荧光光谱
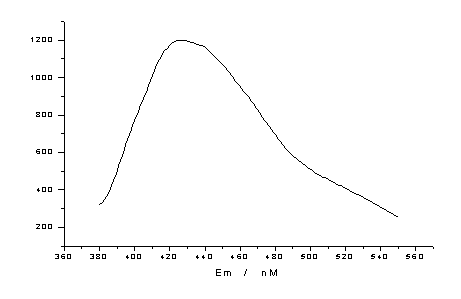
EM=426.4nm


EX=364.2nm
分析: 该配合物由于吸收了激发光中与它本身特征频率相同的光线,原子中的某些电子从基态中的最低振动能级跃迁到较高的某些振动能级,电子在同类分子或其它分子中撞击,消耗了一部分能量,从而下降到基态中的某些不同能级,同时发出比原来吸收的频率低、波长长的一种发射光(荧光)。
4. 小结
第一次做结晶实验,得到的结晶是一粒一粒的大颗粒,虽然晶体长的不是很好,但是结构分析,谱图分析下来还是与生成物很符合的。这个实验具有一定的综合性,增强了我们对红外仪,紫外仪的使用,锻炼了我们各方面的能力,有助于我们全面发展。
