实验七 硫酸亚铁铵的制备
一、实验目的
1、掌握制备复盐硫酸亚铁铵的方法,了解复盐的特性。
2、掌握蒸发、浓缩等基本操作。
3、了解无机物制备的投料、产量、产率的有关计算。
二、实验原理
铁能溶于稀硫酸中生成硫酸亚铁:Fe(S)+2H+(aq) = Fe2++H2(g)
通常,亚铁盐在空气中易氧化。例如,硫酸亚铁在中性溶液中能被溶于水中的少量氧气氧化并进而与水作用,甚至析出棕黄色的碱式硫酸铁(或氢氧化铁)沉淀。
4Fe2++2SO42-(aq)+O2(g)+6H2O(l) = 2[Fe(OH)2]2SO4(s)+4H+(aq)
若往硫酸亚铁溶液中加入与FeSO4相等的物质的量(mol)的硫酸铵,则生成复盐硫酸亚铁铵。硫酸亚铁铵比较稳定,它的六水合物(NH4)2SO4·FeSO4·6H2O不易被空气氧化,在定量分析中常用以配制亚铁离子的标准溶液。像所有的复盐那样,硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO4或(NH4)2SO4的溶解度都要小。蒸发浓缩所得溶液,可制得浅绿色的硫酸亚铁铵(六水合物)晶体。
Fe2+(aq)+2NH+4(aq)+2SO42-(aq) +6H2O(l) = (NH4)2SO4·FeSO4·6H2O(s)
如果溶液的酸性减弱,则亚铁盐(或铁盐)中Fe2+与水作用的程度将会增大。在制备(NH4)2SO4·FeSO4·6H2O过程中,为了使Fe2+ 不与水作用,溶液需要保持足够的酸度。
用比色法可估计产品中所含杂质 Fe3+的量。Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。所以,只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。
三种盐的溶解度(单位为g/100g)数据如下:
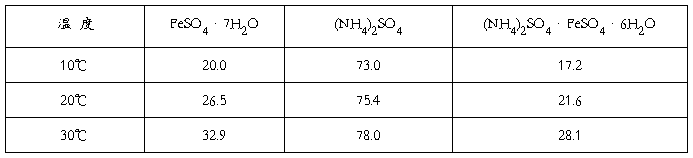
三、药品与试剂
1、仪器
50mL小烧杯、l台式天平、酒精灯、吸滤瓶、布氏漏斗、真空泵、温度计、容量瓶 (1 L 及 500 mL)。
2、药品
盐酸 (2 mol·L-1),硫酸 (3 mol·L-1),标准Fe3+溶液(1.0000g·L-1 由NH4Fe(SO4)2·12 H2O配置),硫氰化钾(KSCN)(25%溶液),硫酸铵(s),碳酸钠(10%溶液),铁屑,乙醇,pH试纸。
四、实验步骤
1、铁屑的洗净去油污
用托盘天平称取2.0 g 铁屑,放入小烧杯中,加入15 ml 质量分数为10%的碳酸钠溶液。小火加热约10 min 后,倾倒去碳酸钠碱性溶液,用自来水冲洗后,再用去离子水把铁屑冲洗洁净。
2、硫酸亚铁的制备
往盛有2.0g 洁净铁屑的小烧杯中加入15ml 3 mol·L-1 H2SO4溶液,盖上表面皿(注意:表面皿凹面向上),放在石棉网上用小火加热(最好在通风橱中进行),使铁屑与稀硫酸反应至基本不再冒出气泡为止(约需15min,注意区分因沸腾而产生的气泡)。在加热过程中应不时加入少量的去离子水,以补充被蒸发的水分,防止 FeSO4 结晶出来;同时要控制溶液的PH值不大于1(为什么?如何测量和控制?)趁热用普通漏斗过滤(过滤前称出滤纸的质量),滤液承接于干净的蒸发皿中。将留在烧杯中残渣转移至滤纸上,并用少量无水乙醇洗涤,然后将滤纸和残渣一起放入烘箱中,计算出残渣的质量。根据已反应的铁屑质量,计算溶液中FeSO4的理论产量。
3、硫酸亚铁铵的制备
根据 FeSO4的理论产量,计算并称取所需固体(NH4)2SO4 的用量。在室温下将称出的(NH4)2SO4配制成饱和溶液,然后倒入上面制得的FeSO4溶液中。混合均匀并调节pH值为1-2,在石棉网上(上加三角架)蒸发浓缩至溶液表面刚出现薄层的结晶时为止(蒸发过程不宜搅动)。自石棉网上取下蒸发皿,放置、冷却,即有硫酸亚铁铵晶体析出。待冷至室温后(能否不冷至室温?),用布氏漏斗抽滤(参见基本操作),最后用少量的乙醇洗去晶体表面所附着的水分(此时应继续抽气过滤)。将晶体取出,置于两张干净的滤纸之间,并轻压以吸干母液,称重。计算理论产量和产率。公式如下:
产率= 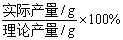
五、数据记录与处理
记录铁屑反应前后的质量和最终产品硫酸亚铁铵的质量,计算硫酸亚铁铵的理论产量和产率
六、思考题
1、计算硫酸亚铁铵的产率时,应以什么为准?为什么?
2、能否将最后产物直接放在表面皿上加热干燥?为什么?
3、在制备硫酸亚铁时,为什么要使铁过量?
第二篇:实验十三硫酸亚铁铵的制备与限量分析










