补钙制剂中钙含量的测定
(高锰酸钾间接滴定法)
一、实验目的
1.了解沉淀分离的基本要求及操作。
2.掌握氧化还原法间接测定钙含量的基本原理及方法。
二、实验原理
利用某些金属离子(如碱土金属、Pb2+、Cd2+等)与C2O42-能形成难溶的草酸盐沉淀的反应,可以用高锰酸钾法间接测定它们的含量。即先将Ca2+全部沉淀为CaC2O4,沉淀经过滤洗涤后溶于稀H2SO4中。
反应方程式:
Ca2++C2O42-=CaC2O4↓
CaC2O4+H2SO4 =CaSO4+H2C2O4
5H2C2O4+2MnO42- +6H+= 2Mn2++10CO2↑ +8H2O
在酸性条件下,用Na2C2O4作基准物质标定KMnO4溶液的反应为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O
滴定时利用MnO4-本身的紫红色指示终点。
计算公式:
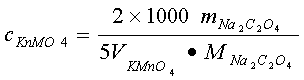
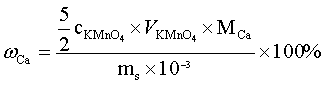
三、试剂仪器
试剂:KMnO4(s)分析纯;Na2C2O4(s)分析纯;H2SO4溶液1 mol·L-1,3 mol·L-1、草酸胺(NH4C2O4)5 g·L-1、氨水 10%、HCl (1:1)、甲基橙 2 g·L-1、硝酸2 mol·L-1、硝酸银 0.1 mol·L-1。
仪器:托盘天平、分析天平、烧杯250ml、水浴锅、漏斗、量筒10ml,50ml、酸式滴定管50ml、洗瓶、铁架台、玻璃棒。
四、实验步骤
(一)KMnO4 标准溶液的配置和标定
1、配置0.02 mol·L-1 KMnO4溶液500mL
称取1.6gKMnO4溶于500mL水中,盖上表面皿,加热至微沸并保持微沸状态1小时冷却后室温放置2——3天后,用玻璃棉过滤,滤液存于棕色试剂瓶中。
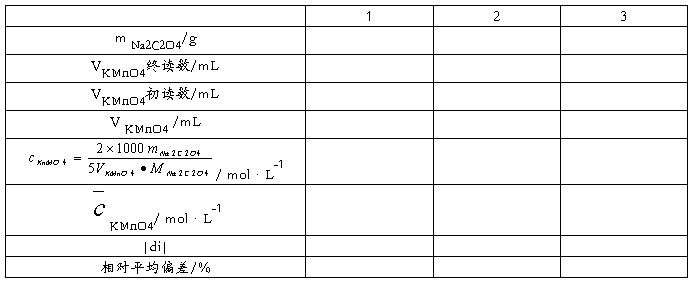
2、KMnO4溶液的标定
准确称取0.13——0.16g基准物质Na2C2O4至于250mL锥形瓶中,加40mL水,10mL3 mol·L-1 H2SO4,加热至70——80℃,趁热用KMnO4溶液进行滴定,至滴定的溶液呈微红色,半分钟内不退色即为终点。平行测定三份,计算KMnO4溶液的浓度和相对平均偏差。
(二)、补钙制剂中钙含量的测定
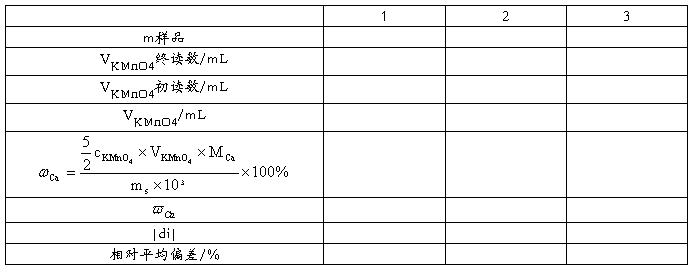
准确称取补钙制剂三份(每份含钙约0.20 g),分别置于250 mL烧杯中,加入适量蒸馏水盖上表面皿,缓慢滴加10mlHCl溶液,加热促使其溶解。于溶液中加入2~3滴甲基橙,以NH3水中和溶液由红转变为黄色,趁热逐滴加约50 mL (NH4)2C2O4,在水浴中陈化30 min。
冷却后过滤(先将上层清液倾入漏斗中),将烧杯中的沉淀洗涤数次后转入漏斗中,继续洗涤沉淀至无Cl-(以小试管接洗液在HNO3介质中用AgNO3检查不到白色沉淀为止)。将带有沉淀的滤纸铺在原烧杯的内壁上,用50 mL 1 mol·L-1 H2SO4把沉淀由滤纸上洗入烧杯中,再用洗瓶洗2次,加入蒸馏水使总体积约100 mL,加热至70~80℃,用KMnO4标准溶液滴定至溶液呈淡红色,再将滤纸搅入溶液中,若溶液褪色,则继续滴定,直至出现的淡红色30 s内不消失即为终点。平行测定三分,计算补钙制剂中钙含量及其中相对平均偏差。
五、数据记录及处理
1、标准溶液的配置和标定
六、注意事项
1、室温下,KMnO4与Na2C2O4之间的反应速度缓慢,故须将溶液加热。但温度不能太高,超过90℃,已引起H2C2O4分解:
H2C2O4=CO2+CO+H2O
2、若滴定速度较快,部分KMnO4将来不及与Na2C2O4反应而在热的酸性溶液中按下式分解:
4MnO4-+4H+=4MnO2+3O2+H2O
3、KMnO4滴定终点不太稳定,这是由于空气中含有还原性气体级尘埃等杂质,能使KMnO4缓慢分解,而使微红色消失,故经过半分钟不褪色即可认为已到达终点。
4、注意观察溶液颜色的变化,控制滴定速度,防止超过滴定终点。
5、实验时必须把滤纸上的沉淀洗涤干净,滤纸一定要放入烧杯中一起滴定。
6、用NH4C2O4沉淀Ca时一定要控制溶液的pH,避免因溶液酸度过大沉淀量减少。
7、洗涤沉淀是一定要使洗液在硝酸介质中用硝酸银检查不到白色沉淀,避免Cl1-与反应,影响测定准确度。
五、数据记录及处理
1、标准溶液的配置和标定

2、补钙制剂中钙含量的测定

实验二十三 合金钢中微量铜的萃取光度测定
思考题:
1.能否用量筒加入CHCl3,为什么?
答:不能用量筒加入CHCl3。因实验要求加入的量要准确,否则会影响萃取相的浓度。
2.能否在用浓氨水调节溶液pH8~9后,加EDTA以消除Fe3+、Co2+、Ni2+的干扰,为什么?
答:不能在用浓氨水调节溶液pH8~9后,再加EDTA以消除Fe3+、Co2+、Ni2+的干扰。因为这时Fe3+会生成沉淀,起不到掩蔽的效果。
第二篇:钙与健康及补钙药物中钙含量的测定
钙与健康及补钙药物中钙含量的测定
组长:何冠男 组员:吴殷林,杨扬,邰怡,高巍巍
一、钙与健康
钙是人体内含量最高的元素之一,总量约为1200克,99%的钙集中于骨骼和牙齿中,只有1%存在于软组织、细胞外液和血液中。钙是人体最易缺乏的矿物质元素。缺乏的原因是由于钙的吸收利用率低。成人对膳食钙的吸收利用率一般仅约20%,儿童和青少年对钙的吸收率为35%左右
缺钙会引起佝偻病,发育迟缓,骨皮疏松症,严重者甚至骨折,此外缺钙还可导致牙齿脱落,神经痛,外伤后流血不止等。近年已证实缺钙还是诱发糖尿病、高血压、老年痴呆症及多种过敏性疾病的因素。下面将详细介绍钙与心血管疾病和及癌症的关系。
(一)钙与心血管疾病
来自原发性高血压患者的代谢评价资料、流行病学调查结果以及动物模型的数据均支持钙营养状态与血压有关,即"钙摄入量不足可能是增加动脉高血压发生的因素之一"。 流行病学调查结果证明,血清离子钙浓度的变化与高血压呈负相关,高血压病人的钙摄入量较低,其中一些人在钙代谢方面出现异常。已有多个研究证实尿钙排泄的增加与血压升高有关,提示特殊人群尿钙排泄量的增加是患高血压危险的征兆。根据四年发生高血压危险性的前瞻性研究结果,钙摄入量大于0.8克与高血压降低有关。根据美国第一次全国健康和营养调查的数据库,人们发现钙摄入量的增加对降低血压的影响有明显临界值,即随人群膳食钙水平从1.4克降低到0.6克,高血压的流行从4~5%上升到7~8%;随着再降低到0.3克,高血压升高的比例增加到10~12%。这个临界值随年龄和性别而改变。
(二) 钙在预防肿瘤中的作用
目前,结肠直肠癌和乳腺癌仍然是西方社会癌症死亡的主要原因之一。在我国,随着人们生活水平的提高,动物性脂肪摄入量增加,结肠直肠癌和乳腺癌的发病率呈上升的趋势。流行病学的研究一般均支持膳食脂肪的量是结肠癌和乳腺癌形成病因学的一个环境因素。 钙与肿瘤关系的研究结果主要集中在结肠癌和乳腺癌。因为乳腺癌的流行病学方式类似于结肠癌,与膳食脂肪有密切关系。大量动物实验模型、流行病学调查及临床观察的结果,均支持膳食钙与结肠癌和乳腺癌的发病率降低有关。钙和维生素D的摄入量和结肠直肠和乳腺癌的发病率呈负相关,与结肠直肠癌危险性的降低有关;钙摄入量和结肠癌的危险性间可能存在直线剂量反应关系。近来的研究结果证明:在高危险人群,通常膳食钙的水平不足以抵消膳食中某种营养素过量或缺乏所致的结肠癌。通过人体补充钙的实验,证明钙与人结
肠粘膜上皮细胞过度增殖的关系;每日通过食物中补充钙1.25~2.0克,短期内可使与结肠癌发生有关的细胞过快增殖得到逆转;上皮细胞的增殖显著降低或过度增殖的结肠上皮消失。流行病学研究结果提示,每日高膳食钙摄入量大于1克或每千卡热能大于0.6克,可降低人群结肠癌的危险性。因此,有人建议要降低结肠癌的发生率,每日适宜钙摄入量男性1.8克、女性1.5克。已有人证实常食用低脂奶产品(或补钙产品),可降低结肠癌的危险性。
科学家们将钙与结肠癌的关系归结为以下假设:在高脂肪低纤维的膳食中,过多的脂肪不能被小肠吸收,剩余的脂肪酸就进入结肠,在某种条件下脂肪酸和胆汁酸干扰结肠上皮的完整性,导致上皮组织损伤以及细胞的过快增殖(癌症的前兆),由于钙对脂类有高度亲和力,通过中和作为肿瘤促进物的胆汁酸和脂肪酸,钙可以很大程度地减少脂质对细胞的损伤,拮抗高脂肪膳食促进结肠癌和乳腺癌的作用。这个假设被称为"钙假设",在许多动物实验中得到证实。
在研究膳食钙拮抗膳食脂肪促进结肠癌和乳腺癌方面起作用,还需要同时考虑可能影响钙在机体内发挥生物活性的其它因素。这些因素包括:膳食维生素D的量,促进钙的吸收利用;膳食磷的水平,因为磷易被吸收,导致血清磷增加,反过来可影响钙的生物利用率。
在研究膳食钙与结肠癌和乳腺癌的关系时,也要考虑到影响钙生物活性的因素,包括膳食维生素D和磷的水平。维生素D对钙的化学预防功能起协同作用,可能与维生素D增加肠钙吸收有关。由于膳食中磷易于吸收,可导致血清磷的浓度增高,影响钙的利用,于是高膳食磷可能拮抗钙抑制细胞增殖的有益作用。当建议增加膳食钙和维生素D摄入量时,需要特别强调指出其益处和危险性。这一方面是如果摄入较高浓度的钙和维生素D,可导致大量的钙经肠丢失和尿钙浓度过高,如尿中有高浓度草酸盐或其它阴离子会沉淀钙,使肾结石的发病率增加;另一方面,在一些补钙制剂中同时添加大量维生素D,长期使用时维生素D的毒性尤其值得注意,特别对儿童。还需要进行大规模的干预实验,确定碳酸钙、维生素D和两者结合在预防结肠癌和乳腺癌方面的作用,以及长期使用的安全性和效果。
(三)钙在人体内的基本作用
钙是人体内的一种微量元素,它在体内的含量虽然微乎其微,但是它的作用是巨大的。 直接的作用是钙能维持调节机体内许多生理生化过程,调节递质释放,增加内分泌腺的分泌,维持细胞膜的完整性和通透性,促进细胞的再生,增加机体抵抗力。间接的作用就比较具体繁多,例如钙可以使骨骼粗壮,使肌肉发达,使人精神饱满,维持体内酸碱适中、水和电解质平衡等。钙还可以消除炎症、净化血液、强力解毒、健美皮肤并能抑制有害病菌的入侵等。钙使人体保持上述状况,实际上是人体抵抗力强的一种综合表现。举例来说,钙能预防治疗感冒的原因有三方面:⑴钙能降低毛细血管的通透性;⑵钙能抑制病菌的生存;⑶钙能增强人体对环境冷暖变化的适应能力。
(四)补钙的标准
钙的含量与人的健康息息相关,为了避免钙缺乏疾病的发生,营养学家确定了补钙的标
准。目前,各国规定的钙营养标准有差别,多数为儿童期400毫克~700毫克/日,青春期1300毫克/日,青年及成年早期800毫克~1000毫克/日,此补钙标准对建立和维持较高水平的骨峰值是必要的。更年期妇女为防止绝经期后“骨丢失”,可以增加到1500毫克/日,50岁以上妇女还可以增至2500毫克/日。最近,美国营养专家确定,钙的日摄入量上限为2500毫克。根据我国的实际情况及人民的体质状况,国内营养学专家建议钙的日摄入量上限为2000毫克为宜
(五)补钙药物的种类
目前常用钙剂分无机钙和有机钙两类。无机钙含钙量高,作用快,但对胃刺激性大;有机钙含量低,吸收较好,刺激性小。一般市售钙剂的吸收率均在30%左右。碳酸钙是口服钙剂中较常用的一种。
二、实验部分
补钙的效果关系的人的健康,补钙制剂中钙的含量也就成为了人们关注的问题。本小组主要研究了三种以碳酸钙为主要成份的口服钙剂(新盖中盖高钙片, 凯思立D3, 钙尔奇)和一种葡萄糖酸钙为主要成分的药物(钙素母片)中的钙含量。
(一) 实验原理
钙制剂一般用酸溶解后调节pH=12-13,减少Mg2+干扰。以钙指示剂为指示剂,指示剂与钙离子生成酒红色络合物,当用EDTA注定终点时,游离出指示剂,溶液呈现蓝色。
(二) 主要试剂和仪器
1. EDTA(0.01mol/L):称取2g EDTA二钠盐于250ml的烧杯中,加水溶解后稀释至
500ml,储于聚乙烯瓶中备用。
2. CaCO3标准溶液(0.01mol/L):准确称取基准物质CaCO3 0.25g左右,先用少量水
润湿,再逐滴加入2mol/LHCl至恰好完全溶解,转移到250ml容量瓶中,水稀释至刻度。
3. NaOH (5mol/L)。
4. HCl (2mol/L)。
5. 主要仪器:分析天平,研钵等
(三) 实验步骤
1. EDTA浓度的标定
准确移取25.00ml CaCO3标准溶液3份分别于250ml锥形瓶中,加2mlNaOH
溶液,钙指示剂30mg,EDTA滴定至蓝色。 2. 钙制剂中钙含量的测定
将洁净的纸片放入研钵中,再将药片放入研钵中研磨。准确称取0.2-0.4g研碎了的药片,加入2mol/L HCl约10ml,加热溶解完全。加蒸馏水继续蒸发除去过量的酸至pH=6-7,转移到250ml容量瓶中,蒸馏水定容,摇匀。准确移取上述溶液25.00ml于250ml锥形瓶中,加入NaOH溶液5ml,蒸馏水25ml,摇匀,加入钙指示剂30mg,用0.01mol/LEDTA标准溶液滴至蓝色。平行滴定三次。 3. 计算钙片中CaCO3或葡萄糖酸钙的百分含量
(四) 实验结果
1.新盖中盖高钙片中钙含量测定
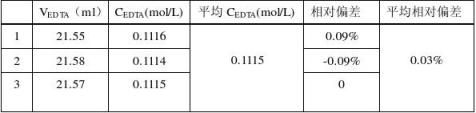

注:在测定EDTA浓度时mCaCO3=0.2407g,在测定药品中该含量时m药=0.2771g 根据该药说明书,每2.5g药片含CaCO31.25g,即 WCaCO3=50% 2. 凯思立D3钙含量的测定
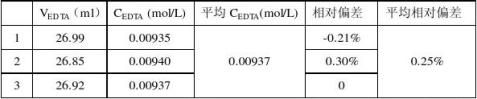
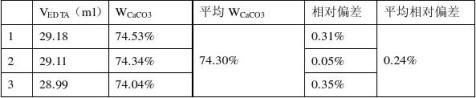
注:在测定EDTA浓度时mCaCO3=0.2546g,在测定药品中该含量时m药=0.3702g。 根据该药片说明书,每1.7g含CaCO31.25g,即WCaCO3=73.5%。
3.钙尔奇中钙含量的测定
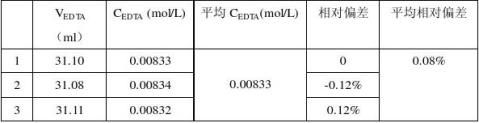
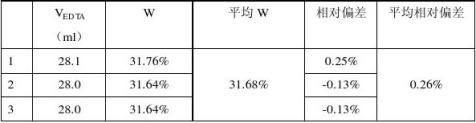
注:在测定EDTA浓度时mCaCO3=0.2593g,在测定药品中该含量时m药=0.3305g。根据药片说明书,每0.6g该药片含葡萄糖酸钙0.16g,即W=26.7%, 相当于WCaCO3=5.95% W=31.68% ,相当于WCaCO3=7.07%。
三、市场调查部分
(一)市场问卷调查主要问题:(50份)
1.请问您为什么补钙(多选) A. 感觉有缺钙症状(15) B. 觉得这个年龄应该补钙(40) C. 觉得钙对人体多多益善(20) 2. 觉得补钙前后身体状况有什么差别? A. 不再有缺钙症状(22%) B. 仍有缺钙症状但较轻(8%) C. 没什么变化(70%)
3. 您选择怎样的补钙手段?(多选) A. 多喝牛奶(40) B. 吃钙片(35) C. 服用液体钙囊(9)
D. 服用葡萄糖酸钙口服液(6)
4.您是否在购买钙药物的时候注意到有添加剂(如维生素D)会促进钙的吸收? A.是的 (58%) B 不是很注意 (14%) C有时注意(28%) 5.您是否喜欢购买同时含有其它微量元素(如铁锌等)的钙药物?
A.是 (16%) B.不是 (84%)
6.您是否按药物说明书上的剂量按时服用?
A. 不是,相对多吃些(14%)
B. 不是,相对少吃些(0)
C. 不是,感觉缺钙的时候才去吃,平时不怎么吃(38%)
D. 是(48%)
7.您是否觉得钙药物的价格越高,补钙效果越好?
A.是 (82%) B 不是(18%)
8.您打算什么时候停止补钙?
A.不打算停止(32%)
B.缺钙症状一消失就停止(12%)
C.缺钙症状消失一段时间后再停止(52%)
D.没想过(4%)
E.觉得钙对人体多多益善(20)
(二)调查结果
1. 不少人认为钙对人体多多益善,这是不对的。
2. 很多人在反现有缺钙症状时才开始补钙,这是不对的。
3. 很多人以喝牛奶的方式补钙,这是很正确的,因为牛奶中的有机钙更易被人体吸收。
4. 很多人认为补钙药品越贵效果越好,这也是不对的。
结论:
通过这次的研究性学习,让我们真实地感到了化学的魅力所在,同时也让我们感到了理论与实际的的差异,理想与现实的距离。 而且通过大规模的查找资料,让我们充分意识到化学这一学科的重要性和对人类巨大的贡献。提高了我们学习和研究化学的积极性。我们通过自己查找资料,自己设计试验,自己动手,自己咨询,我们的收获不仅是学习的能力,更是生存的能力。所以这次的研究性学习,不仅是为我们本专业的学习打下良好基础,更是为我们走向社会作了良好的铺垫。
