结晶水含量测定的原理
[设计思想]
测定硫酸铜晶体里结晶水含量是高中化学一个重要的定量实验。它是帮助学生形成化学定量测定科学方法、态度、技能的重要载体。教学设计着重三个环节:(1)通过对实验目的的认识,以及对硫酸铜晶体的性质、用途、组成的复习、分析讨论,为学习结晶水含量测定的原理和方法,设计测定硫酸铜结晶水含量的实验方案作铺垫;同时体验化学物质对人类生存、发展重要作用,以及化学学科思想、方法对推动人类科学发展重要意义,形成尊重科学,用科学为人类服务的思想观念。(2)以硫酸铜晶体中结晶水含量测定原理的讨论为例,概括出结晶水合物中结晶水含量的测定的基本原来和一般方法,掌握从具体到抽象的思维方法,以及间接测定的方法,体验定量测定中转化的思想方法对人类科学活动的影响与作用。(3)通过测定硫酸铜结晶水含量的实验方案讨论与设计,学习相关仪器的使用方法与操作技能;学习结晶水含量的测定的设计思想、方法,初步形成严谨的科学态度和习惯,以及环境保护意识;感悟实事求是、严肃认真、一丝不苟的科学态度对个人和社会发展的重要作用。
一.教学目标
1.知识与技能
(1)结晶水合物中结水含量的测定原理(C)。
(2)瓷坩埚、研钵、干燥器等仪器的正确使用(B)。
(3)恒重等基本操作技能(B)。
2.过程与方法
(1)通过设计测定硫酸铜结晶水含量的实验方案,认识观察、测量、实验条件的控制、数据处理等科学方法。
(2)通过设计测定硫酸铜结晶水含量的实验方案,认识测定物质组成,确定物质化学式的定量实验一般方法。
3.情感态度与价值观
(1)通过设计实验方案,体验工农业生产中化学定量实验的重要性。
(2)通过实验方案的讨论,体验实事求是、严肃认真、一丝不苟的科学态度在定量测定实验中的意义。
二.教学重点和难点
1.教学重点
结晶水合物中结水含量的测定原理和方法。
2.教学难点
设计测定硫酸铜结晶水含量的实验方案
三.教学用品
药品:CuSO4·xH2O
仪器:电子天平、研钵、玻璃棒、三脚架、泥三角、瓷坩埚、坩埚钳、干燥器、酒精灯、药匙。
媒体:电脑、投影仪(有条件学校)
四.教学流程
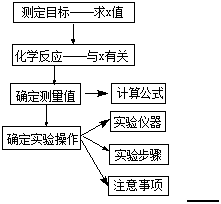
1. 流程图
流程图
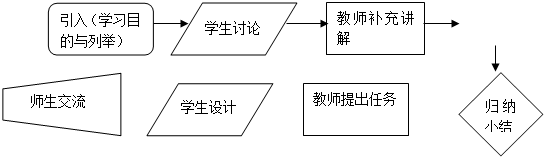






2.流程说明
引入:通过学习目标的阐述与请同学们列举学习过的结晶水合物,并说出CuSO4·5H2O的性质与用途,引入课题。
学生讨论:列举学习过的结晶水合物,说出CuSO4·5H2O的性质与用途,此时自然融入化学物质对生活、生产的作用以及使用它时要讲科学等“生命教育‘内容。
教师补充:湿法冶金术,让学生感受我国劳动人民的勤劳智慧和热爱学科的精神。
师生交流:根据CuSO4·5H2O的化学式,如何计算结晶水的百分含量?如果不知道硫酸铜晶体中结晶水的含量(CuSO4·xH2O),如何测出x值?
归纳小结:晶体中结晶水的测定的原理。
教师提出任务:依据以上原理,请设计一个确定硫酸铜晶体化学式的实验。设计定量实验应从那几个方面考虑?
学生设计:(1)用准确的语言表述测定硫酸铜晶体化学式的实验目的、原理。(2)写出实验步骤、仪器、药品。(3)设计数据记录表(3)写出计算式师生交流:实验原理、操作步骤与仪器、数据记录表设计。
归纳小结:实验设计思路、实验步骤。
学生讨论:一个较精确的定量实验,为了减小误差,实验操作中应注意那些事项?确保测定准确的关键操作有那些?
归纳小结:对实验操作关键点、注意事项的归纳。
学生思考:通过2个思考题,检查学生对讨论内容的理解情况。
归纳总结:测定硫酸铜晶体化学式的实验设计思路、原理、步骤、注意事项。
五.教学案例
1.教学过程

2.主要板书
一、硫酸铜晶体的组成、性质及用途
CuSO4·5H2O,是一种蓝色固体,固体受热时变为白色粉末,用作纺织品媒染剂、农业杀虫剂、水的杀菌剂,饲料添加剂,并用于镀铜
二、结晶水含量测定的原理
(1)明确测定目标——求x值 例:CuSO4·xH2O晶体中结晶水的测定
(2)寻找关系——与x有关或间接有关 CuSO4· xH2O CuSO4 + xH2O
CuSO4 + xH2O
(3)确定有关的测量数据(直接测量和间接测量) 硫酸铜晶体质量m1
(4)找出测间接测量的有关化学反应 无水硫酸铜质量m2
 (5)计算
(5)计算
三、测定硫酸铜结晶水含量的实验方案设计
1.实验设计思路
2.实验步骤
(1)研磨:在研钵中将硫酸铜晶体研碎。
(2)称量:准确称量一干燥洁净的瓷坩锅质量(m1)。
(3)再称:称量瓷坩埚+硫酸铜晶体的质量(m2)。
(4)加热:加热至蓝色晶体全部变为白色粉末,并放入干燥器中冷却。
(5)再称:在干燥器内冷却后,称量瓷坩埚+硫酸铜粉末的质量(m3)。
(6)再加热:把盛有硫酸铜的瓷坩埚再加热,再冷却。
(7)再称重:将冷却后的盛有硫酸铜的瓷坩埚再次称量(两次称量误差不得超过0.001 g)。
(8)计算:根据实验测得的结果计算硫酸铜晶体中结晶水的质量分数。
3.相关连接
1 中学化学教师手册 上海教育出版社
2 http://xiaohe.heyma.net
六.教学反思
通过测定硫酸铜结晶水含量的实验方案设计的教学,学生从量的方面加深对物质的性质和变化规律的理解;学生从研磨、干燥器中冷却、恒重操作等实验设计讨论中加深对实事求是、严肃认真、一丝不苟的科学态度与精神的认识;深化了实验操作正确与否对测定结果有很大影响的认识,初步形成了结晶水含量测定实验方案设计思路,理解了测量、实验条件的控制、数据处理与分析等科学方法;同时通过测定硫酸铜结晶水含量的实验方案设计也自然地体验了化学学科思想方法与价值对人与社会发展的影响与作用。
由于本节课重点是原理讨论与方案设计,学生实验操作方法动手机会比较少,因此,教学中要着重调动学生的思维积极性,加强小组讨论的指导,引导学生积极参与讨论、交流与倾听同学发言。
第二篇:硫酸铜结晶水的测定
实验一:硫酸铜晶体结晶水含量测定
重点难点:
1.晶体结晶水含量测定的原理和步骤
2.利用实验数据计算的原理
导学目标:
知识与技能
过程与方法
情感态度价值观
1.了解硫酸铜晶体结晶水含量测定实验的原理;
2.了解硫酸铜晶体结晶水含量测定实验的步骤;
3.认识泥三角、坩埚、干燥器等仪器;
4.掌握泥三角、坩埚、干燥器等使用方法。
5、培养学生分析问题、思考问题的习惯。
课前准备 : 三脚架、泥三角、酒精灯、坩埚、坩埚钳、托盘天平、干燥器、胆矾 媒体
思路: 阅读学道——展示仪器,进行简单讲解——讨论思考问题——抢答问题——例题讲解——习题验学——展示思维导图,进行评比。
板书设计:
实验一:硫酸铜晶体结晶水含量测定
1、实验原理:
设硫酸铜晶体的化学式为:CuSO4?xH2O,则一摩尔晶体的质量为:160+18x克,失去结晶水后质量为:160克,结晶水的质量为:18x克。实验时若称取W1克胆矾晶体,失去结晶水后质量为W2克,则(160+18x)÷18x=W1÷(W1- W2)由此可以计算出x的数值。
2、实验步骤:
(1)、称取空坩埚的质量为w;
(2)、将一部分胆矾放入坩埚,再次称取质量为W1;
(3)、加热坩埚中的胆矾;
(4)、将加热后的坩埚放入干燥器中冷却至室温;
(5)、再次称量坩埚与晶体的质量;
(6)、重复(3)——(5)的步骤,至前后两次质量之差小于0.1克。
(7)、计算得出结果。
3.反思与创新
引言:有很多晶体都含有结晶水,例如胆矾、绿矾、明矾、碳酸钠等等,这些晶体中的结晶水含量各不相同,但它们受热时都能失去结晶水,所以根据加热前后晶体质量的变化,可以通过计算得出每种晶体中结晶水的含量。
1、实验原理:
设硫酸铜晶体的化学式为:CuSO4?xH2O,则一摩尔晶体的质量为:160+18x克,失去结晶水后质量为:160克,结晶水的质量为:18x克。实验时若称取W1克胆矾晶体,失去结晶水后质量为W2克,则(160+18x)÷18x=W1÷(W1- W2)由此可以计算出x的数值。
2、实验步骤:
(1)、称取空坩埚的质量为w;
(2)、将一部分胆矾放入坩埚,再次称取质量为W1;
(3)、加热坩埚中的胆矾;
(4)、将加热后的坩埚放入干燥器中冷却至室温;
(5)、再次称量坩埚与晶体的质量;
(6)、重复(3)——(5)的步骤,至前后两次质量之差小于0.1克。
(7)、计算得出结果。
3、思考下列问题
(1)测定原理:CuSO4?5H2O中,Cu(H2O)42+与 SO42-?H2O,其中前者是蓝色的,后者是_______色的。5个水分子与CuSO4结合力是__________,在383 K时,Cu(H2O)42+失去4个水分子,在531 K时,才能使_________中的水失去。
(2)测定标准记量:
如果用w为托盘天平称量坩埚的质量,w2为坩埚与晶体的总质量,w3是无水CuS04与坩埚再加热,放在干燥器中冷却后的质量。设x为结晶水的物质的量,则计算x的数学表达式为值只有在4.9-5.1之间,才表明实验是成功的。
(3)测定误差分析:
你认为在_________条件下会导致实验失败。你认为产生误差的可能情况有哪些? (至少写五种) 引起学生兴趣
例题讲解:
(4)脱水后的白色CuSO4 粉未为什么要放在干燥器中冷却?
(5)该实验为什么以两次称量误差不超过0.1 g(即 (0.1 g)作为标准?
4、实验的改变
做此实验如果没有瓷坩埚、坩埚钳、铁架台等仪器,可用试管和试管夹代替来做,步骤如下: ①用天平准确称量出干燥试管的质量,然后称取已研碎的CuSO4?5H2O并放入干燥的试管。CuSO4?5H2O应铺在试管底部。
②把装有CuS04?5H20的试管用试管夹夹住,使管口向下倾斜,用酒精灯慢慢加热。应先从试管底部加热,然后将加热部位逐步前移,至CuS04?5H2O完全变白:当不再有水蒸气逸出时,仍继续前移加热,使冷凝管在试管壁上的水全部变成气体逸出。
③待试管冷却后,在天平上迅速称出试管和 CuSO4的质量。
[例题]在测定硫酸铜结晶水的实验操作中:
(1)加热前应将晶体放在__________中研碎,加热是放在__________中进行,加热失水后,应放在__________中冷却。
(2)判断是否完全失水的方法是_____________________________________。
(3)做此实验,最少应进行称量操作_________次。
(4)下面是某学生一次实验的数据,请完成计算,填入下面的表中。
坩埚质量 坩埚与晶体总质量 加热后坩埚与固体总质量 测得晶体中结晶水个数 11.7g 22.7g 18.6g
(5)这次实验中产生误差的原因可能是________(填写字母)所造成。
(A)硫酸铜晶体中含有不挥发性杂质
(B)实验前晶体表面有湿存水
(C)加热时有晶体飞溅出去
(D)加热失水后露置在空气中冷却
习题:
一、选择题
1.某学生称量CuSO4?5H2O时,左盘放砝码4 g,游码在0.5刻度处,天平平衡。右盘CuSO4?5H2O晶体的质量是 ( )
(A)4.5 g (B)4 g (C)3.5 g (D)3 g
2.下列实验操作会引起测定结果偏高的是( )
(A)测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上冷却
(B)中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释
(C)为了测定一包白色粉末的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡
(D)取待测液的酸式滴定管用水洗后,没用待测液润洗
3.实验室测定CuSO4?5H2O晶体里结晶水的n值时,出现了三种情况:
①晶体中含有受热不分解的物质 ②晶体尚带蓝色,即停止加热 ③晶体脱水后放在台上冷却,再称量。使实验结果偏低的原因是( )
(A)①② (B)①③ (C)②③ (D)①②③
4.下列操作:①用铁坩埚灼烧烧碱 ②用瓷坩埚除去胆矾晶体中的结晶水 ③用酸式滴定管装KMn04溶液 ④直接加热蒸发皿,其中正确的是( )
(A)都正确 (B)①④ (C)③④ (D)②③
5.下列实验操作会引起测定结果偏高的是( )
(A)测定胆矾晶体结晶水含量时,强热迅速蒸干,在干燥器中冷却后称量
(B)中和滴定时,锥形瓶里有少量水(C)用量筒量取液体时,仰视读数
(D)加热胆矾晶体测其结晶水含量时,加热过程中坩埚没有盖盖
6.托盘天平一般精确到__________g,称取5.0g
CuSO4?5H2O之前,应先将天平_______并在两个托盘上各放__________。然后在 ________盘先放 ____g__________。在_________盘加 _____。称毕应及时将砝码___________,并使天平复原。
7.已知在坩埚中加热硫酸铜晶体,受热分解过程如下:有人借助如图封闭装置进行硫酸铜晶体脱水实验,回答下列问题:
(1)本实验可用于验证的化学定律是_________________
(2)d处加热片刻后现象__________________________
(3)你认为此装置设计是否合理、科学?如不合理,理由_______________________
8.实验室用氨气还原氧化铜的方法测定铜的相对原子质量,反应的化学方程式为: 2NH3十3CuO N2十3Cu十3H2O。
(1)如果选用测定反应物CuO和生成物H20的;质量m(CuO)、m(H2O)时,请用上图所示的仪器设计一个简单的实验方案。
①仪器连接的顺序(填编号;仪器可重复使用)是____________________________ D中浓硫酸的作用是______________________
②列出计算Cu的相对原子质量的表达式:______________
③下列情况将使测定结果偏大的是_________
a.CuO未全部还原为Cu b.CuO受潮 c.CuO中混有Cu
(2)如果仍采用如图所示的实验装置,设计其他方案,还可测定的物理量有_______
(A)m(Cu)、m(CuO) (B)m(N2)、m(H2O)
(C)m(Cu)和m(H2O) (D)m(NH3)和m(H2O)
【固学】 《硫酸铜晶体里结晶水含量的测定》针对训练答案
1.C 2.C 3.D 4.A 5.A
6.0.1 调节平衡 相同的纸 右 5g砝码左 硫酸铜晶体取下放回砝码盒
7.(1)质量守恒定律
(2)蓝色变白色
(3)密封容器加热后诬强增大,易损坏仪器,封闭容器不宜加热。
8.(1)①BCACD 吸收未反应的氨;防止空气中水分进入第二个C装置 固体由黑变红色
② ;③a c;
(2)AC。
