硫酸亚铁铵的制备
一、知识储备——
1.复盐:
A)定义:两种或两种以上简单盐类组成的晶态化合物,如:(NH4)2SO4·FeSO4·6H2O(摩尔盐).
B)特点
(a)溶液性质与组成它的简单盐的混合溶液没有区别;
(b)比组成它的组分的简单盐稳定;
(c)溶解度比组成它的组分的简单盐小.
2. 硫酸亚铁铵,俗名为莫尔盐、摩尔盐,是一种蓝绿色的无机复盐,分子式为(NH4)2SO4·FeSO4·6H2O。其俗名来源于德国化学家莫尔。可溶于水,在100℃~110℃时分解,可用于电镀。
3. 制备或来源:
一般从废铁屑中回收铁屑,经碱溶液洗净之后,用过量硫酸溶解。再加入稍过量硫酸铵饱和溶液,在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂。过滤后用少量乙醇洗涤。
二、实验原理
A)利用(NH4)2SO4·FeSO4·6H2O的溶解度比(NH4)2SO4,FeSO4的小,先结晶析出.
B)浓缩程度控制.
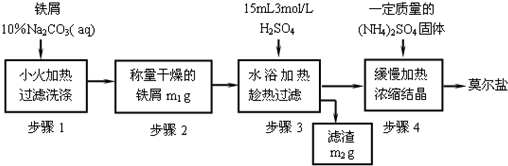
三、实验步骤
1. 铁屑表面油污的去除(如用纯铁粉可省去此步)
用台秤称取2g铁屑放入100mL锥形瓶中,加入15mL100g·L-1的Na2CO3溶液,缓慢加热约10分钟,用倾析法倾去碱液,用去离子水将铁屑冲洗干净。
2. 制备硫酸亚铁
往盛有铁屑的锥形瓶中加入10mL 3mol·L-1的H2SO4,于通风处水浴加热(注意控制反应速率,以防反应过快,反应液喷出)至不再有气泡放出。反应过程中应适当补加些水,以保持原体积。趁热减压过滤。用少量热水洗涤锥形瓶及漏斗上的残渣,抽干。将溶液倒入蒸发皿中。
3. 硫酸亚铁铵的制备
根据溶液FeSO4中的量,按关系式n [(NH4)2SO4]:n [FeSO4]=1:1称取所需的(NH4)2SO4(s),配制成(NH4)2SO4的饱和溶液。将此饱和溶液加到FeSO4溶液中(此时溶液的pH值应接近于1,如pH值偏大,可加几滴浓H2SO4调节),水浴蒸发,浓缩至表面出现结晶薄膜为止(蒸发过程中切不可搅拌)。放置缓慢冷却至室温,得硫酸亚铁铵晶体。减压过滤除去母液并尽量吸干。把晶体转移到表面皿上晾干片刻,观察晶体色态,称重,计算产率
四、实验制备流程图
五、注意事项
1)不必将所有铁屑溶解完,实验时溶解大部分铁屑即可
2)酸溶时要注意分次补充少量水,以防止FeSO4析出.
3)注意计算(NH4)2SO4的用量.
4) 蒸发浓缩初期要不停搅拌,但要注意观察晶膜,一旦发现晶膜出现即停止搅拌
5)最后一次抽滤时,注意将滤饼压实,不能用蒸馏水或母液洗晶体.
六、以镀锌铁片为原料制备硫酸亚铁铵晶体

第二篇:硫酸亚铁铵的制备实验报告
大学化学实验
报告本
(一)
姓名: 赵蕾
实验室: 乙313
周次: 周一
实验柜台: 61
指导老师: 章文伟
硫酸亚铁铵的制备
一.实验目的
1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质
3. 掌握水浴、减压过滤等基本操作
4. 学习pH试纸、吸管、比色管的使用
5. 学习用目测比色法检验产品质量。
二.原理
铁屑溶于稀硫酸生成硫酸铁。硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
Fe + H2SO4 = FeSO4 + H2 ↑
FeSO4 +(NH4)2SO4+6H2O = FeSO4(NH4)2SO4·6H2O
硫酸铵/硫酸亚铁/硫酸亚铁铵在不同温度的溶解度数据(单位:g/100g H2O)
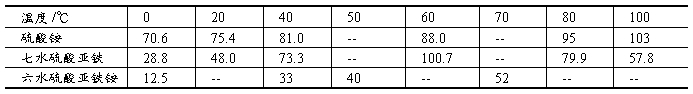
由于复盐的溶解度比单盐要小,因此溶液经蒸发浓缩、冷却后,复盐在水溶液中首先结晶,形成(NH4)2FeSO4·6H2O晶体。
比色原理:Fe3+ + n SCN- = Fe(SCN)n(3-n) (红色) 用比色法可估计产品中所含杂质 Fe3+的量。Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。所以,只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。
三.仪器及药品
洗瓶、250ml烧杯、锥形瓶(150mL,250mL各一个)、移液管(1mL,2mL各一根)10ml量筒、吸滤瓶、比色管(25mL)、比色架、铁粉、2mol/L盐酸、3mol/L硫酸、25%KSCN
四.实验步骤
1. 硫酸亚铁制备

2. 硫酸亚铁铵的制备
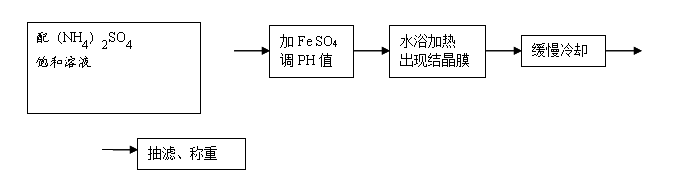
配(NH4)2SO4饱和溶液:0.005*3*132=1.98g((NH4)2SO4),1.98*100÷75=2.64g(水)
3. Fe3+的限量分析

不含氧水的准备 :在250mL锥形瓶中加热150mL纯水至沸,小火煮沸10~20分钟,冷却后备用。
五.记录
1. 实验现象:
① 铁屑与硫酸反应时溶液变为浅绿色,有气泡出现。
② 趁热过滤后,滤液无色。
③ 硫酸亚铁铵溶液加热蒸发后晶体呈浅绿色。
2. 产量:
3. 理论产量:
Fe — FeSO4 — (NH4)2SO4·FeSO4·6H2O
56 392
1 7
m (NH4)2SO4·FeSO4·6H2O) =(392)/56=7g
4. 产率: /7.0 *100% = %
六.思考题
1. 在反应过程中,铁和硫酸哪一种应过量,为什么?反应为什么要在通风橱中进行?
5mL3mol·L-1硫酸所需铁的质量为0.8克,所以是铁过量。铁过量可以防止Fe3+的产生. 由于铁屑中存在硫化物(FeS等)、磷化物(Fe2P、Fe3P等),以及少量固溶态的砷,在非氧化性的稀H2SO4溶液中,以H2S、PH3、AsH3的形式挥发出,它们都有毒性,所以在通风橱中进行。
2. 混合液为什么要呈酸性?
Fe2+在空气中被氧化的速度随溶液酸度的增加而降低, 所以混合液保持微酸性的目的是防止Fe2+的氧化与水解。
3. 限量分析时,为什么要用不含氧的水?写出限量分析的反应式。
防止水中溶有的氧把Fe2+氧化为Fe3+,影响产品等级的判定。 限量分析的反应方程式为:Fe3+ + n SCN- = Fe(SCN)n(3-n) (红色)
4. 怎样才能得到较大的晶体?
溶液的浓度不能大,要缓慢冷却,静置不能搅拌。
七.问题
硫酸亚铁与硫酸亚铁铵的性质有何不同
硫酸亚铁铵比较稳定,定量分析中常用来配制亚铁离子的标液;和其他复盐一样,硫酸亚铁铵的溶解度比硫酸亚铁要小。
