分析化学实验一
分析天平的使用和称量练习
(p85-90,p97-98)
一、实验目的
1、学习分析天平的基本操作和常用称量方法
2、熟练掌握称量方法,在时限内称出目标质量。
3、培养准确、整齐、简明地在报告上记录原始数据的习惯。
二、实验原理
分析天平是分析化学实验中最重要、最常用的仪器之一。常用的分析天平有半自动电光天平、全自动电光天平,单盘电光天平和电子天平等。
电子天平是最新一代的天平,是根据电磁力平衡原理,直接称量,全量程不需砝码,放上被称物后,在几秒内即达到平衡,显示读数,称量速度快、精度高。电子天平具有自动校正、自动去皮、超载指示、事故报警等功能以及具有质量电信号输出功能,可与打印机、计算机联用,进一步扩展功能。电子天平的价格尽管高,但也越来越广泛的取代机械天平应用在各个领域。
电子天平按结构分为上皿式和下皿式电子天平。目前广泛使用的是上皿式电子天平。下面简单介绍电子天平的使用。
1、将天平放在稳定的工作台上,避免振动,气流、阳光直射和剧烈的温度波动。
2、水平调节,调整水平调节脚,使水泡位于水准器中心。
3、预热,接通电源预热1 h后,开启显示器进行操作。称量完毕一般不切断电源,若短时间内暂不使用天平(如2 h),再用时可省去预热时间。
4、天平基本模式选定,天平通常为“通常情况”模式,并具有断电记忆功能。使用时若改其他模式,可按OFF键,返回“通常情况”模式。
5校准,天平安装后第一次使用前或存放时间较长、位置移动、环境变化或为获得精确测量,需校准。
6、称量,按TAR键,显示为零后,置被测物于秤盘上,待数字稳定即显示器左下角的“o”消失后,该数字即为被称物的质量值。
7、去皮称量,按TAR键,显示为零后,置容器于秤盘上,天平显示容器质量,再按TAR键,显示为零,即去皮重。
称量方法:
1、直接称量法:用于称量某一物体的质量,例如小烧杯、容量瓶、坩埚等。
2、固定质量称量法:用于称量某一固定质量的试剂(如基准物质)或试样。特点:称量速度慢;试样不易吸潮、在空气中稳定;粉末或小颗粒样品。
3、递减称量法:用于称量一定质量范围的样品或试剂。因秤取试样的质量是由两次称量之差求得,又称差减法。
具体称量步骤:A、从干燥器中取出称量瓶(注:手指避免直接接触称瓶和瓶盖)。
B、用小纸片夹住打开瓶盖,用药匙加入适量试样,盖上瓶盖。
C、称量出称量瓶加试样的准确质量m1。
D、取出称量瓶,在接收器的上方,倾斜瓶身,用瓶盖轻敲瓶口上部,使试剂慢慢落入容器,在接近所需量时,边敲瓶口边将瓶身竖直,使粘在瓶口的试剂落下,再盖好瓶盖。
E、再次称量出 称量瓶+试样 的准确质量m2。
F、试剂质量m=m1-m2,按上述方法连续递减,直到m落在要求的质量范围内。
电子天平使用的注意事项:
1、开、关天平,放、取被称物,开、关侧门,动作都要轻、缓,不可用力过猛过快造成天平部件脱位或损坏。
2、调零、读数要关门。
3、被称物应在室温,不在室温的(过冷或过热)在干燥器内放至室温。
4、严禁超重。
5、保持天平,天平台,天平室的安全,整洁和干燥。
6、如发现天平不正常,应及时报告老师或工作人员,不要自行处理。
三、实验步骤
1、直接称量法称量钛板。
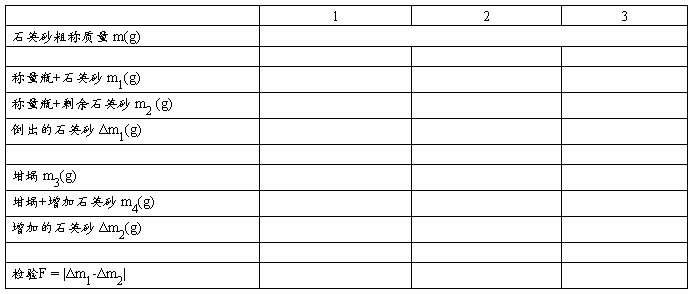
2、递减称量法称量石英砂
A先用托盘天平称量1.7 g石英砂,
B分析天平上称量:称量瓶+石英砂,空坩埚
C用递减法称量石英砂(0.45~0.55 g),石英砂放在坩埚内
D在分析天平上准确称量质量:称量瓶+剩余石英砂,坩埚+石英砂
对比称量瓶中倒出石英砂的质量和坩埚内增加石英砂的质量。
平行试验三次。
四、数据处理
钛板的编号: 质量:
分析化学实验二
NaOH溶液的配制与标定
(p71-76,p105-106)
一、实验目的
1、学习掌握滴定分析常用仪器的洗涤和正确使用方法。
2、了解基准物质邻苯二甲酸氢钾(KHC8H4O4)的性质及其应用。
3、掌握NaOH标准溶液的配制、标定及保存要点。
4、掌握强碱滴定弱酸的滴定过程、突跃范围及指示剂的选择原理。
二、实验原理

三、实验步骤
1、0.1 mol/L的NaOH溶液的配制:用烧杯在台秤上秤取4 g NaOH固体,立刻加入蒸馏水溶解稍冷后,转移至1 L的透明试剂瓶中,加水至1 L,用橡皮塞塞好瓶口,充分摇匀备用。
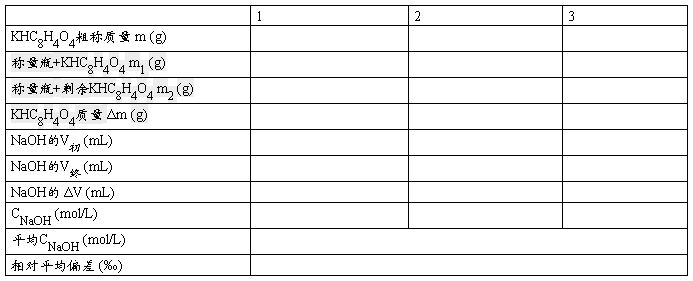
2、0.1 mol/L的NaOH标准溶液浓度的标定
1)用称量瓶以差减法称量KHC8H4O43份到3个250 mL的锥形瓶中,每份0.4-0.5g,加入50 mL蒸馏水,待完全溶解后,加入2-3滴酚酞指示剂。
2)用待标定的NaOH溶液滴定至微红色并保持半分钟不褪色为终点。
3)平行滴定3次,记录NaOH消耗的体积,计算NaOH的浓度、平均浓度及相对平均偏差。
注意:每次滴定都应将NaOH溶液补足到滴定管的0刻度,以避免滴定管不同部位的刻度误差。
四、数据处理及表格
KHC8H4O4摩尔质量:204.20 g/mol
分析化学实验三
铵盐中含氮量的测定(甲醛法)
(考核实验)
一、实验目的
1、了解弱酸强化的基本原理。
2、掌握甲醛法测定铵态氮的原理及操作方法。
3、熟练掌握酸碱指示剂的选择原理。
二、实验原理
4NH4+ + 6HCHO = (CH2)6N4H+ + 3H+ + 6H2O
(CH2)6N4H+ + 3H+ + 4OH- = (CH2)6N4 + 4H2O
铵盐中的NH4+的酸性太弱Ka为5.6 × 10-10,不能用NaOH直接滴定,用甲醛与之生成(CH2)6N4H+,其Ka为7.1 × 10-6可被NaOH直接滴定,因此该反应称为弱酸的强化。
三、实验步骤
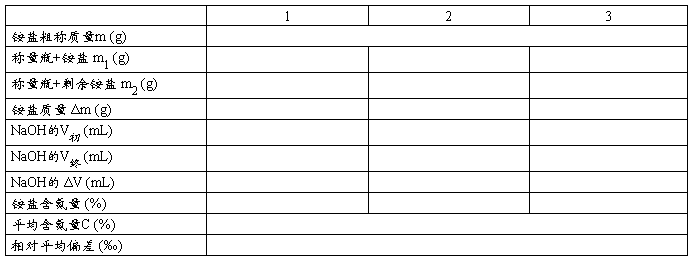
1、用称量瓶以差减法称量未知铵盐3份到3个250 mL的锥形瓶中,每份0.17-0.18g,加入30 mL蒸馏水,待完全溶解后,加入10 mL甲醛,充分摇匀1 min后,加入2-3滴酚酞指示剂,再用NaOH标准溶液滴定至微红色,并保持半分钟不褪色为终点。
2.、平行滴定3次,记录NaOH消耗的体积,计算未知铵盐中的含氮量及相对平均偏差。
四、数据处理及表格
未知铵盐的编号:
分析化学实验四
EDTA的配制与标定
(p123-125)
一、实验目的
1、了解EDTA标准溶液的配制与标定原理
2、掌握常用的标定EDTA的方法
二、实验原理
铬黑T是一种常用的金属指示剂,它属于O,O’-二羟基偶氮染料,简称EBT,化学名称是1-(1-羟基-2-萘偶氮基)-6-硝基=2萘酚-4-磺酸钠,其结构式和铬黑T镁的结构式如下:
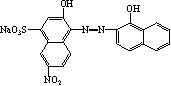

铬黑T MgIn-
铬黑T溶于水时, 磺酸基上的Na+全部离解,形成H2In-。它在溶液中有如下酸碱平衡:

MgY-EBT指示剂原理:
 MgCL2和少量的铬黑T发生反应:Mg2+ (过量) + EBT MgEBT + Mg2+ (游离)
MgCL2和少量的铬黑T发生反应:Mg2+ (过量) + EBT MgEBT + Mg2+ (游离)
加入EDTA,首先和溶液中游离的Mg2+ 发生反应,再和MgEBT反应:
因为 lgKMgY=8.69,lgKMgEBT=7.0,

 Mg2+ + Y MgY,MgEBT + Y MgY + EBT
Mg2+ + Y MgY,MgEBT + Y MgY + EBT
加入Ca2+,,因为lgKMgY=8.69,lgKMgEBT=7.0,lgKCaY=10.69,lgKCaEBT=5.0,反应如下:
 MgY + EBT + Ca2+ CaY + MgEBT
MgY + EBT + Ca2+ CaY + MgEBT
再加入EDTA,溶液中的反应:
 CaY + MgEBT + Ca2+ + Y CaY + MgY + EBT
CaY + MgEBT + Ca2+ + Y CaY + MgY + EBT
三、实验步骤
1、EDTA标准液的配制
称取8 g EDTA (Na2H2Y×2H2O) 固体,在烧杯中溶解,稀释转移至1 L细口瓶中,稀释至约1 L,摇匀备用。
2、Ca2+ 标准液的配制
准确称取0.45-0.55 g左右的CaCO3基准物于小烧杯中,加极少量水调成稠糊,滴加盐酸(1+1) 至全部溶解,稍稀释后定量转移至250 mL容量瓶中,定容,摇匀备用。
3、MgY-EBT指示剂的配制
向250mL的锥形瓶中加入:1mL MgCL2、10mL缓冲液(pH=10)、2滴EBT,用EDTA标准液滴定至蓝色,向另2个250mL锥形瓶中倒入,使其平分三份。
4、准确移取25.00 mL Ca2+标准液至的250mL锥形瓶(含有指示剂)中,再加入10 mL缓冲液(pH=10)、2滴EBT,用EDTA标准液滴定至蓝色,记录消耗的EDTA的体积。实验平行三次。
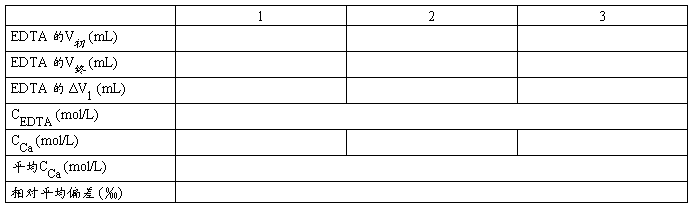
四、数据处理及表格
CaCO3的质量与浓度
m1= m2= mCaCO3= n(Ca2+) =

分析化学实验五
铋铅含量的连续测定(考核)
(p128-129)
一、实验目的
1、了解由调节酸度提高EDTA选择性原理
2、掌握用EDTA进行连续滴定的方法
二、实验原理
 Bi+Y BiY lgKBiY=27.94
Bi+Y BiY lgKBiY=27.94
 Pb+Y PbY lgKPbY=18.04
Pb+Y PbY lgKPbY=18.04
LgKBiY - LgKPbY = 9.90 ≥ 6
所以可在pH=1和pH=5~6时分别滴定Bi3+和Pb2+ 。

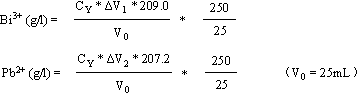
三、实验步骤
1、准确移取未知溶液25.00 mL于250 mL容量瓶中,加水稀释至2/3处摇匀,继续稀释至近刻度线,定容,摇匀备用。
2、从容量瓶中移取25.00 mL溶液于锥形瓶中,加4滴二甲酚橙指示剂和10 mL 硝酸(0.1mol/L),摇匀。
3、用EDTA进行滴定,锥形瓶中的溶液由玫瑰红变亮黄色,记录ΔV1。
4、向锥形瓶中滴加六亚甲基四胺溶液至待测液成稳定的紫红色后,再加入六亚甲基四胺溶液5 mL,继续用EDTA溶液滴定至再次出现黄色为终点,记录ΔV2。
5、步骤2-4平行实验三次。
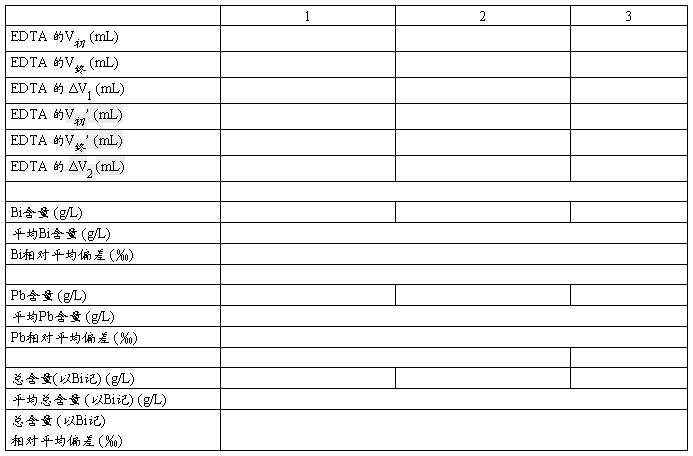
四、数据处理及表格
未知样品编号:
分析化学实验六
补钙制剂中钙含量的测定
一、实验目的
1、学习络合滴定法的原理和应用
2、进一步学习和掌握配位滴定的方法和操作
二、实验原理
MgY-EBT指示剂原理。
Ca2+ + Y = CaY (pH=10)
三、实验步骤
1、MgY-EBT指示剂的配制
向250 mL的锥形瓶中加入:1 mL MgCL2、10 mL缓冲液(pH=10)、2滴EBT,用EDTA标准液滴定至蓝色,平分三份。
2、葡萄糖酸钙口服液中Ca含量的测定
将10 mL口服液转移至容量瓶中,定容摇匀备用,准确移取25.00 mL至含有指示剂的锥形瓶中,再加入10mL缓冲液(pH=10)、2滴EBT,用EDTA标准液滴定至蓝色,记录消耗的EDTA的体积。实验平行三次。
四、数据处理及表格
五、下周实验准备:
高锰酸钾溶液的配制(0.02 mol/L) (p196)
称1.6 g高锰酸钾固体溶于水中(约700 mL)加热煮沸1 h,剩余溶液体积约为500 mL,冷却后用玻璃三角漏斗和石棉过滤,滤液贮存于棕色试剂瓶中。
分析化学实验七
高锰酸钾溶液的配制和标定
(P135-137)
一、实验目的
1、掌握高锰酸钾溶液的配制和标定过程。
2、对自动催化反应有所了解。
3、对高锰酸钾自身指示剂的特点有所体会。
二、 实验原理
实验原理
2MnO4- + 5C2O4 + 16H+ = 2Mn2+ + 10CO2 + 8H2O
因为高锰酸钾是紫红色,Mn2+几乎无色,所以高锰酸钾自身可作指示剂。
氧化还原反应速度慢,可提高酸度、升高温度80~90 度,也可以加入Mn2+催化。
注:加热注意控温,因为草酸钠加热会分解成二氧化碳、一氧化碳和水,使结果偏高。
三、实验步骤
1、高锰酸钾溶液的配制(0.02 mol/L)提前一周配制
称1.6 g高锰酸钾固体溶于水中(约700 mL)加热煮沸1 h,剩余溶液体积约为500 mL,冷却后用玻璃三角漏斗和玻璃棉过滤,滤液贮存于棕色试剂瓶中。
2、高锰酸钾溶液的标定
准确秤取基准物质草酸钠0.16~0.18 g,置于锥形瓶中,加入50 mL蒸馏水溶解,加入3mol/L硫酸15 mL,用煤气灯上垫石棉网加热到约80~90度,趁热用高锰酸钾溶液滴定,开始滴定的速度要慢,待有Mn2+生成后,可适当加快滴定速度,滴至溶液呈微红色,半分钟不退色即为终点,记录消耗的高锰酸钾溶液的体积。平行实验三次。
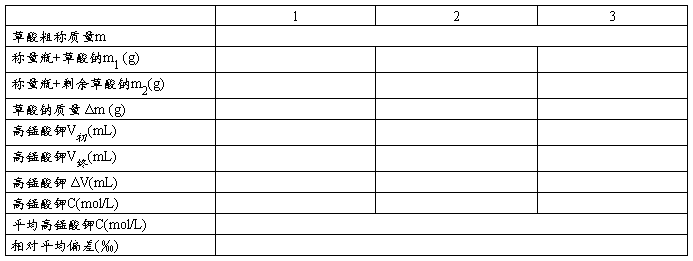
四、数据处理
草酸钠分子量134.0
分析化学实验八
水样中化学耗氧量(COD)的测定(KMnO4法)
(P137-139)
一、实验目的
1、了解水中化学耗氧量对水体污染的关系
2、掌握高锰酸钾法测定水中化学耗氧量的原理和方法
二、 实验原理
实验原理
4MnO4- + 5C + 12H+ = 4Mn2+ + 5CO2 +6H2O
 2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
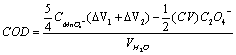 VH2O为水样体积
VH2O为水样体积
三、实验步骤
1、高锰酸钾标液的配制
准确移取实验七中已标定的高锰酸钾溶液25.00 mL到250 mL的容量瓶中,稀释定容摇匀备用。
2、河水水样的测定
准确移取水样50.00 mL于锥形瓶中,加入8 mL硫酸(1+3),用酸式滴定管放出约10 mL的高锰酸钾,并记录体积为ΔV1,加沸石,用煤气灯垫石棉网加热煮沸并小火保温10 min,此时溶液应为红色。若红色褪去,补加高锰酸钾溶液再加热呈稳定红色为止(在水样污染程度较大的情况下需补加)。
趁热加入10 mL草酸钠溶液 (0.005 mol/L),摇匀,溶液褪成无色,用高锰酸钾溶液滴定至微红,半分钟内不褪色为终点,记录消耗的高锰酸钾溶液的体积为V2。
平行实验三次。
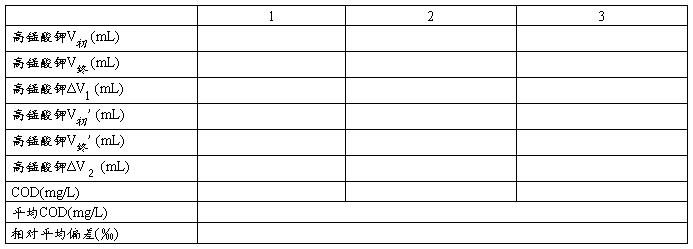
四、数据处理
高锰酸钾溶液的浓度C =
五、下周实验准备:
硫代硫酸钠溶液溶液的配制
将 750 mL的蒸馏水煮沸冷却,台秤秤取12.5 g的Na2S2O3×5H2O,用煮沸冷却的蒸馏水溶解稀释到500 mL,贮存于1 L的棕色瓶中,加入0.1 g的Na2CO3固体,使溶解,保存备用。
分析化学实验九
硫代硫酸钠溶液的配制与标定
(p142-145)
一、实验目的
1、掌握硫代硫酸钠溶液的配制与标定要点
2、了解淀粉指示剂的作用原理
二、实验原理
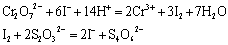
I2遇淀粉变蓝,可用淀粉做指示剂
三、实验步骤
1、硫代硫酸钠溶液溶液的配制(提前一周配制)
将 750 mL的蒸馏水煮沸冷却,台秤秤取12.5 g的Na2S2O3×5H2O,用煮沸冷却的蒸馏水溶解稀释到500 mL,贮存于1 L的棕色瓶中,加入0.1 g的Na2CO3固体,使溶解,保存备用。
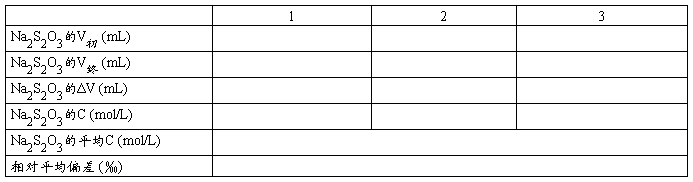
2、准确秤取基准物质重铬酸钾1.2 g左右,在小烧杯中溶解,定量转移至250 mL的容量瓶中,稀释定容摇匀备用。
3、准确移取25.00 mL的重铬酸钾标准溶液于碘量瓶中,加入12 mL 硫酸(3 mol/L),加入碘化钾固体1 g,溶解后置于暗室中5 min,取出用蒸馏水淋洗碘量瓶的盖子和内壁,加水至总体积约150 mL,用硫代硫酸钠溶液滴定至草绿色(蓝色+淡黄色),加入1 mL淀粉指示剂(0.5%),继续滴定至蓝紫色消失为止,溶液最后清亮浅蓝绿色。平行实验三次。
四、数据处理
称量瓶+重铬酸钾m1 = 称量瓶+剩余重铬酸钾m2 =
重铬酸钾m = 重铬酸钾C =
分析化学实验十
铜合金中铜含量的测定(考核)
(P142-145)
一、实验目的
1、了解间接碘量法测定铜的原理
2、学习铜合金试样的分解方法
3、掌握以碘量法测铜的操作过程
二、实验原理
 2Cu2+ +4I- = 2CuI +I2
2Cu2+ +4I- = 2CuI +I2
I2 +2S2O3 = 2I- + S4O62-
 CuI +SCN-=CuSCN + I-
CuI +SCN-=CuSCN + I-
注:KSCN在近终点时加入
NH4HF2掩蔽Fe3+,调控pH=3.0~4.0之间
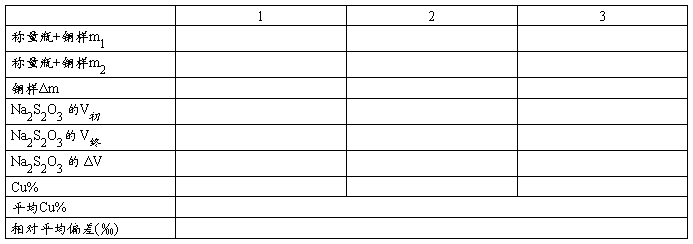
三、实验步骤
1、准确秤取铜样0.20~0.30g,置于碘量瓶中,加入10 mL的HCl(1+1),滴加2 mL H2O2,小火加热至铜样完全分解,继续加热促使H2O2完全分解,以密集气泡平静后再次出现大气泡为无H2O2的标志。冷却溶液,切勿盖塞子。
2、在冷却后,滴加氨水(1+1)至浅蓝色沉淀刚生成(注:滴加速度要慢,否则易生成蓝色铜氨络离子不出现沉淀),再加入10 mL的HAc(1+1),10 mL NH4HF2溶液。加入1 g碘化钾固体,溶解后置于暗室5 min。
3、用Na2S2O3标准溶液滴定上述溶液至浅黄色,再加入3 mL淀粉指示剂,继续滴定至浅蓝色,加入10 mL的KSCN溶液(10%),振荡后再滴定至蓝紫色络合物消失,终点溶液呈混浊的乳白色或奶茶色,记录消耗的Na2S2O3的体积。
四、数据处理
分析化学实验十一
邻二氮菲吸光光度法测定铁(考核)
(P173-174)
一、实验目的
1、学习如何选择吸光光度法的实验条件
2、掌握用吸光光度法测定铁的原理和方法
3、掌握分光度计和吸量管的使用方法
二、实验原理
在pH=2~9
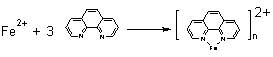 n=3 络合物呈现橘红色
n=3 络合物呈现橘红色
当有Fe3+存在时, 需要将Fe3+还原为Fe2+:
2Fe3+ + 2NH2OH·HCl = 2Fe2+ + N2 + 4H+ +2H2O +2Cl-
三、实验步骤
1、标准系列溶液的配制
在编号1~6的50 mL容量瓶中,分别准确移取0.00, 0.20, 0.40, 0.60, 0.80, 1.00 mL标准Fe3+溶液(0.1mg/mL),加入1.00 mL盐酸羟胺(10%),振荡2 min后,加入2.00 mL邻二氮菲溶液,再加入5.00 mL的NaAc溶液,用水稀释,定容摇匀备用。
2、未知样品的配制
在50mL的容量瓶中,准确移取1.00 mL的未知铁样品,加入1.00mL盐酸羟胺(10%),振荡2 min后,加入2.00 mL邻二氮菲溶液,再加入20.00 mL的NaAc溶液,用水稀释,定容摇匀备用。
3、最大吸收波长的测定
取1、5号标液,以1号标液为参比溶液(reference),5号溶液为被测样品(sample),依照分光光度计的操作规程,在650~400 nm间扫出最大吸收波长,并记录λmax。
4、工作曲线的测定
在最大吸收波长下,以1号溶液为参比,测各浓度标铁溶液的吸光度A。以浓度C为x轴,以吸光度A为y轴,在坐标纸上绘标准工作曲线。
在最大吸收波长下,以1号溶液为参比,测未知铁溶液的吸光度A,在工作曲线上查出其浓度。
四、数据处理
样品编号: λmax=

未知样品的原始浓度: (mg/L)
分析化学实验十二
茶饮料中茶多酚含量的测定
一、实验目的
1、学习掌握用吸光光度法测定物质的原理和方法
2、学习用酒石酸比色法测定茶多酚类物质的方法
二、实验原理
1、在一定pH条件下,酒石酸铁与茶多酚类物质形成蓝紫色或红紫色络合物,在λ=540nm处比色。
2、在适当酸度范围内,茶多酚的量与显色的深浅成正比关系,可用分光光度法测定其浓度。
三、实验步骤
1、酒石酸亚铁溶液的配制
准确秤取FeSO4·7H2O固体0.1150 g ~ 0.1250 g,酒石酸钾钠0.6250 g ~ 0.6350 g,蒸馏水溶解后定量转移至500 mL的容量瓶中,蒸馏水稀释定容摇匀备用。
2、茶多酚溶液的配制
准确秤取茶多酚0.2450 g ~ 0.2550 g,蒸馏水溶解,定量转移至250 mL的容量瓶中,蒸馏水稀释定容摇匀备用。
3、pH=7.5的缓冲溶液配制
台秤秤取6.0 g的Na2HPO4和0.2 g的KH2PO4,用蒸馏水溶解,在烧杯中稀释到300 mL。
4、标准工作曲线的绘制
在编号1~6的50 mL容量瓶中,分别准确移取0.00, 0.40, 0.80, 1.20, 1.60, 2.00 mL的茶多酚标液,加8 mL蒸馏水,10.00 mL的酒石酸亚铁溶液,再用pH=7.5的缓冲溶液稀释到刻度,摇匀备用。
取1、5号标液,以1号标液为参比溶液(reference),5号溶液为被测样品(sampLe),依照分光光度计的操作规程,在650~400 nm间扫出最大吸收波长,并记录λmax。
在最大吸收波长下,以1号溶液为参比,测各浓度茶多酚溶液的吸光度A。以浓度C为x轴,以吸光度A为y轴,在坐标纸上绘标准工作曲线。
5、茶饮料中茶多酚含量的测定
在50 mL容量瓶中,准确移取8.00 mL的茶饮料,加8 mL蒸馏水,10.00 mL的酒石酸亚铁溶液,再用pH=7.5的缓冲溶液稀释到刻度,摇匀备用。
在最大吸收波长下,以1号溶液为参比,测茶饮料溶液的吸光度A。在工作曲线上查出其茶多酚的浓度。
四、数据处理
FeSO4·7H2O质量: 酒石酸钾钠质量:
茶多酚质量: 茶饮料中茶多酚的浓度: (mg/L)
λmax=

