实验二、常压蒸馏和沸点的测定
一、实验目的
了解沸点测定的意义;掌握蒸馏法及微量法测定沸点的原理和方法。
二、基本原理
液态物质受热,由于分子运动使其从液体表面逃逸出来,形成蒸气压;随着温度升高,蒸气压加大,当蒸气压和大气压相等时,液体沸腾,此时的温度即为该液体的沸点;每一种纯液态有机化合物在一定压力下均具有固定的沸点。
蒸馏就是将液态物质加热至沸腾变为蒸气,然后将蒸气移到别处,再使蒸气冷凝变为液体的一种操作过程。
蒸馏的原理是利用物质中各组分的沸点差别(相差大于30℃)而将各组分分离。
三、实验步骤演示
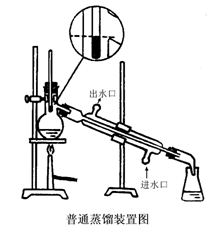
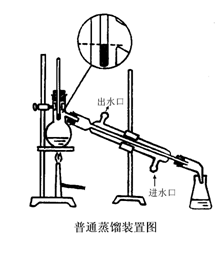
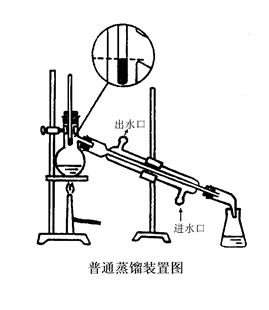
1、蒸馏装置及安装
水银球的上缘位于蒸馏烧瓶支管接
口的下缘,使他们在同一水平线上
沸点低于130 ℃
常用蒸馏装置
2、 蒸馏操作
加料:不纯乙醇30 mL及沸石数颗;
加热:先通水再加热;蒸馏速度1-2滴/S;
观察沸点及收集馏液:维持原有温度不再有馏出液蒸出而温度又突然下降时,就应停止蒸馏;
蒸馏完毕,先停止加热再停止通水,拆卸仪器,其程序与装配时相反。
纯粹液体的沸程一般不超过1-2℃。液体的沸程常一定程度上代表它的纯度。
本实验用不纯乙醇30 mL,放在60 mL圆底烧瓶中蒸馏,并测定沸点。
四、实验注意事项
1、 温度计的位置应恰当。
2、 不要忘记加沸石。如果忘记,应使沸腾的液体冷却至沸点以下后才能加入沸石。
3、 有机溶剂均应用小口接受器。
4、 系统要与大气相通,否则造成封闭体系,引起爆炸事故。
五、应用
1、分离液体混合物;
2、测定化合物的沸点;
3、提纯除去不挥发性杂质;
4、回收溶剂或者蒸出部分溶剂以浓缩溶液;
第二篇:有机化学实验三蒸馏及沸点的测定
实验三 蒸馏及沸点的测定
一. 实验目的:
(1)了解测定沸点和蒸馏的意义;
(2)掌握蒸馏法测定沸点的原理和操作方法;
(3)掌握微量法测定沸点的原理和方法;
二. 实验重点和难点:
(1) 蒸馏和沸点的意义;
(2) 微量法和常量法测定沸点的原理和方法;
实验类型:基础性 实验学时:4学时
三. 实验装置和药品:
主要实验仪器:温度计 沸点管 毛细管 Thiele管(即b形管)
酒精灯 液体石蜡 温度计 蒸馏烧瓶 直形冷凝管
接液管 锥形瓶 沸石
主要化学试剂:95%乙醇(化学纯,b.p78.5) 乙酸(化学级,b.p117.9)
酒精(工业级,b.p78.2)
四. 实验装置图:


微量法沸点测定管

五. 实验原理:
1. 定义:
液体受热时,其蒸气压升高。当蒸气压达到与外界压力相等时,液体沸腾。此时的温度称为该化合物在此压力下的沸点。
2. 测定沸点的原理:
所谓蒸馏就是将液态物质加热到沸腾变为蒸气,又将蒸气冷凝为液体这两个过程的联合操作。
利用蒸馏可将沸点相差较大(如相差300C)的液态混合物分开。
液体的分子由于分子运动有从表面逸出的倾向,这种倾向随着温度的升高而增大,进而在液面上部形成蒸气。当分子由液体逸出的速度与分子由蒸气中回到液体中的速度相等,液面上的蒸气达到饱和,称为饱和蒸气。它对液面所施加的压力称为饱和蒸气压。实验证明,液体的蒸气压只与温度有关。即液体在一定温度下具有一定的蒸气压。
当液体的蒸气压增大到与外界施于液面的总压力(通常是大气压力)相等时,就有大量气泡从液体内部逸出,即液体沸腾。这时的温度称为液体的沸点。
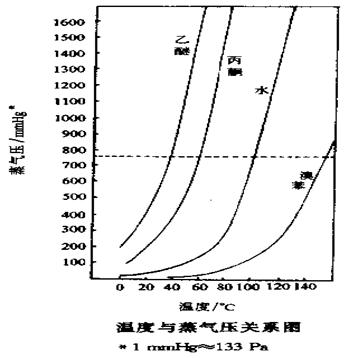
纯粹的液体有机化合物在一定的压力下具有一定的沸点(沸程0.5-1.5 oC)。利用这一点,我们可以测定纯液体有机物的沸点。又称常量法。
但是具有固定沸点的液体不一定都是纯粹的化合物,因为某些有机化合物常和其它组分形成二元或三元共沸混合物,它们也有一定的沸点。
蒸馏是将液体有机物加热到沸腾状态,使液体变成蒸汽,又将蒸汽冷凝为液体的过程。
通过蒸馏可除去不挥发性杂质,可分离沸点差大于30 oC的液体混合物,还可以测定纯液体有机物的沸点及定性检验液体有机物的纯度。1. 纯净的液体有机物在一定压力下具有固定的沸点。沸点是液体有机化合物的物理常数之一,因此通过测定沸点可以鉴别有机化合物并判断其纯度。 利用蒸馏可将沸点相差较大(如相差30℃)的液体混合物分开。液体混合物加热后沸点较低者先蒸出、沸点较高者随后蒸出、不挥发的留在蒸馏瓶内,这样可以达到分离提纯的目的。
将一支毛细管一端封口,一端开口向下插入到盛有待测液体的沸点管中。在最初受热时,毛细管内的空气受热膨胀逸出毛细管外,形成小气泡。继续加热,若液体受热温度超过其沸点时,此时毛细管内的蒸气压大于外界施于液面总压力,则有一连串气泡逸出。此时停止加热,毛细管内的蒸气压会降低、气泡减少。当气泡不再冒出,而液体将要压进毛细管内的瞬间,此刻毛细管内的待测液体的蒸气压与外界压力正好相等,所测的温度即为该液体的沸点。
六. 实验內容:
1. 微量法:
(1)装样:将待测样品装入沸点管中,使液柱高约1cm。将一端封闭的毛细管开口向下插入液体中(如图1所示)。把沸点管用橡皮圈系于温度计上,插入盛有硫酸(或液体石蜡)的Thiele管中,勿使橡皮圈触到硫酸。放入浴中加热。
(2)加热:按熔点测定方法一样加热。加热时,由于气体膨胀,內管中会有小气泡缓缓逸出,在到达该液体的沸点时,将有一连串的小气泡快速地逸出。此时可停止加热,使浴温自行下降,气泡逸出的速度即渐渐减慢。
(3)记录数据:当气泡恰要停止逸出而液体将要缩入毛细管内的瞬间,表示毛细管內的蒸气奈与外界奈力相等,此时记录下温度计上所示温度,即为沸点。待温度下降20-30oC,重新加热再测一次,两次测定数据不应超出l-2oC。
2.蒸馏法:(常量法)
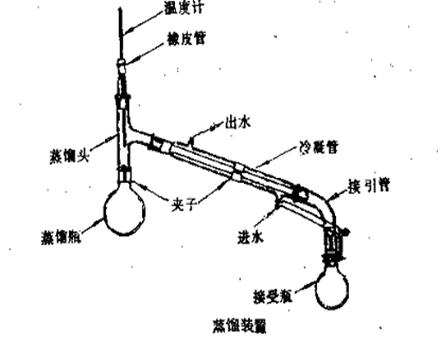
(1) 安装蒸馏装置:【参见教材P76图3.5】实验室的蒸馏装置
主要包括三个部分:蒸馏烧瓶(包括温度计);冷凝管;接受器(包括接液管和接受瓶)。
安装仪器一般原则:自下而上,从左到右。要准确端正,横平竖自。无论从正面或侧面观察,全套仪器装置的轴线都要在同一平面內。铁架应整齐地置于仪器的背面。也可将安装仪器概括为四个字:即稳,妥,端,正。稳,即稳固牢靠;妥,即妥善安装。消除一切不安全因素;端,即端正好看,同时给人以美的享受;正,即正确地使用和选用仪器。
(2) 加料:将待蒸馏液通过玻璃漏斗小心倒入蒸馏瓶中,要注意不使液体从支管流出。加入几粒沸石,塞好带温度计的塞子。再一次检查仪器的各部分连接是否紧密和妥善。
(3) 加热:首先接通冷凝管中的水,冷凝水由下口进上口出,然后加热。控制好加热温度,调节蒸馏速度,通常以每秒1—2滴为宜。在整个蒸馏过程中,应使温度计水银球上常有被冷凝的液滴。此时的温度即为液体与蒸气平衡时的温度。温度计的读数就是液体(馏出物)的沸点。
蒸馏时加热的火焰不能太大,否则会在蒸馏瓶的颈部造成过热现象,使一部分液体的蒸气直接受到火焰的热量,这样一来由温度计读得的沸点会偏高;另一方面,蒸馏也不能进行得太慢。否则由于温度计的水银球不能为馏出液蒸气充分浸润而使温度计上所读得的沸点会偏低或不规则。
(4) 观察沸点和收集馏液:
(5) 蒸馏结束:
七. 实验注意事项:
(1) 认真仔细地观察实验情况和现象;
(2) 注意蒸馏装置的安装原则和操作要
(3) 掌握好气泡停止逸出而液体将要缩入毛细管内的瞬间;
(4) 注意管内液体的高度;
(5) 冷却水流速以能保证蒸汽充分冷凝为宜,通常只需保持缓缓水流即可。
(6) 蒸馏有机溶剂均应用小口接收器,如锥形瓶。
八. 实验相关內容:
沸点也是有机物的重要物理常数。可以借助蒸馏操作测定有机物的沸点,也可以用微量法测定沸点。用蒸馏法测定沸点需要较多的试样,微量法仅需数滴试样即可进行测定。
蒸馏瓶:蒸馏瓶的选用与被蒸液体量的多少有关,通常装入液体的体积应为蒸馏瓶容积1/3-2/3。液体量过多或过少都不宜。(为什么)?在蒸馏低沸点液体时,选用长颈蒸馏瓶;而蒸馏高沸点液体时,选用短颈蒸馏瓶。
温度计:温度计应根据被蒸馏液体的沸点来选,低于100oC,可选用100oC温度计;高于100oC,应选用250-300oC水银温度计。
冷凝管:冷凝管可分为水冷凝管和空气冷凝管两类,水冷凝管用于被蒸液体沸点低于140 oC;空气冷凝管用于被蒸液体沸点高于140 oC(为什么)。
尾接管及接收瓶:尾接管将冷凝液导入接收瓶中。常压蒸馏选用锥形瓶为接收瓶,减压蒸馏选用圆底烧瓶为接收瓶。
蒸馏操作是有机化学实验中常用的实验技术,一般用于下列几个方面:
1. 分离液体混合物:仅限混合物中各成分的沸点有教大的差别时才能有效的分离。
2. 测定化合物的沸点:
3. 提纯,除去不挥发的杂质:
4. 回收溶剂,或蒸出部分溶剂以浓缩溶液。
九. 思考题:
1. 为什么把最后一个气泡刚欲缩回至內管的瞬间的温度作为该化合物的沸点?
2. 什么是沸点? 液体的沸点和大气压有什么关系? 文献里记载的某物质的沸点是否即为你们那里的沸点温度?
3. 蒸馏时为什么蒸馏瓶所盛液体的量不应超过容积的2/3也不应少于1/3?
4. 蒸馏时加入沸石的作用是什么? 如果蒸馏前忘记加沸石,能否立即将沸石加至将近沸腾的液体中?当重新蒸馏时,用过的沸石能否继续使用?
5. 为什么蒸馏时最好控制馏出液的速度为1--2滴/s为宜?
6.蒸馏时加热的快慢,对实验结果有何影响?为什么?
7..在蒸馏装置中,温度计水银球的位置不符合要求会带来什么结果?
8.如果液体具有恒定的沸点,那么能否认为它是单纯物质?
