水中钙镁含量的测定实验报告
试验时间:2014.04.11 报告人:武伟
一、 目的要求
1. 掌握配位滴定的基本原理,方法和计算。
2. 掌握铬黑T、钙指示剂的使用条件和终点变化。
二、 实验原理
用EDTA测定水中钙镁含量时,通常在两个等分溶液中分别测定钙及钙镁的总量,镁的含量则从两者所用EDTA的差值求出。(详细原理见预习报告)
三、 实验用品
6 mol/L氢氧化钠,N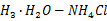 缓冲溶液,铬黑T试剂,钙指示剂,滴定管,25 mL移液管,锥形瓶6个
缓冲溶液,铬黑T试剂,钙指示剂,滴定管,25 mL移液管,锥形瓶6个
四、 实验内容
i. 实验步骤
1. 取6个锥形瓶,洗净,用蒸馏水润洗,向每个锥形瓶里加入100 mL蒸馏水。
2. 取其中三个用来测定钙含量,向其中加入2 mL 6 mol/L氢氧化钠和5滴钙指示剂,溶液变成酒红色,用EDTA滴定至溶液变成纯蓝色,记下EDTA的用量。
3. 剩余三个用来测定钙镁的总含量,向其中加入5 mL N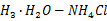 缓冲溶液,三滴,铬黑T试剂,也是用EDTA滴定至溶液由酒红色变成纯蓝色。
缓冲溶液,三滴,铬黑T试剂,也是用EDTA滴定至溶液由酒红色变成纯蓝色。
ii. 数据处理
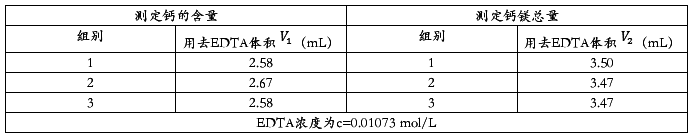
对数据进行离群检验得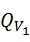 =
=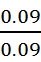 =1
=1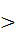 0.94,所以应该舍去
0.94,所以应该舍去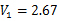 和
和 =3.50
=3.50
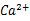 含量=
含量=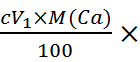 1000
1000
 =
=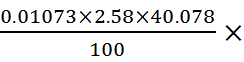 1000 mg/L=11.09 mg/L
1000 mg/L=11.09 mg/L
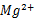 含量=
含量=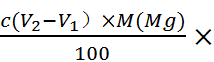 1000
1000
 =
=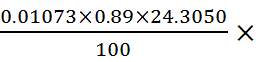 1000 mg/L=2.3211 mg/L
1000 mg/L=2.3211 mg/L
CaC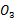 含量=
含量=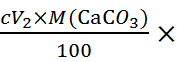 1000
1000
=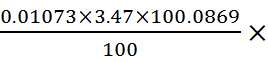 1000 mg/L=37.27 mg/L
1000 mg/L=37.27 mg/L
五、 思考题
1. 如果只有铬黑T指示剂,能不能测定钙离子的含量?如何测定?
答:能;先调节溶液的pH使镁离子沉淀,然后过滤除去,这样溶液中就只剩下钙离子,就可以去测定了。
2. 钙离子、镁离子与EDTA的配合物,那个更稳定?为什么滴定镁离子时要控制pH=10,而钙离子要控制pH=12~13?
答:钙离子和EDTA的配合物更稳定;前者是因为铬黑T只有在这个pH范围是才有作用,后者是为了先使溶液中的镁离子生成沉淀。
3. 测定的水样中若含有少量铁离子,铜离子时,对终点有什么影响?如何消除其影响?
答:使到达终点时,EDTA的用量偏大;先通过调节pH的方法将其除去。
六、 心得体会
我能吐槽那个用25 mL连续取用4*6=24次自来水的操作吗?为什么不生产一个大一点的移液管?取到我头晕,取着取着我就忘了取了几次,就和其它的比一比,感觉差不多,行了。有的瓶壁厚一点,就取的液面高一点。不过我已经准备好了对付万一出现差错的办法啦,办法如下:
及时忘记了到底取了几次,我也可以确定答案肯定在3、4、5之中,因为一次两次是很容易记得的,即使不记得,也可以用这种方法处理。然后用正确的滴定方法进行滴定,每次用去的EDTA去和确定的有100 mL蒸馏水的试样进行对比,接近  是滴入75 mL蒸馏水的,
是滴入75 mL蒸馏水的, 是滴入125 mL的。因为各个锥形瓶中的蒸馏水都是25 mL的倍数,所以必然会有唯一一个最接近的比例,通过换算就可以得到加入蒸馏水的量。
是滴入125 mL的。因为各个锥形瓶中的蒸馏水都是25 mL的倍数,所以必然会有唯一一个最接近的比例,通过换算就可以得到加入蒸馏水的量。
还有,没想到锥形瓶的刻度是那么的不准,太离谱了,
第二篇:水中溶解氧测定实验报告
水中溶解氧测定实验报告
周然
指导教师:任学宝
日期:20xx年2月13日
实验目的:1、测定水中溶解的氧气的量,了解水体的基本状况。
2、掌握基本的实验方法和实验技巧。
实验原理:利用水中溶解氧氧化Mn2+后用I-还原,然后用碘量法滴定生成的碘。 有关化学方程式: 2Mn2+ + 2OH— + O2 === 2MnO(OH)2↓ MnO(OH)2 + 4H+ + 2I— === Mn2+ + I2 + 3H2O
I2 + 2 Na2S2O3 === Na2S4O6 + 2NaI
实验仪器和药品:
仪器:铁架台(铁夹)、酒精灯、石棉网、烧杯、锥形瓶、酸式滴定管、碱式滴定管、铁圈、
滴定管夹、试剂瓶、漏斗、滤纸、玻璃棒、容量瓶、精密天平、25ml量筒 固体:MnSO4、KIO3、Na2S2O3、NaI、可溶性淀粉
溶液:6mol/LNaOH、1mol/LHCl、新鲜水样(取水日期:20xx年2月11日下午) 实验准备:
1、 配制溶液。
MnSO4:称取药品1.000克,用250ml容量瓶配制,转移至试剂瓶。
KIO3:准确称取药品0.4280克,用250ml容量瓶配制成0.008000mol/L的溶液,转移。
Na2S2O3:称取药品1.000克,用500ml容量瓶配制,转移。
可溶性淀粉:用大烧杯盛半杯蒸馏水,煮沸,再在小烧杯中用蒸馏水溶解淀粉成糊状,并搅拌均匀,在大烧杯煮沸时加入,搅拌均匀后冷却。 NaI:在大烧杯中加入药品,加蒸馏水配制成溶液。
2、 标定Na2S2O3浓度。
用量筒量取一定量KIO3 标准溶液,加入过量NaI和HCl,然后加入几滴淀粉溶液,用Na2S2O3滴定,记录消耗的Na2S2O3体积,重复一次。 3、 取新鲜水样100ml ,过滤,转移至锥形瓶,加盖静置。 实验步骤:
1、取过滤好的新鲜水样25ml,加入NaOH和过量MnSO4,静置。
2、待溶液不再变色,加入HCl和过量NaI,振荡后静置。
3、加入少量淀粉溶液后用Na2S2O3滴定。
实验数据:
实验现象:
加入NaOH后再加入MnSO4,溶液颜色逐渐变黄,出现沉淀。 加入HCl和NaI后,溶液颜色逐渐加深,变成棕黄色。
加入淀粉后溶液变蓝,滴定至终点后溶液呈无色。
1、测定Na2S2O3浓度:
次数 KIO3溶液体积(ml) 消耗Na2S2O3体积(ml) Na2S2O3浓度(mol/L) 1 10.0 33.8 0.01420
2 5.00 15.6 0.01538
平均值:0.01479 mol/L
注:IO3— + 5I— + 6H+ === 3I2 + 3H2O
I2 + 2 Na2S2O3 === Na2S4O6 + 2NaI
*Na2S2O3浓度 = KIO3体积 × KIO3浓度 × 6 / Na2S2O3体积
2、测定水中溶解氧:
水样来源 滴定时的读数(ml) 消耗Na2S2O3体积(ml) 水中溶解氧的浓度(mg/L) 平均值(mg/L)
开始 结束
贴沙河 1 0.00 14.8 14.8 2.189 2.234
2 20.0 35.4 15.4 2.278
西 湖 1 2.00 12.4 10.4 1.538 1.516
2 24.1 34.2 10.1 1.494
京 杭
运 河 1 0.00 12.5 12.5 1.849 1.783
2 12.5 24.1 11.6 1.716
*水中溶解氧的浓度 = Na2S2O3体积 × Na2S2O3浓度 / 4 / 水样体积 数据分析:
由实验结果可知,贴沙河的水质较西湖与京杭运河的水质好,但根据国家关于此方面的规定来看,贴沙河的水处于Ⅳ与Ⅴ类水之间,西湖和京杭运河的水在Ⅴ类水之下。这些数据表明,虽然与前几年臭气熏天的情况相比要好得多,但仍不容乐观。就实地观察,京杭运河的水最脏,而西湖水较好,但由于西湖内的含氧量与COD相近,因此鱼类较多,而京杭运河富营养化污染严重,水中含氧量远低于COD值,鱼类等生物难以生存,水中含氧量就高于西湖水。另外,取水时因条件限制均取表层水,因此测得的值可能较实际深层水的值大。对于这三个地方的水,都有一定程度的富营养化污染。要治理这些污染,笔者认为首先应该制止向水中排放污水和钓鱼、洗衣等行为,去除水下的淤泥,向水中加入一些植物以吸收氮、磷等营养元素,制止微生物的过分繁殖。
对照国家标准,西湖作为风景点水质已基本达标,但贴沙河作为杭州自来水的水源,其水质还偏差。为了使杭州的水重新干净起来,让我们大家一起来爱护杭州的水资源。
