神经体液对动脉血压和呼吸运动的调节
[目的要求]
1.学习直接测定家兔动脉血压的急性实验方法。
2.观察神经、体液因素对心血管活动的影响。
[基本原理]
在正常生理情况下,人和高等动物的动脉血压是相对稳定的。这种相对稳定性是通过神经和体液因素的调节而实现的,其中以颈动脉窦—主动脉弓压力感受性反射尤为重要。此反射既可使升高的血压下降,又可使降低的血压升高,故有血压缓冲反射之称谓。家兔的主动脉神经在解剖上独成一支,易于分离与观察其作用。
本实验是应用液导系统直接测定动脉血压。即由动脉插管与压力传感器连通,其内充满抗凝液体,构成液导系统,将动脉插管插入动脉内,动脉内的压力及其变化,可通过封闭的液导系统传递到压力传感器,并由计算机采集系统记录下来。
[动物与器材]
家兔、兔手术台、常用手术器械、止血钳(4~6把)、眼科剪、支架、双凹夹、气管插管、动脉插管、三通管、动脉夹、计算机采集系统、压力传感器、保护电极、照明灯、纱布、棉球、丝线、注射器 (1 ml、5 ml、20 m1)、生理盐水、4%柠檬酸钠、20%~25%氨基甲酸乙酯、肝素(200 U/ml)、肾上腺素(1:5 000)、乙酰胆碱(1:10 000)。
[方法与步骤]
1.实验仪器的准备
打开计算机采集系统,接通压力传感器。从显示器的“实验项目”中找出“循环实验”的“家兔血压的调节”条,使显示器显示压力读数。
2.连通液导系统并制压
将压力传感器的下方支管,通过输液管连接三通管,再连接动脉插管。上侧管供制压时排除管内空气使用。先用装有20ml 4%柠檬酸钠的注射器,通过三通管向连接动脉插管的输液管内推注,使之充满液体(不要使动脉插管高过压力传感器的上方支管)后,再用止血钳夹住动脉插管端的输液管。然后继续向三通管内推注,直至充满压力传感器的上方支管,并用塞子塞住(注意:液导系统内不可有气泡)。继续向三通管内推注,同时观察显示器上压力变化。当加压到120 mmHg时即可关闭三通管。观察压力是否发生变化,如果压力下降,则需要检查液导系统的漏液原因,并重新制压。调节血压显示器的灵敏度,使30~130 mmHg的变化都能在显示器上明显地反映出来。将动脉插管端的导管内充满肝素溶液。
3.动物的准备
1)麻醉动物
取家兔一只,称重并剪去耳缘静脉上的被毛。用20ml注射器由耳缘静脉缓慢推注20%(或25%)氨基甲酸乙酯(5ml/kg体重)进行麻醉。注射时注意:先从耳缘静脉尽可能远心端注射(第一次注射不成功时,可稍向近心一些注射),注射时速度要慢,并随时观察动物情况。当动物四肢松软、呼吸变深变慢、角膜反射迟钝时,表明动物已被麻醉,即可停止注射。
2)固定与剪毛
将动物背位固定于手术台上,用剪毛剪将颈部手术野的被毛剪去,即可进行手术。
3)切开皮肤
术者一手的拇指和示指按住家兔颈部两侧,另一手持手术刀,在紧靠喉头下缘,沿颈部正中线作一长约5~7cm的皮肤切口。然后用止血钳或手术剪分离皮下结缔组织后,夹住少许皮肤并向两侧分开创口。
4)分层分离肌肉及气管插管
术者与助手分别持止血钳轻轻提起少许气管正上方的肌肉(距离要尽可能近),然后用手术剪在两止血钳夹住的肌肉之间,纵向(沿肌肉纤维走向)将肌肉层剪开一个小口(亦可用止血钳创开口)。用剪刀或止血钳将创口纵向扩大,再用止血钳夹住少许肌肉,向两侧分开肌层。继续用两把止血钳夹住下层气管上方的少许肌肉,轻轻提起,同法剪开并扩大肌肉创口。如此层层分离肌肉,直至看见肌肉层下方的气管(如果创口不够大,亦可用两手示指深入创口后再向前后方撕裂肌膜,使创口扩大)。用止血钳向气管两侧拉开最后一层肌肉,暴露出气管,再进行气管插管:将气管与周围组织钝性分离,在气管上做一“⊥”形切口,插入“Y”形气管套管,并用线将气管套管结扎固定。手术时,注意切口不可偏离气管上方,不可横向剪断肌肉,以免造成血管断裂而出血。切口也不要过于扩大,以免造成气胸。如果发现肌肉或血管有少量出血,可用浸过温热生理盐水的纱布(不可过湿)轻轻按压止血;如果出血不止,应立即用止血钳夹住出血部位,然后用棉线结扎止血。
5)分离主动脉神经
家兔颈部的神经、颈总动脉被结缔组织膜包在一起,形成血管神经束,位于气管两侧,其腹面被胸骨舌骨肌和胸骨甲状肌所覆盖。术者用拇指和示指轻轻捏住分离的肌肉和皮肤,使示指向上顶而拇指向外翻,即可将血管神经束翻于示指之上。用弯头玻璃分针轻轻划开局部结缔组织束膜,仔细辨认3种神经与颈总动脉(图4—19):颈总动脉呈红色,有波动,壁有较强的弹性;迷走神经最粗,有较好的韧性,色洁白,一般位于外侧;交感神经较细,略呈灰色,一般位于内侧;主动脉神经最细,一般位于两神经之间。由于主动脉神经纤细,离开神经、动脉束的包膜后则难以分辨,所以应在原自然位置首先找到,并用玻璃分针沿纵向轻轻划动,分离出2 cm左右(此神经的韧性很差,易于拉断,分离时需十分小心)。用玻璃分针轻轻挑起分离后的神经,再用弯头眼科镊由神经下方穿过,将一浸过生理盐水的彩色丝线放于镊子内,轻轻收回夹住丝线的眼科镊,穿好线并打一活结备用。如果不能辨认出3条神经,则可先在颈总动脉下方穿过一条粗棉线(方法同上,但只分离很小一段动脉,需保留其前后的结缔组织束膜)。当轻轻提起动脉时即可看清3条神经,同法分离主动脉神经。分离主动脉神经、迷走神经并穿线备用。再将止血钳从颈总动脉下方穿过,轻轻张开止血钳,分离出2~3cm长的颈总动脉。分离出的颈总动脉外壁应该十分光洁,外面并无结缔组织及脂肪等物。在动脉上穿两条备用棉线,分别打上活结。将两线分别拉至分离出的动脉两端备用。同样方法分离另一侧血管与神经(一侧动脉用于插管测压,另侧动脉实验用)。由于家兔的品种不同,个体之间也有差异,常发现3条神经的解剖位置有些变异。主动脉神经的最后确认,需以对血压的影响为准。
4.动脉插管
首先用5m1注射器从耳缘静脉注入肝素(200 U/kg体重)以防凝血。然后在一侧动脉行动脉插管术以记录血压。其方法如下:
将动脉头端的备用线尽可能靠头端结扎(务必扎紧,以防渗血),然后在另一备用线的向心侧 (尽可能近心端),用动脉夹夹闭。轻轻提起动脉头端的结扎线,用锐利的眼科剪在靠近扎线的稍后方,沿向心方向斜向剪开动脉上壁(注意:不可只剪开血管外膜,也切勿剪断整个动脉,剪口大小约为管径的一半)。一手持弯头眼科镊,将其一个弯头从剪口处插进动脉少许,轻轻挑起剪开的动脉上壁,另一手将准备好的动脉插管由开口处插入动脉管内。如果插入较浅,可用一手轻轻捏住进入插管的动脉管壁,另一手拿住动脉插管,顺势轻轻推进至6—8mm左右(如果手感滞涩,说明插管并未进入动脉,必须退出插管,重新剪口再插),用
备用线将动脉连同进入的插管扎紧(插管不可因扎线松动而滑出,亦不可漏液),并将余线系在插管的固定侧支上,以免滑脱。注意:插管应与动脉血管的方向一致,以防插管尖端扎破动脉管壁。轻轻取下向心端动脉夹,可见动脉血与插管内液体混合。再取下通向压力传感器的止血钳,此时显示器上出现血压的波动曲线。
5.实验观察
(1)观察正常血压曲线 调节扫描速度与增益,可以明显地观察到心室射血与主动脉回缩形成的压力变化与收缩压、舒张压的读数。有时可以观察到血压曲线随呼吸变化,心搏为一级波,呼吸波为二级波。然后将扫描速度调慢,观察正常血压曲线。
(2)刺激迷走神经 记录对照血压、呼吸描记曲线后,刺激迷走神经,观察血压、呼吸有何变化。
(3)刺激另一侧迷走神经 待血压、呼吸渐渐趋于稳定后,刺激另一侧迷走神经,观察血压、呼吸有何变化。
(4)刺激一侧交感神经 待血压、呼吸渐渐趋于稳定后,刺激一侧交感神经,观察血压、呼吸有何变化。
(5)注射肾上腺素 待血压、呼吸渐渐趋于稳定后,耳缘静脉注射0.2ml肾上腺素,观察血压、呼吸有何变化。
(6)夹闭颈动脉 待血压、呼吸渐渐趋于稳定后,用动脉夹夹闭未插管一侧颈动脉,观察血压、呼吸有何变化。
(7)剪断一侧主动脉神经 待血压、呼吸渐渐趋于稳定后,剪断未插管侧的主动脉神经,观察血压、呼吸有何变化。
(8)剪断一侧交感神经 待血压、呼吸渐渐趋于稳定后,剪断未插管侧的交感神经,观察血压、呼吸有何变化。
(9)剪断一侧迷走神经 待血压、呼吸渐渐趋于稳定后,剪断未插管侧的迷走神经,观察血压、呼吸有何变化。
第二篇:家兔动脉血压神经体液调节
家兔动脉血压神经体液调节
201 级生物科学二班 学号:
1.实验目的
1.1学习直接测定家兔动脉血压的急性实验方法。
1.2 观察神经、体液因素对心血管活动的影响。
2.实验原理
在正常生理情况下,人和高等动物的动脉血压是相对稳定的。这种相对稳定性是通过神经和体液因素的调节而实现的,其中以颈动脉窦—主动脉弓压力感受性反射尤为重要。此反射既可使升高的血压下降,又可使降低的血压升高,故有血压缓冲反射之称。家兔的主动脉神经在解剖上独成一支,易于分离与观察其作用。
本实验是应用液导系统直接测定动脉血压。即由动脉插管与压力传感器连通,其内充满抗凝液体,构成液导系统,将动脉插管插入动脉内,动脉内的压力及其变化,可通过封闭的液导系统传递到压力传感器,并由计算机采集系统记录下来。
3.实验动物和器材
家兔、兔手术台、常用手术器械、止血钳(4~6把)、眼科剪、支架、双凹夹、气管插管、动脉插管、三通管、动脉夹、计算机采集系统、压力传感器、保护电极、照明灯、纱布、棉球、丝线、注射器(1 m1、5 ml、20m1)、生理盐水、4%柠檬酸钠、20%-25%氨基甲酸乙酯、肝素(200 U/m1)、肾上腺素(1:5 000)。
4.实验步骤
4.1 家兔麻醉固定:称重,耳缘静脉注射麻醉剂。待兔被麻醉后,将兔背位固定于手术台上,剪颈部皮毛。
4.2 气管插管:钝性分离颈部肌肉等组织,暴露气管,在气管背面穿线,再用手术刀手术剪在气管上方作T形切口;用制作好的棉签将气管中的血块弄出,沿向心方向插好气管插管并用线扎紧,防止松脱。
4.3分离右侧主动脉神经:用食指中指和拇指将右侧颈部肌肉等组织翻起,看到有弹性的颈总动脉,在其旁边可看到白色的粗的迷走神经,然后在旁边用后玻璃分针(完好无破损)找出最细的减压神经,穿2条线备用。
4.4 分离右侧迷走神经,穿2条线备用。
4.5 分离右侧的右颈总动脉,穿1条线备用。
4.6 分离左侧颈总动脉(3厘米长),穿2线备用,用于插管。
4.7 注射肝素(200U/kg体重)。
4.8 动脉插管法:
动脉夹夹住左侧颈总动脉靠心端
结扎左侧颈总动脉靠头端,检查分支
在结扎线下方2mm剪向心1/2切口
用眼科镊插进动脉切口,确定在动脉内,然后挑起动脉上壁,将动脉插管由眼 科镊下方开口处插入动脉内,用备用线扎死动脉和套管并挂住套管上,用另一动脉夹固定结扎部位。
4.9 实验仪器的准备
打开计算机采集系统,接通压力传感器。从显示器的“实验项目”中找出“循环实验”的“家兔血压的调节”条,使显示器显示压力读数。
4.10 连通液导系统并制压
将压力传感器的下方支管,通过输液管连接三通管,再连接动脉插管。上侧管供制压时排除管内空气使用。先用装有20ml 4%柠檬酸钠的注射器,通过三通管向连接动脉插管的输液管内推注,使之充满液体(不要使动脉插管高过压力传感器的上方支管)后,再用止血钳夹住动脉插管端的输液管。然后继续向三通管内推注,直至充满压力传感器的上方支管,并用塞子塞住(注意:液导系统内不可有气泡)。继续向三通管内推注,同时观察显示器上压力变化。当加压到120mmHg时既可关闭三通管。观察压力是否变化,如果压力下降,则需要检查液导系统的漏液原因,并重新制压。调节血压显示器的灵敏度,使30~130mmHg的变化都能在显示器上明显的反映出来。将动脉插管端的导管内充满肝素溶液。
4.11实验观察
(1)观察正常血压曲线 调节扫描速度与增益,可以明显地观察到心室射血与主动脉回缩形成的压力变化与收缩压、舒张压的读数。有时可以观察到血压曲线随呼吸变化,心搏为一级波,呼吸波为二级波。然后将扫描速度调慢,观察正常血压曲线。
(2)轻轻提起对侧完好颈总动脉上的备用线,用动脉夹夹闭30s(于夹闭前记录动脉通畅时的血压曲线),观察并记录血压变化。出现变化后即取下动脉夹,记录血压的恢复过程。
(3)记录对照血压曲线后,用手指按压颈动脉窦(下颌下方内侧),观察并记录血压变化。当血压明显下降时,则停止按压,待血压恢复(如果血压反而升高,说明按压的是血管,需重新寻找按压位置)。
(4)刺激主动脉神经 使刺激输出端连接保护电极,轻轻提起主动脉神经上的备用线,小心地将神经置于保护电极之上。记录对照血压曲线后,再用中等强度的连续电脉冲信号,通过保护电极,刺激神经10-20s。血压出现明显下降后即可停止刺激,并待血压恢复。如果血压并不下降,可调整刺激强度或刺激频率再行刺激。任何刺激都无效时,则表示此神经并非主动脉神经。需要重新辨认神经后再行实验。
(5)分别刺激主动脉神经中枢端和外周端 双结扎主动脉神经后(务必扎紧),从两扎线结之间剪断神经。记录对照血压后,同法分别刺激神经的中枢端和外周端,观察并记录血压变化。
(6)刺激迷走神经 记录对照血压后,用同样的方法刺激迷走神经,观察血压下降曲线与(4)有何不同(如果血压下降很快、很低,应立即停止刺激)。
(7)结扎并剪断迷走神经 同时结扎双侧迷走神经后剪断,观察血压有何变化。
(8)刺激迷走神经外周端 分别刺激两侧迷走神经外周端,观察并记录血压变化有何不同。
(9)肾上腺素对血压的影响 记录对照血压曲线后,用1 m1注射器,从耳缘静脉注入0.1~0.3 m1肾上腺素溶液,观察并记录血压变化及恢复曲线。
5.实验结果及分析
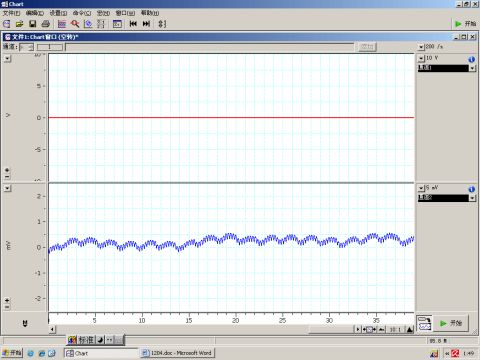
图1 正常血压曲线
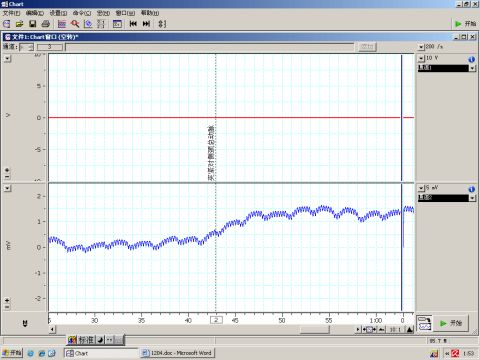
图2 夹闭对侧颈总动脉
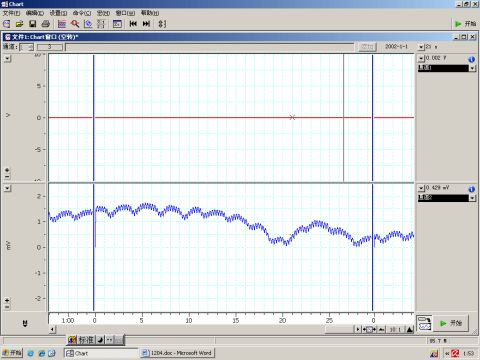
取下动脉夹
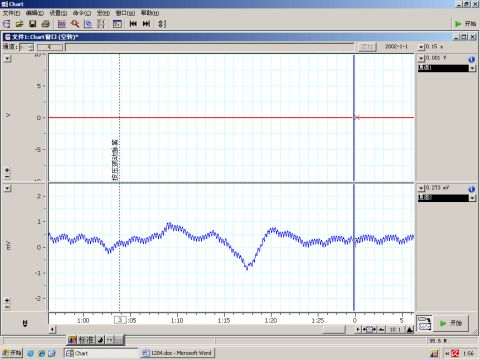
图3 按压颈动脉窦

图4 刺激主动脉神经
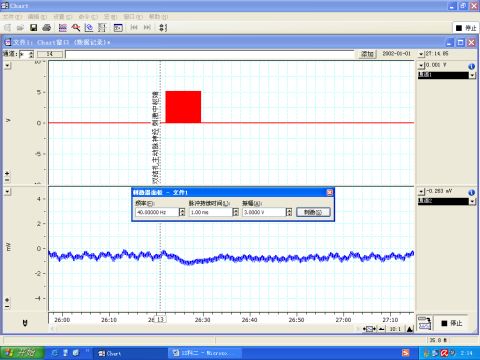
图5 刺激主动脉神经中枢端
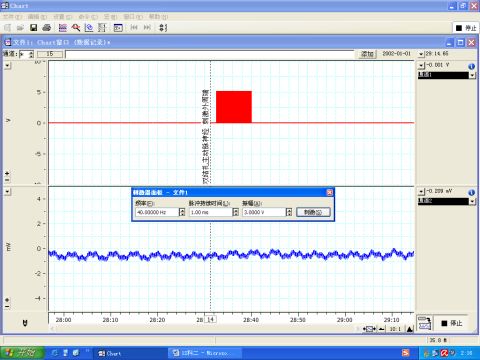
图6 刺激主动脉神经外周端
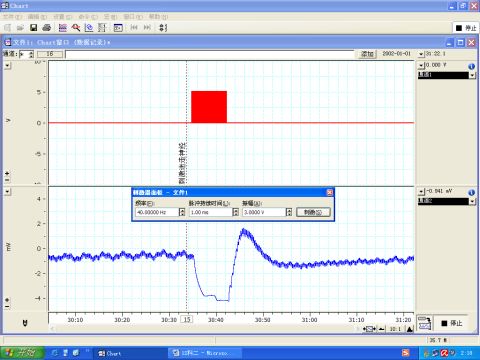
图7 刺激迷走神经
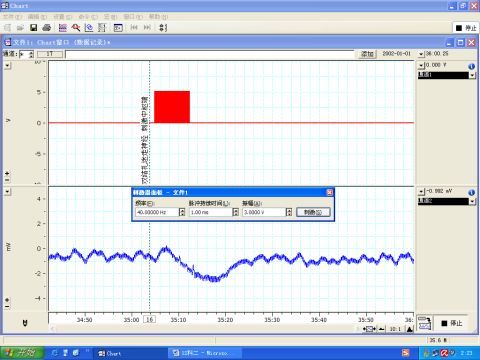
图8 刺激迷走神经中枢端
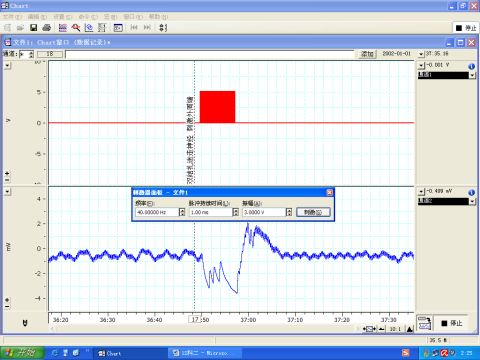
图9 刺激迷走神经外周端
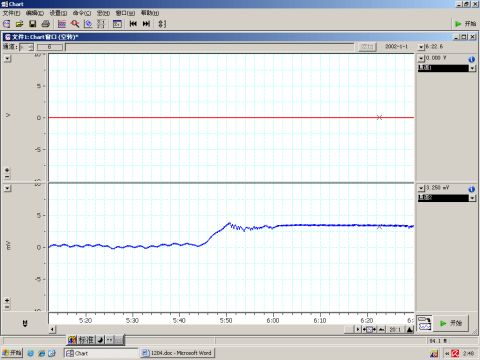
图10 肾上腺素对血压的影响
(注:因本组做实验时仪器无法输出刺激,故刺激迷走神经和主动脉神经的实验结果借鉴第三组的实验结果)
6.分析与讨论
6.1 夹闭颈总动脉使颈动脉窦血压下降,颈动脉窦压力感受器受到刺激减弱,导致血压升高,如图2所示。相反的,按压颈动脉窦使颈动脉窦压力感受器受到刺激增强,导致血压降低,如图3所示。
6.2 主动脉神经又称减压神经,兔减压神经是单纯的传入神经,其作用是将冲动传入延髓的心血管中枢,引起血压降低。因此,刺激完整的主动脉神经或其中枢端,导致血压下降,如图4、5所示。而刺激其外周端不会引起血压变化。如图6所示。
6.3 刺激迷走神经使其中的副交感神经纤维兴奋,产生负性变时、变力、变传导作用,出现心率减慢,心输出量下降,血压下降,如图7所示。而迷走神经与主动脉神经不同,并不是单纯的传入神经,因此刺激其中枢端和外周端都能引起血压降低,如图8、9所示。
6.4 肾上腺素能使心肌收缩力加强、兴奋性增高,传导加速,通过增加心输出量,
使血压升高,如图10所示。
7.参考文献
崔庚寅 解景田 主编。生理学实验释疑解难。第一版。北京:科学出版社,20xx年。
