
第二篇:物化实验(下)报告实验A-磁化率-络合物结构的测定
磁化率——络合物结构的测定
摘要 :本实验通过古埃(GOUY)法测定磁化率的方法对莫尔氏盐(NH4)2SO4·FeSO4·6H2O,FeSO4·7H2O以及K4Fe(CN)6·3H2O的磁化率进行测定,并求出未成对电子数并判断络合物中央离子的电子结构和成键类型,同时了解磁介质在磁场中的磁化现象。
关键词: 磁化率 古埃法 磁化现象 络合物结构
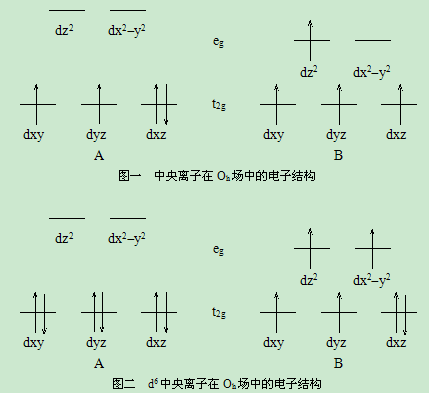
前言: 当磁介质放到场强为H的磁场中会产生附加的磁场H′,这种现象称为磁介质的磁化。 由亍分子体系内有电子环形运劢,所以它应具有磁矩。由亍热运劢,原子或分子的磁矩μ P指向各个方向的几率相等,所以由大量原子分子所组成的体系的平均磁矩为零。但在外磁场中,原子分子的磁矩会顺着磁场方向取向。(即有较多的原子分子的μ P顺着H的方向排列)而热运劢会扰乱这种取向。当达到热力学平衡时,由大量原子分子组成的体系具有丌为零的平均磁矩。这种平均磁矩随外磁场的增大而增大,随温度的升高而减小。 在多原子分子中,电子轨道运劢和分子的核构型联系很紧密,以致分子的轨道运劢丌能顺着磁场方向取向,分子的顺磁性全部或几乎全部都是由电子的自旋运劢提供。 络合物中的中央离子的电子结构强烈地受配位体电场的影响。当没有配位体存在时,中央离子的5个d轨道具有相同的能量。在正八面体配位体场的作用下,中央离子的d轨道的能级分裂成两个小组,能量较高的一组记为eg,它由dz2和dx2-y2组成。能量较低的一组记为t2g,它由dxy、dyz、dxz组成。eg和t2g之间的能量差记为Δ称为分离能。 配位体电场越强(如CN-配位体)则分离能越大(如图-A),配位体电场越弱(如H2O、F-配位体)则分离能Δ越小(如图一中B所示)。同理d6中央离子在正八面体配位场中的电子结构,在强场中有图二(A)的电子排布,在弱场中有图二(B)的电子排布。强场络合物因未配对电子少属于低自旋络合物(共价配键),弱场络合物因未配对电子多属于高自旋络合物(电价配键)。
实验部分:
(1) 仪器和试剂:
试剂:莫尔氏盐 (NH4)2SO4?FeSO4?6H2O(分析纯);
FeSO4?7H2O(分析纯);
K4Fe(CN)6?3H2O(分析纯)。
仪器:古埃磁天平(包括磁场,电光天平,励磁电源等);
CT5型高斯计一台;
软质玻璃样品管4支;
装样品工具(研钵、角匙、小漏斗、玻璃棒)一套。
(2)实验过程:
1.将电流调至0A,取一支清洁、干燥的空样品管悬挂在古埃磁天平的挂钩上,使样品管底部正好与磁极中心线齐平。准确称得空样品管重量;然后将励磁电流由小至大调节至3A,迅速且准确地称取此时空样品管的重量;继续由小至大调节励磁电流至4A再称重量;继续将励磁电流升至5A,接着又将励磁电流缓降至4A,再称空样品管重量;又将励电流由大至小降至3A,再称重量;将励磁电流降至零,又称取一次样品管重量。本实验的装置图如图三所示。
 同法重复测定一次,将二次测得的数据取平均值。
同法重复测定一次,将二次测得的数据取平均值。
取下样品管,将事先研细的莫尔氏盐通过小漏斗装入样品管,在装填时须不断将样品管底部敲击皮垫,务使粉末样品均匀填实,直至装满约15厘米高。用直尺准确量取样品高度h。同上法,将装有莫尔氏盐的样品管置于古埃天平的挂钩上,在0A、3A、4A、4A、3A、0A电流下进行称量。测量两次,取两次数据的平均值。测定完毕,将样品管中的莫尔氏盐倒入回收瓶中,然后洗净、干燥备用。
2.测定FeSO4?7H2O和K4Fe(CN)6?3H2O的摩尔磁化率。具体步骤与1中相同。
(3)实验内容:
1.由莫尔氏盐的克磁化率和实验数据计算3A、4A电流下的磁场强度。
2.由FeSO4?7H2O和K4Fe(CN)6?3H2O的测定数据,计算它们的XM及未成对电子数n。
3.根据未成对电子数,讨论FeSO4?7H2O和K4Fe(CN)6?3H2O的Fe2+的最外层电子结构及由此推断配键类型。
结果与讨论:
1.磁场强度:
已知莫尔盐 ,温度T室温=294.95 K
,温度T室温=294.95 K
故XM=Xm×M=[9500/(294.59+1)]×392.14×10-6
=0.012603 cm3·mol-1
由实验数据以及公式:

可以计算得到,电流为3A时,磁场强度为H=2121.44G
电流为4A时,磁场强度为H=2415.935G
可以看出:
磁场强度与所加电流的大小有关,而实验中各种失误都会造成磁场强度值的误差,比如空管中的污渍的存在,会影响空管质量以及其随电流的变化;天平底部的玻璃门的缝隙,使得反应体系存在空气流动,同样会影响测量;最关键的一点,电流表精度较低,对于测量结果影响较大;这些都会影响到最终计算出来的磁场强度的数值。而实验采用电流增大方向及减小方向两向测量,每次实验重复测量2次的方法,可以有效地减小这些误差,从而得到较精确的结果。
2.FeSO4·7H2O和K4Fe(CN)6·3H2O的XM及未成对电子数n计算
由实验原始数据按与(1)相同的处理方法可以得到:
FeSO4·7H2O:
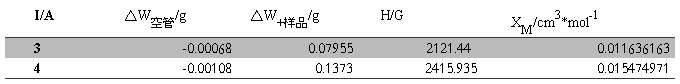
XM的平均值=0.013555567 cm3·mol-1
代入  可得n(n+2)=32.053
可得n(n+2)=32.053
n取整数,则n=4
K4Fe(CN)6·3H2O:
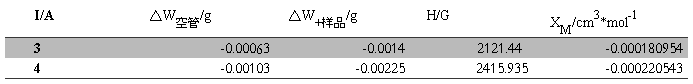
XM的平均值=-0.000200748cm3·mol-1
代入  可得n(n+2)=-0.47469
可得n(n+2)=-0.47469
n取整数,则n=0
3、FeSO4·7H2O和K4Fe(CN)6·3H2O的Fe2+的最外层电子结构及配键类型
FeSO4·7H2O 和K4Fe(CN)6·3H2O均为正八面体配合物,Fe2+最外层是d6 结构。对于K4Fe(CN)6·3H2O,配位体CN-是强场配体,分离能大于电子配对能P,第四个电子客服电子成队能P而处于t2g上,电子排布如A 所示, 没有单电子,属于共价配键。对于FeSO4·7H2O,配位体H2O 是弱场配体,电子配对能大于分离能,第四个电子克服分离能△排在eg上,电子排布如B 所示,有4 个单电子,属于电价配键。

结论:
当将磁介质放入外磁场中,原子或分子的磁矩会顺着磁场方向取向,而在多原子分子中,分子的顺磁性全部或几乎全部都是由电子的自旋运动提供,所以可以通过测量分子的磁化率从而得到分子中的未成对电子以及电子结构,并以此推出分子的配键类型。
本实验通过古埃法测定莫尔氏盐(NH4)2SO4·FeSO4·6H2O,FeSO4·7H2O以及K4Fe(CN)6·3H2O的磁化率。从实验中我们可以得到,在不同电流下的磁场强度不同,得出的磁化率也不同。而利用平均磁化率,求得FeSO4·7H2O中有4个未成对电子,Fe2+的电子结构为d6,为高自旋络合物(电价配键);K4Fe(CN)6·3H2O中没有未成对电子,Fe2+的电子结构为d6,为低自旋络合物(共价配键)。
参考文献:
《物理化学实验》崔献英,柯燕雄,单绍纯 中国科学技术大学出版社
《物理化学》傅献彩等 高等教育出版社
《普通化学原理》华彤文等 北京大学出版社
Susceptibility - The Determination of Complex Structures
Abstract: This experiment used GOUY method to measure the
susceptibility of (NH4)2SO4·FeSO4·6H2O,FeSO4·7H2O and K4Fe(CN)
6·3H2O ,through which we could calculate the number of unpaired
electrons and determine the electronic structure of the central complex
ions and their bonding types. Meanwhile we could know more about the
Magnetic phenomenon.
Keywords: susceptibility GOUY method Magnetic phenomenon bonding type
原始数据记录及处理:
实验室的温度:T1=21.1℃ T2=22.5℃
反应温度为:T=1/2(T1+T2)=21.8℃=294.59K
(1)电流为3A、4A时磁场强度的计算
实验中测得装有莫尔盐管的质量随电流的变化为Table.1所示:
Table.1 莫尔盐实验中质量随电流的变化

W样品=W0+样品— W0空管=24.79373- 13.8519=10.94183g
△W空管=W空管+磁场-W0空管
△W+样品=W+样品+磁场-W0+样品
实验测量得到:h=15.12cm
并且对于莫尔盐来说:
所以莫尔盐的磁化率:XM=Xm·M=[9500/(294.59+1)]×392.14×10-6
=0.012603 cm3·mol-1
由:
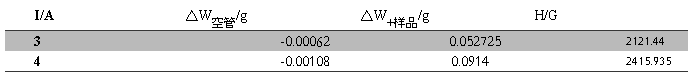
可以得到电流分别为3A、4A时的磁场强度H,如Table.2
Table.2不同电流时磁场强度
(2)由FeSO4?7H2O和K4Fe(CN)6?3H2O的测定数据,计算它们的XM及未成对电子数n。
实验中,装填两种物质的高度h分别为:
FeSO4?7H2O: h1=15.45cm
K4Fe(CN)6?3H2O:h2=15.18cm
与(1)中处理类似可以得到:
1、FeSO4?7H2O(Table.3 、Table.4)
Table.3 FeSO4?7H2O实验中质量随电流的变化
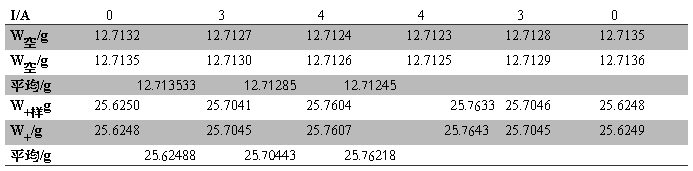
W样品= W0+样品— W0空管= 12.91134g
h1=15.45cm
Table.4 FeSO4?7H2O在不同磁场强度的磁化率
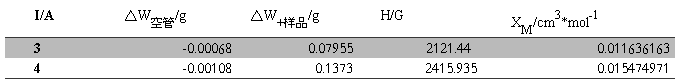
XM的平均值=(0.011636163+0.015474971)/2=0.013555567 cm3·mol-1
代入  可得n(n+2)=32.053
可得n(n+2)=32.053
n取整数,则n=4
2、K4Fe(CN)6?3H2O(Table.5 、Table.6)
Table.5 K4Fe(CN)6?3H2O实验中质量随电流的变化
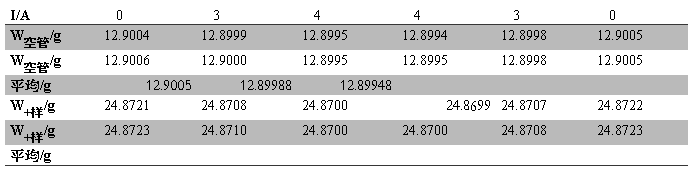
W样品= W0+样品— W0空管= 11.97173g
h1=15.18cm
Table.6 K4Fe(CN)6?3H2O在不同磁场强度的磁化率

XM的平均值=(0.011636163+0.015474971)/2=-0.000200748cm3·mol-1
代入  可得n(n+2)=-0.47469
可得n(n+2)=-0.47469
n取整数,则n=0
