乙酸乙酯的制备
[适用对象] 中药学(知识产权保护方向)、中药资源与开发、环境科学、药学、药物制剂、中药学、制药工程、中药学(国际交流方向)专业
[实验学时] 8学时
一、实验目的
1. 了解从有机酸合成酯的一般原理及方法。
2. 掌握蒸馏。分液漏斗的使用等操作。
二、实验原理
反应式:
CH3COOH+浓H
C2H5OH2SO4
110-140CH3COOC2H5+H2O
副反应:
浓H
2CH3CH2

OH2SO4
140CH3CH2OCH2CH3+H2O
浓H
CH3CH2OH2SO4
[O]CH3CHO+SO2+H2O
|浓H2SO4|
[O]CH3COOH
SO2+H2OH2SO3
三、仪器设备
三颈瓶、滴液漏斗、温度计、蒸馏弯管、直形冷凝管、锥形瓶、分液漏斗、蒸馏瓶
四、相关知识点
1.本实验所采用酯化方法,仅适用于合成一些沸点较低的酯类。
优点是能连续进行,用较小容积的反应瓶制得较大量的产物。对于沸点较低的酯类,若采用相应的酸和醇回流加热来制备,常常不够理想。
2.滴液漏斗使用前,活塞涂上凡士林,并用橡皮筋固定,检查是否漏液,以免漏液,引起火灾。
3.温度不宜过高,否则会增加副产物乙醚的含量。滴加速度太快会使醋酸和乙醇来不及作用而被蒸出。同时,反应液的温度会迅速下降,不利于酯的生成,使产量降低。
4.用碳酸钠饱和溶液除去醋酸,亚硫酸等酸性杂质后,碳酸钠必须洗去,否则下一步用饱和化钙溶液洗去乙醇时,会产生絮状的碳酸钙沉淀,造成分离的困难。为减少酯在水中的溶解度(每17份水溶解1份乙酸乙酯),故用饱和食盐水洗碳酸钠。
5.乙酸乙酯与水或醇能形成二元或三元共沸物,其组成及沸点如下表:
由上表可知,若洗涤不净或干燥不够时,都使沸点降低,影响产率。 如果在70-72度蒸出的馏出液较多时,可另外收集,重新除醇,干燥除水和重蒸馏。
a) 假如浓硫酸有机物混合不均匀,加热时往往会使有机物炭化,溶液发黑。
b) 假如未冷却,低沸点的乙酸乙酯易因挥发而损失。
馏出液主要是乙酸乙酯,同时含有少量水。乙醇。乙醚和乙酸
五、实验步骤
125ml三颈瓶中,放入12ml95%乙醇,在震摇下分批加入12ml
浓硫酸使混合均匀,并加入几粒沸石。旁边两口分别插入60滴液漏斗及温度计,漏斗末端及温度计的水银球浸入液面以下,距平地0.5-1cm。中间一口装一蒸馏弯管与直形冷凝管连接,冷凝管末端连接一接液管,升入50ml具塞锥形瓶中。
将12ml95%乙醇及12ml冰醋酸(约12。6克。0。21mol/L)的混合液,由60ml滴液漏斗滴入蒸馏瓶内约3-4ml。然后将三颈瓶在石棉网上用小火加热,使瓶中反应液温度升到110度,减小火焰,立即从滴液漏斗慢慢滴入其余的混合液。控制滴入速度和馏出速度大致相等(约每秒一滴)并维持反应液温度在110-120度之间。滴加完毕后,继续加热数分钟,直到温度升高到130度时不再有液体馏出为止。
馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和醋酸。在此馏出液中慢慢加入饱和碳酸钠溶液(约10ml),时加摇动,直至无二氧化碳气体逸出(用试纸检验,酯层应呈中性)。将混合液移入分液漏斗,充分振摇(注意活塞放气)后,静置。分去下层水溶液酯层用10ml饱和食盐水洗涤后,再每次用10ml饱和化钙饱和溶液洗涤二次。齐去下层液,酯层自分液漏斗上口倒入干燥的50ml具塞锥形瓶中,用无水硫酸镁(或无水硫酸钠)干燥。
将干燥的粗乙酸乙酯滤入干燥的30ml蒸馏瓶中,加入沸石后在水浴上进行蒸馏。收集73-78℃的馏分,产量10.5-12.5克(产率57%-68%).
纯乙酸乙酯的沸点为77.06℃,折光率1.3723。
六、实验报告要求
1.实验现象要表达正确,数据记录要完整,真实。
2.对现象加以简要的解释,写出主要反应方程式,分标题小结或者最后得出结论。数据计算要表达清晰。
3.针对实验中遇到的疑难问题提出自己的见解或收获。
七、思考题
1.酯化反应有什么特点,本实验如何创造条件促使酯化反应尽量向生成物方向进行?
2.本实验可能有哪些副反应?
3、在酯化反应中,用作催化剂的硫酸量,一般只需醇重量的3%就够了,这里为何用了12ml?
4.如果采用醋酸过量是否可以?为什么?
八、实验成绩评定办法
主要评分点:原理描述(10%)、实验流程(20%)、调试过程(10%)、数据记录(10%)、解决问题的能力(20%)、资料搜集(10%)、实验结果(10%)、实验效果(10%)。
思考题和测试题
思考题1:浓硫酸的作用是什么?
思考题2:加入浓硫酸的量是多少?
思考题3:为什么要加入沸石,加入多少?
思考题4:为什么要使用过量的醇,能否使用过量的酸?
思考题5:为什么温度计水银球必须浸入液面以下:
思考题6:为什么调节滴加的速率(每分钟30滴左右)?
思考题7:为什么维持反应液温度120℃左右?
思考题8:实验中,饱和Na2CO3溶液的作用是什么?
思考题9:实验中,怎样检验酯层不显酸性?
思考题10:酯层用饱和Na2CO3溶液洗涤过后,为什么紧跟着用饱和NaCl溶液洗涤,而不用CaCl2溶液直接洗涤?
思考题11:为什么使用CaCl2溶液洗涤酯层?
思考题12:使用分液漏斗,怎么区别有机层和水层?
思考题13:本实验乙酸乙酯是否可以使用无水CaCl2干燥?
思考题14:本实验乙酸乙酯为什么必须彻底干燥?
思考题答案
思考题1答:在酯化反应中,浓硫酸其催化和吸水作用。
思考题2答:硫酸的用量为醇用量的3%时即能起催化作用,当硫酸用量较多时,由于它能够其脱水作用而增加酯的产率。但硫酸用量过多时,由于高温时氧化作用的结果对反应反而不利。
思考题3答:加入沸石的目的是防止爆沸,加入1-2粒即可。
思考题4答:使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。 思考题5答:反应过程中,我们控制的是反应液的温度,所以温度计水银球必须浸入液面以下。
思考题6答:若滴加速率太快则乙醇和乙酸可能来不及反应就随着酯和水一起蒸馏出,从而影响酯的产率。
思考题7答:温度太高,容易发生副反应,影响产物的纯度和产率。
思考题8答:使用饱和Na2CO3溶液中和反应液中残余的乙酸。
思考题9答:先将蓝色石蕊试纸湿润,再滴上几滴酯。
思考题10答:当酯层用饱和Na2CO3溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的CaCO3沉淀,使进一步分离变得困难,故在这步操作之间必须水洗一下。由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
思考题11答:酯层中含有少量未反应的乙醇,由于乙醇和CaCl2作用生成CaCl2·4H2O结晶化物,所以使用乙醇除去少量未反应的乙醇。
思考题12答:乙酯的密度d204=0.9003,所以有机层在上层。如果不知道密度,可以向分液漏斗中加入少量水,比较上层和下层体积的变化。
思考题13答:不可以,因为乙醇和CaCl2作用生成CaCl2·4H2O结晶化物。
思考题14答:乙酸乙酯与水和醇分别生成二元共沸物,若三者共存则生成三元共沸物。因此,酯层中的乙醇和水除不净时,回形成低沸点共沸物,而影响酯的产率。
测试题1、 酯化反应有什么特点? 实验中如何创造条件使酯化反应尽量向生成物的方向进行?
测试题2、 本实验若采用醋酸过量的做法是否合适?为什么?
测试题3、 蒸出的粗乙酸乙脂中主要有哪些杂质?如何除去?
测试题4、实验中使用浓硫酸的作用?
测试题5、能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?
测试题6、为什么用饱和碳酸钠溶液洗涤时要小量分批加入,并不断摇动接受器? 测试题7、实验中用饱和食盐水洗涤,是否可用水代替?
测试题答案:
测试题1答:酯化反应为可逆反应,反应进行慢且需要酸催化。为提高产率,本实验中采用增加醇的用量、不断将产物酯和水蒸出、加大浓硫酸用量的措施,使平衡向右移动。
测试题2答:不合适,因为使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。
测试题3答:主要杂质有乙醚、乙醇、乙酸和水等。由于乙醚沸点低,在多次洗涤中,极易挥发掉;使用饱和的Na2CO3溶液洗涤除去乙酸;紧跟着用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,然后用饱和CaCl2溶液直接洗涤除去少量的乙醇。
测试题4答:反应中,浓硫酸除了起催化剂作用外,还吸收反应生成的水,有利于酯的生成。
测试题5答:不可以,使用浓氢氧化钠溶液可以使乙酸乙酯发生水解,降低产率。 测试题6答:因为乙酸乙酯粗产品中含有乙酸,乙酸与饱和碳酸钠溶液反应生成二氧化碳,如果一次加入,反应剧烈,所以必须要小量分批加入,并不断摇动接受器,使乙酸与碳酸钠温和的反应。
测试题7答:不可以,由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
第二篇:乙酸乙酯的合成 思考题附答案
乙酸乙酯的合成
一、教学要求:
1、 了解由醇和羧酸制备羧酸酯的原理和方法
2、 掌握酯的合成法(可逆反应)及反应条件的控制
3、 掌握产物的分离提纯原理和方法
4、 学习液体有机物的蒸馏、洗涤和干燥等基本操作
二、预习内容:
1、 滴液漏斗和分液漏斗的使用
2、 蒸馏操作
3、 萃取与洗涤
4、 了解浓硫酸的性质与使用方法
5、 乙酸乙酯、乙酸、乙醇和水的密度、熔点和沸点等参数
三、基本操作
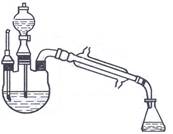
图 乙酸乙酯的制备装置
四、实验原理:
乙酸乙酯由乙酸和乙醇在少量浓硫酸催化下制得。
主反应: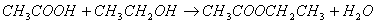
副反应: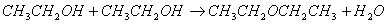 (140℃~150℃)
(140℃~150℃)
反应中,浓硫酸除了起催化剂作用外,还吸收反应生成的水,有利于酯的生成。若反应温度过高,则促使副反应发生,生成乙醚。
为提高产率,本实验中采用增加醇的用量、不断将产物酯和水蒸出、加大浓硫酸用量的措施,使平衡向右移动。
本反应的特点:(1)反应温度较高,达到平衡时间短;(2)操作简单;(3)转化率较高。
五、实验步骤:
在干燥的100ml三颈烧瓶中加入8ml 95%的乙醇,在冷水冷却下,边摇边慢慢加入8ml浓硫酸,(思考题1,2)加入沸石(思考题3);在滴液漏斗中加入8ml 95%的乙醇和8ml乙酸,摇匀(思考题4)。按书上装置图组装仪器。滴液漏斗的末端和温度计的水银球必须浸到液面以下距瓶底0.5~1cm处。(思考题5)
用电热套加热烧瓶(电压70~80V),当温度计示数升到110℃,从滴液漏斗中慢慢滴加乙醇和乙酸混合液(速度为每分钟30滴为宜),(思考题6)并始终维持反应温度在120℃左右。(思考题7)滴加完毕,继续加热数分钟,直到反应液温度升到130℃,不再有馏出液为止。
向馏出液中慢慢加入7ml饱和碳酸钠溶液,轻轻摇动锥形瓶,直到无CO2气体放出,并用兰色石蕊试纸检验酯层不显酸性为止。将混合液移入分液漏斗中,充分振摇(注意放气),静置分层。弃去下层水溶液,酯层用7ml饱和食盐水洗涤,分净后,再用14ml饱和CaCl2溶液分两次洗涤酯层,弃去下层废液。(思考题8,9,10,11,12)分液漏斗上口将乙酸乙酯倒入干燥的50ml锥形瓶中,加入2~3g无水硫酸镁,放置30min。在此期间要间歇震荡锥形瓶。(思考题13,14)
将干燥好的乙酸乙酯滤入干燥的50ml圆底烧瓶中,加入沸石,蒸馏,收集76~78℃馏分,称重,计算产率。
纯乙酸乙酯为无色而有香味的液体,b.p.为77.06℃,n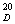 为1.3723
为1.3723

六、存在的问题与注意事项:
1、 反应温度不宜过高,否则会发生副反应,产生过多的副产物—乙醚。
2、 进行反应时,应保持滴加速度和蒸出速度大体一致,否则收率也较低。
3、 使用浓硫酸要注意安全。
4、 蒸馏滴加反应装置的要按次序正确安装。
七、深入讨论:
1、 合成乙酸乙酯的其它方法
在100mL圆底烧瓶中加入14.3mL冰醋酸和23mL乙醇,在摇动下慢慢加入7.5mL浓硫酸,混合均匀后加入几粒沸石,装上回流冷凝管,在水浴上加热回流0.5h。稍冷后,改为蒸馏装置,在水浴上加热蒸馏,直至无馏出物馏出为止,得粗乙酸乙酯。在摇动下慢慢向粗产物中滴入饱和碳酸钠水溶液数滴,使有机相呈中性为止(用pH试纸测定)。将液体转入分液漏斗中,摇振后静置,分去水相,有机相用10mL饱和食盐水洗涤后,再每次用10mL饱和氯化钙溶液洗涤两次。弃去下层液,酯层转入干燥的锥形瓶用无水硫酸镁干燥。
将干燥后的粗乙酸乙酯滤入50mL蒸馏瓶中,在水浴上进行蒸馏,收集73~78℃馏分,产量10~12g。
纯粹乙酸乙酯的沸点为77.06℃, =1.3723。
=1.3723。
2、 实验步骤流程图
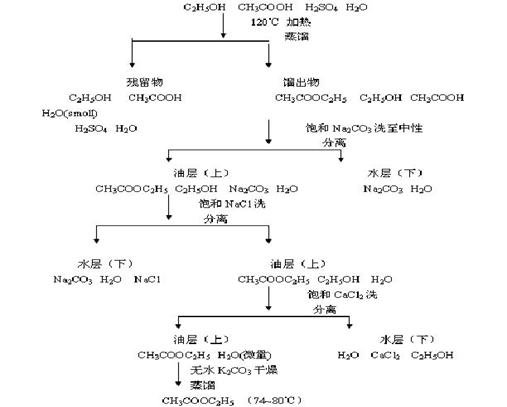
八、思考题和测试题
思考题1:浓硫酸的作用是什么?
思考题2:加入浓硫酸的量是多少?
思考题3:为什么要加入沸石,加入多少?
思考题4:为什么要使用过量的醇,能否使用过量的酸?
思考题5:为什么温度计水银球必须浸入液面以下:
思考题6:为什么调节滴加的速率(每分钟30滴左右)?
思考题7:为什么维持反应液温度120℃左右?
思考题8:实验中,饱和Na2CO3溶液的作用是什么?
思考题9:实验中,怎样检验酯层不显酸性?
思考题10:酯层用饱和Na2CO3溶液洗涤过后,为什么紧跟着用饱和NaCl溶液洗涤,而不用CaCl2溶液直接洗涤?
思考题11:为什么使用CaCl2溶液洗涤酯层?
思考题12:使用分液漏斗,怎么区别有机层和水层?
思考题13:本实验乙酸乙酯是否可以使用无水CaCl2干燥?
思考题14:本实验乙酸乙酯为什么必须彻底干燥?
思考题答案
思考题1答:在酯化反应中,浓硫酸其催化和吸水作用。
思考题2答:硫酸的用量为醇用量的3%时即能起催化作用,当硫酸用量较多时,由于它能够其脱水作用而增加酯的产率。但硫酸用量过多时,由于高温时氧化作用的结果对反应反而不利。
思考题3答:加入沸石的目的是防止爆沸,加入1-2粒即可。
思考题4答:使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。
思考题5答:反应过程中,我们控制的是反应液的温度,所以温度计水银球必须浸入液面以下。
思考题6答:若滴加速率太快则乙醇和乙酸可能来不及反应就随着酯和水一起蒸馏出,从而影响酯的产率。
思考题7答:温度太高,容易发生副反应,影响产物的纯度和产率。
思考题8答:使用饱和Na2CO3溶液中和反应液中残余的乙酸。
思考题9答:先将蓝色石蕊试纸湿润,再滴上几滴酯。
思考题10答:当酯层用饱和Na2CO3溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的CaCO3沉淀,使进一步分离变得困难,故在这步操作之间必须水洗一下。由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
思考题11答:酯层中含有少量未反应的乙醇,由于乙醇和CaCl2作用生成CaCl2·4H2O结晶化物,所以使用乙醇除去少量未反应的乙醇。
思考题12答:乙酯的密度d204=0.9003,所以有机层在上层。如果不知道密度,可以向分液漏斗中加入少量水,比较上层和下层体积的变化。
思考题13答:不可以,因为乙醇和CaCl2作用生成CaCl2·4H2O结晶化物。
思考题14答:乙酸乙酯与水和醇分别生成二元共沸物,若三者共存则生成三元共沸物。因此,酯层中的乙醇和水除不净时,回形成低沸点共沸物,而影响酯的产率。
测试题1、 酯化反应有什么特点? 实验中如何创造条件使酯化反应尽量向生成物的方向进行?
测试题2、 本实验若采用醋酸过量的做法是否合适?为什么?
测试题3、 蒸出的粗乙酸乙脂中主要有哪些杂质?如何除去?
测试题4、实验中使用浓硫酸的作用?
测试题5、能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?
测试题6、为什么用饱和碳酸钠溶液洗涤时要小量分批加入,并不断摇动接受器?
测试题7、实验中用饱和食盐水洗涤,是否可用水代替?
测试题答案:
测试题1答:酯化反应为可逆反应,反应进行慢且需要酸催化。为提高产率,本实验中采用增加醇的用量、不断将产物酯和水蒸出、加大浓硫酸用量的措施,使平衡向右移动。
测试题2答:不合适,因为使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。
测试题3答:主要杂质有乙醚、乙醇、乙酸和水等。由于乙醚沸点低,在多次洗涤中,极易挥发掉;使用饱和的Na2CO3溶液洗涤除去乙酸;紧跟着用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,然后用饱和CaCl2溶液直接洗涤除去少量的乙醇。
测试题4答:反应中,浓硫酸除了起催化剂作用外,还吸收反应生成的水,有利于酯的生成。
测试题5答:不可以,使用浓氢氧化钠溶液可以使乙酸乙酯发生水解,降低产率。
测试题6答:因为乙酸乙酯粗产品中含有乙酸,乙酸与饱和碳酸钠溶液反应生成二氧化碳,如果一次加入,反应剧烈,所以必须要小量分批加入,并不断摇动接受器,使乙酸与碳酸钠温和的反应。
测试题7答:不可以,由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
