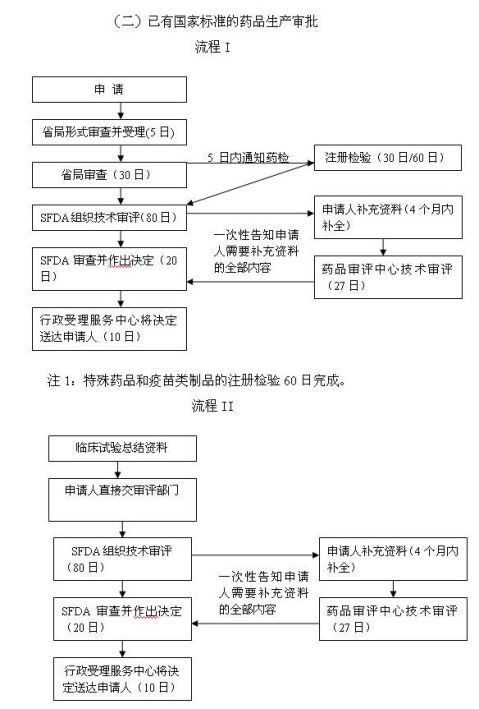
(二)已有国家标准的药品
《药品注册申请表》
1.综述资料
资料编号1、药品名称
资料编号2、证明性文件。
资料编号4、对主要研究结果的总结及评价。
资料编号5、药品说明书样稿、起草说明及最新参考文献。
资料编号6、包装、标签设计样稿。
2.药学研究资料
资料编号7、药学研究资料综述。
资料编号8、药材来源及鉴定依据。
资料编号12、生产工艺的研究资料及文献资料,辅料来源及质量标准。
资料编号15、药品标准草案及起草说明,并提供药品标准物质及有关资料。 资料编号16、样品检验报告书。
资料编号17、药物稳定性研究的试验资料及文献资料。
资料编号18、直接接触药品的包装材料和容器的选择依据及质量标准。
以上申报材料具体要求详见《药品注册管理办法》附件一。
(一)申报资料的一般要求:
1、申报资料按《药品注册管理办法》(国家食品药品监督管理局令第17号)附件一规定的资料顺序编号,按编号分别装订,申报资料首页为申报资料目录。
2、申报资料应使用A4纸打印,内容完整、清楚,不得涂改。
3、资料封面应包含以下信息:药品名称、资料项目编号、项目名称、申请机构联系人姓名、电话、地址,试验资料完成机构名称、主要完成人、参加人、电话、原始资料保存地点。并须加盖各机构公章。
4、资料按套装入档案袋,档案袋封面注明:申请分类、注册分类、药品名称、本袋所属第X套第X袋每套共X袋、原件/复印件、申请机构、联系人、电话。
5、注册申请报送2套完整申请资料(其中至少1套为原件)和1套综述资料(可为复印件),各袋均应包含1份申请表。
6、《药品注册申请表》:从国家食品药品监督管理局网站(www.)下载,按要求填写后打印并保存,用于提交的申请表电子文件与书面申请表的数据核对码必须一致,并一并提交。
7、临床试验总结资料封面应有临床试验组长单位盖章,各临床试验分总结应有试验单位盖章。
(二)申报资料的具体要求:
1、《药品注册申请表》:临床试验完成后申请生产或仅申请新药证书,应重新填写《药品注册申请表》
该表是申请人提出药品注册申请的基本文件,同时也是药监部门对该申请进行审批的依据,其填写必须准确、规范,并符合填表说明的要求。
注:按照《药品注册管理办法》的规定,属于注册分类9的中药注射剂和国家食品药品监督管理局规定的注册分类9的其他中药、天然药物制剂,应当进行临床试验。此类申请的审批首先按照流程I进行,临床试验完成后,再按照流程II进行。
九、许可程序:
(一)受理:
申请人向省局受理部门提出申请,按照本《须知》第六条所列目录提交申请材料,工作人员按照“《药品注册管理办法》附件一:中药、天然药物注册分类及申报资料要求”对申请材料进行形式审查。申请事项依法不需要取得行政许可的,应当即时告知申请人不受理;申请事项依法不属于本行政机关职权范围的,应当即时作出不予受理的决定,并告知申请人向有关行政机关申请;申请材料存在可以当场更正的错误的,应当允许申请人当场更正;申请材料不齐全或者不符合法定形式的,应当当场或者在五日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理;申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,应当受理行政许可申请。
(二)省局审查与申请资料移送:
省级食品药品监督管理局自申请受理之日起5日内组织对生产情况和条件进行现场核查;抽取连续3个生产批号的样品,并向药品检验所发出注册检验通知。并在30日内完成现场核查、抽取样品、通知药品检验所进行注册检验、将审查意见及核查报告连同申请人的申报资料一并报送国家食品药品监督管理局等工作,同时将审查意见通知申请人。
(三)药品注册检验:
药品注册检验与技术审评并列进行。
药品检验所在接到注册检验通知和样品后,应当在30日内完成检验,出具药品注册检
验报告,并报送国家食品药品监督管理局,同时抄送通知其检验的省级食品药品监督管理部门和申请人。特殊药品和疫苗类制品的注册检验可以在60日内完成。
按照《药品注册管理办法》第三十二条规定,必须在指定的药品检验所进行的临床试验用样品检验,按照前两款时限的要求执行。
需要进行样品检验和药品标准复核的,药品检验所应当在60日内完成。特殊药品和疫苗类制品的样品检验和药品标准复核可以在90日内完成。
(四)技术审评:
注册分类1-8的注册申请,国家食品药品监督管理局药品审评中心按照有关的技术审评原则,在120日内完成技术审评(符合《药品注册管理办法》第四十八条规定的快速审批药品在100日内完成技术审评)。对于不符合技术审评要求的,发给补充资料通知,申请人在4个月内补充资料;药品审评中心收到补充资料后,在40日(符合《药品注册管理办法》第四十八条规定的快速审批药品在25日内完成技术审评)内完成补充资料的审查。未能在规定的时限补充资料的,对该申请予以退审。
注册分类9的注册申请,国家食品药品监督管理局药品审评中心按照有关的技术审评原则,在80日完成技术审评,对于不符合国家食品药品监督管理局药品审评中心技术审评要求的,发给补充资料通知,申请人在4个月内补充资料,药品审评中心收到补充资料后,在27日内完成补充资料的审查。
(五)行政许可决定:
国家食品药品监督管理局在完成技术审评后20日内完成审批;20日内不能完成审批的,经主管局领导批准,可以延长10日;时限延长超过10日的,须报国务院批准。经审查,认为符合规定的,发给《药品注册批件》和新药证书;申请人已持有《药品生产许可证》并具备该药品相应生产条件的,可以同时发给药品批准文号。认为不符合规定的,发给《审批意
见通知件》,并说明理由。
(六)送达:
自行政许可决定之日起10日内,SFDA行政受理服务中心将行政许可决定送达申请人。
(七)复审:
申请人对国家食品药品监督管理局作出的决定有异议的,在申请行政复议或者提起行政诉讼前,可以在收到决定之日起10日内填写《药品补充申请表》,向国家食品药品监督管理局提出复审申请并说明复审理由。复审的内容仅限于原申请事项及原申报资料。
国家食品药品监督管理局接到复审申请后,应当在50日内作出复审决定,并通知申请人。维持原决定的,国家食品药品监督管理局不再受理再次的复审申请。
复审需要进行技术审查的,国家食品药品监督管理局应当组织有关专业技术人员按照原申请时限进行。
十、承诺时限:
自受理之日起,无需进行临床试验的药品注册(按新药申请的)170日内作出行政许可决定;实行快速审批的药品,150日内作出行政许可决定;无需进行临床试验的药品注册(按已有国家标准申请的)130日内作出行政许可决定。
完成临床试验后的药品注册(按新药申请的)170日内作出行政许可决定;实行快速审批的药品,150日内作出行政许可决定;完成临床试验的药品注册(按已有国家标准申请的)100日内作出行政许可决定。
(注:国家食品药品监督管理局在完成技术审评后20日内完成审批;20日内不能完成审批的,经主管局领导批准,可以延长10日)。
以上时限不包括申请人补充资料及补充资料审评所需的时间。
十一、实施机关:
实施机关:国家食品药品监督管理局
受理地点:各省级食品药品监督管理部门
十二、许可证件有效期与延续:
国家食品药品监督管理局核发的药品批准文号、《进口药品注册证》或者《医药产品注册证》的有效期为5年。有效期届满,需要继续生产或者进口的,申请人应当在有效期届满前6个月申请再注册。
第二篇:药品注册分类及注册流程
目录
1. 化学药品注册分类
2. 境内申请人新药申报流程
3. 化学药品申报资料要求
4. 化学药品临床试验要求
化学药品注册分类
1.未在国内外上市销售的药品:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;
(5)新的复方制剂;
(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品:
(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途
径的制剂;
(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制
剂;
(3)改变给药途径并已在国外上市销售的制剂;
(4)国内上市销售的制剂增加已在国外批准的新适应症。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6.已有国家药品标准的原料药或者制剂。
以上,属注册分类1~5类按新药申报程序申请注册,6类按仿制药申请程序申请注册。
境内申请人,新药申报流程(以上注册分类中1~5类申报流程)
准备报临床申报资料(具体资料项目要求附后)
向省食品药品监督管理局报送申请资料 拿到受理号,相关进度,
便可以从SFDA网站上
查询www.
省局,受理,5工作日内组织对药物研制情况及原始资料进行现场核查;30工作日内完成现
场核查,将初审意见,《药品注册研制现场核查报告》,申报资料送交
国家食品药品监督管理局药品审评中心(CDE)
审评进度,审评人员名 单及联系方式可以从 CDE网站查询。 .cn CDE对申报资料进行技术审评(90工作日)
如果必要,CDE将要求申请人补充资料
(补充资料准备时间4个月,审评30工作日,一般最多要求补充2次)
CDE完成审评,提出技术审评意见,送国家食品药品监督管理局(SFDA)审批
符合规定,SFDA30工作日内作出审批,发给《药物临床试验批件》
临床试验备案(SFDA,申报省局,临床试验基地所在省局3处备案)
进行药物临床试验
临床试验完成后,准备报生产申报资料
向省食品药品监督管理局报送申请资料
省局,受理,5工作日内组织对药物临床试验情况及原始资料进行现场核查;
30工作日内完成现场核查,同时抽取3批样品。
初审意见, 《药品注册研制现场核查报告》,申报资料 样品送省药检所,60工作日完成注册检验,标准复核,《药检报告》寄送CDE
CDE技术审评(150工作日) 如果必要,CDE将要求申请人补充资料
(补充资料准备时间4个月,审评50工作日,一般最多要求补充2次)
CDE审评符合规定的,通知申请人申请生产现场检查,
并抄送国家食品药品监督管理局药品认证中心,
申请人6个月内向国家药品认证中心提出申请
国家药品认证中心30日内完成生产现场检查,
同时抽取1批样品
10日内《生产现场检查报告》寄送
样品送省药检所检验,30工作日,药检报告寄送CDE
CDE
CDE完成审评,提出技术审评意见,送国家食品药品监督管理局(SFDA)审批
改变剂型不改变给药途径,
向制剂,缓释,控释制剂等 特殊剂型除外。 SFDA审批(30工作日)
符合规定的发给新药证书
申请人已持有《药品生产许可证》的,同时发给药品批准文号
增加新适应症不属新药,靶
化学药品申报资料要求
化学药品申报资料包括综述资料、药学研究资料、药理毒理研究资料、临床试验资料四部分,共1~32号,不同注册分类的药品,所需资料要求不同,一般的规律是,1~6类,资料及临床试验要求依次降低,参见《申报资料项目表》。另外,报临床的资料与报生产资料要求也不同,具体要求见“三、申报资料项目表及说明/(二)说明”。
以下是资料项目及每号资料要求
一、申报资料项目
(一)综述资料
1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
(二)药学研究资料
7.药学研究资料综述。
8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。
9.确证化学结构或者组份的试验资料及文献资料。
10.质量研究工作的试验资料及文献资料。
11.药品标准及起草说明,并提供标准品或者对照品。
12.样品的检验报告书。
13.原料药、辅料的来源及质量标准、检验报告书。
14.药物稳定性研究的试验资料及文献资料。
15.直接接触药品的包装材料和容器的选择依据及质量标准。
(三)药理毒理研究资料
16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
19.急性毒性试验资料及文献资料。
20.长期毒性试验资料及文献资料。
21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。
22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。
23.致突变试验资料及文献资料。
24.生殖毒性试验资料及文献资料。
25.致癌试验资料及文献资料。
26.依赖性试验资料及文献资料。
27.非临床药代动力学试验资料及文献资料。
(四)临床试验资料
28.国内外相关的临床试验资料综述。
29.临床试验计划及研究方案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告。
二、申报资料项目说明
1.资料项目1药品名称:包括通用名、化学名、英文名、汉语拼音,并注明其化学结构式、分子量、分子式等。新制定的名称,应当说明命名依据。
2.资料项目2证明性文件:
(1)申请人机构合法登记证明文件(营业执照等)、《药品生产许可证》及变更记录页、《药品生产质量管理规范》认证证书复印件,申请生产时应当提供样品制备车间的《药品生产质量管理规范》认证证书复印件;
(2)申请的药物或者使用的处方、工艺、用途等专利情况及其权属状态说明,以及对他人的专利不构成侵权的声明;
(3)麻醉药品、精神药品和放射性药品需提供研制立项批复文件复印件;
(4)完成临床试验后申报生产时应当提供《药物临床试验批件》复印件及临床试验用药的质量标准;
(5)申请制剂的,应提供原料药的合法来源证明文件,包括原料药的批准证明文件、药品标准、检验报告、原料药生产企业的营业执照、《药品生产许可证》、《药品生产质量管理规范》认证证书、销售#5@p、供货协议等的复印件;
(6)直接接触药品的包装材料和容器的《药品包装材料和容器注册证》或者《进口包装材料和容器注册证》复印件。
3.资料项目3立题目的与依据:包括国内外有关该品研发、上市销售现状及相关文献资料或者生产、使用情况,制剂研究合理性和临床使用必需性的综述。
4.资料项目4对研究结果的总结及评价:包括申请人对主要研究结果进行的总结,并从安全性、有效性、质量可控性等方面对所申报品种进行综合评价。
5.资料项目5药品说明书、起草说明及相关参考文献:包括按有关规定起草的药品说明书、说明书各项内容的起草说明、相关文献。
6.资料项目7药学研究资料综述:是指所申请药物的药学研究(合成工艺、剂型选择、处方筛选、结构确证、质量研究和质量标准制定、稳定性研究等)的试验和国内外文献资料的综述。
7.资料项目8原料药生产工艺的研究资料:包括工艺流程和化学反应式、起始原料和有机溶媒、反应条件(温度、压力、时间、催化剂等)和操作步骤、精制方法、主要理化常数及阶段性的数据积累结果等,并注明投料量和收得率以及工艺过程中可能产生或引入的杂质或其他中间产物,尚应包括对工艺验证的资料。
制剂处方及工艺研究资料:应包括起始物料、处方筛选、生产工艺及验证资料。
8.资料项目10质量研究工作的试验资料及文献资料:包括理化性质、纯度检查、溶出度、含量测定及方法学验证及阶段性的数据积累结果等。
9.资料项目11药品标准及起草说明,并提供标准品或者对照品:质量标准应当符合《中国药典》现行版的格式,并使用其术语和计量单位。所用试药、试液、缓冲液、滴定液等,应当采用现行版《中国药典》收载的品种及浓度,有不同的,应详细说明。提供的标准品或对照品应另附资料,说明其来源、理化常数、纯度、含量及其测定方法和数据。
药品标准起草说明应当包括标准中控制项目的选定、方法选择、检查及纯度和限度范围等的制定依据。
10.资料项目12样品的检验报告书:指申报样品的自检报告。临床试验前报送资料时提供至少1批样品的自检报告,完成临床试验后报送资料时提供连续3批样品的自检报告。
11.资料项目14药物稳定性研究的试验资料:包括影响因素试验、采用直接接触药物的包装材料和容器共同进行的稳定性试验。
12.资料项目16药理毒理研究资料综述:是指所申请药物的药理毒理研究(包括药效学、作用机制、一般药理、毒理、药代动力学等)的试验和国内外文献资料的综述。
13.资料项目27非临床药代动力学试验资料及文献资料:是指所申请药物的体外和体内(动物)药代动力学(吸收、代谢、分布、排泄)试验资料和文献资料。
14.资料项目28国内外相关的临床试验资料综述:是指国内外有关该品种临床试验的文献、摘要及近期追踪报道的综述。
15.资料项目29临床试验计划及研究方案:临床试验计划及研究方案应对拟定的适应症、用法用量等临床试验的重要内容进行详细描述,并有所报送的研究资料支持。临床试验计划及研究方案应科学、完整,并有对与拟定试验的潜在风险和收益相关的非临床和临床资料进行的重要分析的综合性摘要。
16.资料项目30临床研究者手册:是指所申请药物已有的临床试验资料和非临床试验资料的摘要汇编,目的是向研究者和参与试验的其他人员提供资料,帮助他们了解试验药物的特性和临床试验方案。研究者手册应当简明、客观。
三、申报资料项目表及说明
(一)申报资料项目表
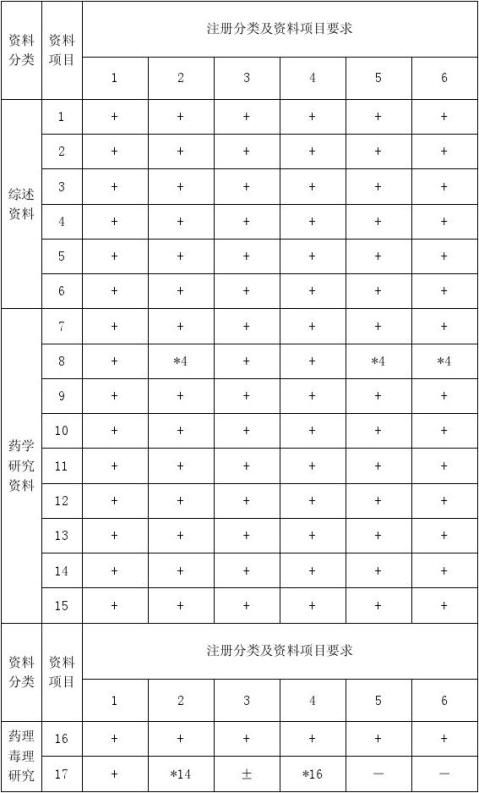
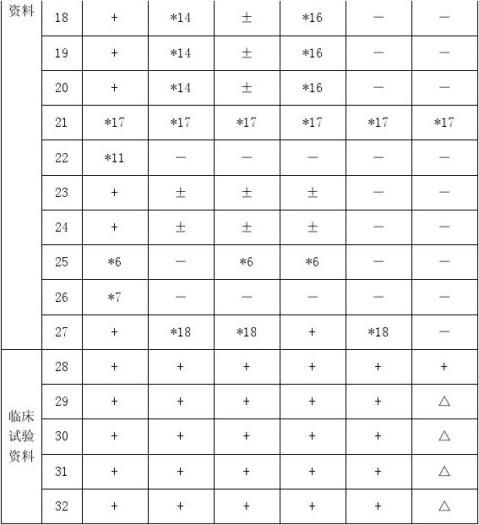
注:1.“+”指必须报送的资料和/或试验资料。 2.“±”指可以用文献资料代替试验资料。 3.“-”指可以无需提供的资料。
4.“*”指按照说明的要求报送资料,如*6,指见说明之第6条。 5.“△”指按照本附件“五、临床试验要求”中第4条执行。
6.文献资料为所申请药物的各项药理毒理(包括药效学、作用机制、一般药理学、毒理学、药代动力学等)研究的文献资料和/或其文献综述资料。
(二)说明
1.申请注册分类1~5的品种,按照《申报资料项目表》的要求报送资料项目1~30(资料项目6除外);临床试验完成后报送的资料项目包括重新整理的综述资料1~6、资料项目12和14、临床试验资料28~32以及重新整理的与变更相关的资料和补充的资料,并按申报资料项目顺序排列。
对于注册分类1的品种,临床试验完成后应根据临床期间进行的各项研究的结果,重新
整理报送资料项目1~30的全部资料。
同时申请注册属于注册分类3的原料药和属于注册分类6的制剂的,其原料药的注册申请应当符合申报生产的要求。
2.申请注册分类6的药品,按照《申报资料项目表》的要求报送资料项目1~16和28~
30。需进行临床试验的,在临床试验完成后报送资料项目28~32以及其他变更和补充的资料,并按申报资料项目顺序排列。
3.申请注册分类6的药品,应根据品种的工艺、处方进行全面的质量研究,按国家标准与已上市产品进行质量对比研究。无法按照国家标准与已上市产品进行质量对比研究的,应按照新药的要求进行质量研究,必要时对国家药品标准项目进行增订和/或修订。
4.单独申请注册药物制剂,必须提供原料药的合法来源证明文件,一式2份,分别放入资料项目2的资料(证明性文件)和资料项目13号的资料(原料药、辅料的来源及质量标准、检验报告书)中。使用国产原料药的申请人,应当提供该原料药的药品批准证明文件、检验报告书、药品标准、原料药生产企业的营业执照、《药品生产许可证》、《药品生产质量管理规范》认证证书、与该原料药生产企业签订的供货协议、销售#5@p等的复印件。使用进口原料药的,应当提供与该原料药生产企业或国内合法的销售代理商签订的供货协议、《进口药品注册证》或者《医药产品注册证》、口岸药品检验所检验报告书、药品标准复印件等。药品注册过程中,研制制剂所用的进口原料药未取得《进口药品注册证》或者《医药产品注册证》的,必须经国家食品药品监督管理局批准。
5.对用于育龄人群的药物,应当根据其适应症和作用特点等因素报送相应的生殖毒性研究资料。
6.对于临床预期连续用药6个月以上(含6个月)或治疗慢性复发性疾病而需经常间歇使用的药物,均应提供致癌性试验或文献资料;对于下列情况的药物,需根据其适应症和作用特点等因素报送致癌试验或文献资料:
(1)新药或其代谢产物的结构与已知致癌物质的结构相似的;
(2)在长期毒性试验中发现有细胞毒作用或者对某些脏器、组织细胞生长有异常促进作用的;
(3)致突变试验结果为阳性的。
7.作用于中枢神经系统的新药,如镇痛药、抑制药、兴奋药以及人体对其化学结构具有依赖性倾向的新药,应当报送药物依赖性试验资料。
8.属注册分类1的,一般应在重复给药毒性试验过程中进行毒代动力学研究。
9.属注册分类1中“用拆分或合成等方法制得的已知药物中的光学异构体及其制剂”,应当报送消旋体与单一异构体比较的药效学、药代动力学和毒理学(一般为急性毒性)等反映其立题合理性的研究资料或者相关文献资料。在其消旋体安全范围较小、已有相关资料可能提示单一异构体的非预期毒性(与药理作用无关)明显增加时,还应当根据其临床疗程和剂量、适应症以及用药人群等因素综合考虑,提供与消旋体比较的单一异构体重复给药毒性(一般为3个月以内)或者其他毒理研究资料(如生殖毒性)。
10.属注册分类1中“由已上市销售的多组份药物制备为较少组份的药物”,如其组份中不含本说明6所述物质,可以免报资料项目23~25。
11.属注册分类1中“新的复方制剂”,应当报送资料项目22。
12.属注册分类1中“新的复方制剂”,一般应提供与单药比较的重复给药毒性试验资料,如重复给药毒性试验显示其毒性不增加,毒性靶器官也未改变,可不提供资料项目27。
13.属注册分类1中“新的复方制剂”,如其动物药代动力学研究结果显示无重大改变的,可免报资料项目23~25。
14.属注册分类2的,其药理毒理研究所采用的给药途径应当与临床拟用途径一致。一般情况下应当提供与原途径比较的药代动力学试验和/或相关的毒理研究资料(如重复给药毒性试验和/或局部毒性试验)。
15.属注册分类3中“改变给药途径,已在境外上市销售的制剂”,应当重视制剂中的辅料对药物吸收或者局部毒性的影响,必要时提供其药代动力学试验或者相关毒理研究资料。
16.属注册分类4的,应当提供与已上市销售药物比较的药代动力学、主要药效学、一般药理学和急性毒性试验资料,以反映改变前后的差异,必要时还应当提供重复给药毒性和其他药理毒理研究资料。如果改变已上市销售盐类药物的酸根、碱基(或者金属元素)而制成的药物已在国外上市销售,则按注册分类3的申报资料要求办理。
17.局部用药除按所属注册分类及项目报送相应资料外,应当报送资料项目21,必要时应当进行局部吸收试验。
18.对于存在明显安全性担忧(如安全性范围比较小、给药剂量明显增加)的缓、控释制剂,一般应当提供与已上市缓控释制剂或常释制剂比较的单次给药的动物药代动力学研究资料。
化学药物临床试验要求
1.属注册分类1和2的,应当进行临床试验。
(1)临床试验的病例数应当符合统计学要求和最低病例数要求;
(2)临床试验的最低病例数(试验组)要求:
I期为20至30例,II期为100例,III期为300例,IV期为2000例。
(3)避孕药的I期临床试验应当按照本办法的规定进行;II期临床试验应当完成至少100
对6个月经周期的随机对照试验;III期临床试验完成至少1000例12个月经周期的开放试验;IV期临床试验应当充分考虑该类药品的可变因素,完成足够样本量的研究工作。
2.属注册分类3和4的,应当进行人体药代动力学研究和至少100对随机对照临床试验。多个适应症的,每个主要适应症的病例数不少于60对。避孕药应当进行人体药代动力学研究和至少500例12个月经周期的开放试验。
属于下列二种情况的,可以免予进行人体药代动力学研究:
(1)局部用药,且仅发挥局部治疗作用的制剂;
(2)不吸收的口服制剂。
3.属注册分类5的,临床试验按照下列原则进行:
(1)口服固体制剂应当进行生物等效性试验,一般为18至24例;
(2)难以进行生物等效性试验的口服固体制剂及其他非口服固体制剂,应当进行临床
试验,临床试验的病例数至少为100对;
(3)缓释、控释制剂应当进行单次和多次给药的人体药代动力学的对比研究和必要的
治疗学相关的临床试验,临床试验的病例数至少为100对;
(4)注射剂应当进行必要的临床试验。需要进行临床试验的,单一活性成份注射剂,
临床试验的病例数至少为100对;多组份注射剂,临床试验的病例数至少为300例(试验药);脂质体、微球、微乳等注射剂,应根据注册分类1和2的要求进行临床试验。
4.对于注册分类6中的口服固体制剂,应当进行生物等效性试验,一般为18至24例。 需要用工艺和标准控制药品质量的,应当进行临床试验,临床试验的病例数至少为100对。
5.减免临床试验的申请,应当在申请药品注册时一并提出,并详细列出减免临床试验的理由及相关资料。对于已批准进行临床试验的,除《药品注册管理办法》规定可以减免临床试验
的情况外,一般不再批准减免试验。如完成临床试验确有困难的,申请人应当提出申请,详细说明减免临床试验的依据和方案,从临床统计学、试验入组病人情况等各个方面论证其合理性。
6.临床试验对照药品应当是已在国内上市销售的药品。对必须要从国外购进的药品,需经国家食品药品监督管理局批准,并经口岸药品检验所检验合格方可用于临床试验。临床试验阳性对照药品的选择一般应按照以下顺序进行:
(1)原开发企业的品种;
(2)具有明确临床试验数据的同品种;
(3)活性成份和给药途径相同,但剂型不同的品种;
(4)作用机制相似,适应症相同的其他品种。
