一、有机物的概念
1、定义:含有碳元素的化合物为有机物(碳的氧化物、碳酸、碳酸盐、碳的金属化合物等除外)
2、特性:①种类多 ②大多难溶于水,易溶于有机溶剂 ③易分解,易燃烧 ④熔点低,难导电、大多是非电解质 ⑤反应慢,有副反应(故反应方程式中用“→”代替“=”)
二、烃—碳氢化合物:仅有碳和氢两种元素组成
1、甲烷,组成最简单的烃,物理性质:无色、无味的气体,极难溶于水,密度小于空气,俗名:沼气、坑气
2、分子结构:CH4:以碳原子为中心, 四个氢原子为顶点的正四面体(键角:109度28分)
3、化学性质:①氧化反应:CH4 + 2O2 → CO2 + 2H2O
甲烷与KMnO4不发生反应,所以不能使紫色KMnO4溶液褪色
②取代反应: CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 →CH2Cl2 + HCl
CH2Cl2 + Cl2 →CHCl3 + HCl
CHCl3 + Cl2 →CCl4 + HCl
(三氯甲烷又叫氯仿,四氯甲烷又叫四氯化碳,二氯甲烷只有一种结构,说明甲烷是正四面体结构)
4、同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质(所有的烷烃都是同系物)
5、同分异构体:化合物具有相同的分子式,但具有不同结构式(结构不同导致性质不同)
6、烷烃的溶沸点比较:碳原子数不同时,碳原子数越多,溶沸点越高;碳原子数相同时,支链数越多熔沸点越低
三、乙烯
1、乙烯的制法:
工业制法:石油的裂解气(乙烯的产量是一个国家石油化工发展水平的标志之一)
2、物理性质:无色、稍有气味的气体,比空气略轻,难溶于水
3、结构:不饱和烃,分子中含碳碳双键,6个原子共平面,键角为120°
4、化学性质:
(1)氧化反应:C2H4 + 3O2 → 2CO2 + 2H2O (火焰明亮并伴有黑烟)
可以使酸性KMnO4溶液褪色,说明乙烯能被KMnO4氧化,化学性质比烷烃活泼。
(2)加成反应:乙烯可以使溴水褪色,利用此反应除乙烯
乙烯还可以和氢气、氯化氢、水等发生加成反应。
CH2=CH2 + H2 → CH3CH3 CH2=CH2 + HCl → CH3CH2Cl(一氯乙烷)
CH2=CH2 + H2O → CH3CH2OH(乙醇)
(3)聚合反应:n CH2=CH2 → —[—CH2—CH2—]—n
四、苯
1、物理性质:无色有特殊气味的液体,密度比水小,有毒,不溶于水,易溶于有机
溶剂,本身也是良好的有机溶剂。
2、苯的结构:C6H6(正六边形平面结构)苯分子里6个C原子之间的键完全相同,碳碳键键能大于碳碳单键键能小于碳碳单键键能的2倍,键长介于碳碳单键键长和双键键长之间,键角120°。
3、化学性质
(1)氧化反应 2C6H6 + 15O2 → 12CO2 + 6H2O (火焰明亮,冒浓烟)
不能使酸性高锰酸钾褪色
(2)取代反应
① + Br2 + HBr
铁粉的作用:与溴反应生成溴化铁做催化剂;溴苯无色密度比水大
② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、密度大于水、有毒的油状液体——硝基苯。
+ HONO2 + H2O
反应用水浴加热,控制温度在50—60℃,浓硫酸做催化剂和脱水剂。
(3)加成反应
用镍做催化剂,苯与氢发生加成反应,生成环己烷。
+ 3H2 (也可以和氯气加成生成六六六,一种农药)
五、乙醇
1、物理性质:无色有特殊香味的液体,密度比水小,与水以任意比互溶
如何检验乙醇中是否含有水:加无水硫酸铜;
如何得到无水乙醇:加生石灰,蒸馏
2、结构: CH3CH2OH(含有官能团:羟基 -OH)
3、化学性质
(1)乙醇与金属钠的反应:2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑(取代反应)
(2) 乙醇的氧化反应
①乙醇的燃烧:CH3CH2OH + 3O2 → 2CO2 + 3H2O
②乙醇的催化氧化反应: 2CH3CH2OH + O2 → 2CH3CHO + 2H2O
③乙醇被强氧化剂氧化反应 高锰酸钾等
羟基直接被氧化为羧基 CH3CH2OH → CH3COOH
六、乙酸(俗名:醋酸)
1、物理性质:常温下为无色有强烈刺激性气味的液体,易结成冰一样的晶体,所以纯净的乙酸又叫冰醋酸,与水、酒精以任意比互溶
2、结构:CH3COOH(含羧基,可以看作由羰基和羟基组成)
3、乙酸的重要化学性质
(1) 乙酸的酸性:弱酸性,但酸性比碳酸强,具有酸的通性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
2CH3COOH+CaCO3 (CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2) 乙酸的酯化反应
(酸脱羟基,醇脱氢,酯化反应属于取代反应)
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。在实验时用饱和碳酸钠吸收,目的是为了吸收挥发出的乙醇和乙酸,降低乙酸乙酯的溶解度;反应时要用冰醋酸和无水乙醇,浓硫酸做催化剂和吸水剂
化学与可持续发展
一、金属矿物的开发利用
1、常见金属的冶炼:①加热分解法:②加热还原法:铝热反应 ③电解法:电解氧化铝
2、金属活动顺序与金属冶炼的关系:
金属活动性序表中,位置越靠后,越容易被还原,用一般的还原方法就能使金属还原;金属的位置越靠前,越难被还原,最活泼金属只能用最强的还原手段来还原。(离子)
二、海水资源的开发利用
1、海水的组成:含八十多种元素。
其中,H、O、Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等总量占99%以上,其余为微量元素;特点是总储量大而浓度小
2、海水资源的利用:
(1)海水淡化: ①蒸馏法;②电渗析法; ③离子交换法; ④反渗透法等。
(2)海水制盐:利用浓缩、沉淀、过滤、结晶、重结晶等分离方法制备得到各种盐。
三、环境保护与绿色化学
绿色化学理念 核心:利用化学原理从源头上减少和消除工业生产对环境造成的污染。又称为“环境无害化学”、“环境友好化学”、“清洁化学”。
从环境观点看:强调从源头上消除污染。(从一开始就避免污染物的产生)
从经济观点看:它提倡合理利用资源和能源,降低生产成本。(尽可能提高原子利用率)
热点:原子经济性——反应物原子全部转化为最终的期望产物,原子利用率为100%
高中化学(人教版)必修二相关化学方程式汇总
第一章 物质结构 元素周期律
1、Li与O2反应(点燃): 4Li + O2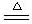 2Li2 O
2Li2 O
Na与O2反应(点燃): 2Na+O2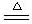 Na2O2
Na2O2
2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应:
F2 + H2 === 2HF Cl2 + H2=== 2HCl
Br2 + H2=== 2Br I2 + H2=== 2HI
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:
① Cl2+2NaBr===Br2+2NaCl
② Cl2+2NaI===I2+2NaCl
(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr
4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑
Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑
Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑
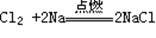 5、Na与Cl2反应(点燃):
5、Na与Cl2反应(点燃):
6、用电子式表示氯化氢的形成过程: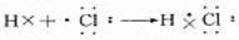
第二章 化学反应与能量
1、Ba(OH)2?8H2O与NH4Cl的反应 :
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
2、原电池原理
典型的原电池(Zn-Cu原电池)
负极(锌):Zn-2e-===Zn2+(氧化反应)
正极(铜):2H++2e-===H2↑(还原反应)
电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn+2H+===Zn2++H2↑
3、H2O2在催化剂作用下受热分解: 2H2O2  2H2O+O2↑
2H2O+O2↑
4、Na2SO4与CaCl2反应:Na2SO4+CaCl2===CaSO4↓+Na2CO3
5、高炉炼铁:2C + O2 === 2CO Fe2O3 + 3CO ==2Fe + 3CO2
第三章 有机化合物
1、甲烷的主要化学性质
(1)氧化反应(与O2的反应):CH4(g)+2O2(g) CO2(g)+2H2O(l)
CO2(g)+2H2O(l)
(2)取代反应(与Cl2在光照条件下的反应,生成四种不同的取代物):
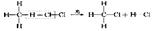

2、乙烯的主要化学性质
(1)氧化反应(与O2的反应):C2H4+3O2 2CO2+2H2O
2CO2+2H2O
(2)加成反应((与Br2的反应): 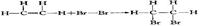
(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:
CH2=CH2 + H2 CH3CH3
CH3CH3
CH2=CH2+HCl CH3CH2Cl(一氯乙烷)
CH3CH2Cl(一氯乙烷)
CH2=CH2+H2O CH3CH2OH(乙醇)
CH3CH2OH(乙醇)
(4)聚合反应:
 (乙烯制聚乙烯)①
(乙烯制聚乙烯)①
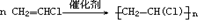 (氯乙烯制聚氯乙烯)②
(氯乙烯制聚氯乙烯)②
3、苯的主要化学性质:
(1)氧化反应(与O2的反应):2C6H6+15O2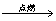 12CO2+6H2O
12CO2+6H2O
(2)取代反应:

 ① 与Br2的反应: + Br2
① 与Br2的反应: + Br2 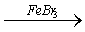 + HBr
+ HBr
② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。反应方程式:

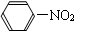 + HONO2
+ HONO2  + H2O
+ H2O
(3)加成反应

 用镍做催化剂,苯与氢发生加成反应: + 3H2
用镍做催化剂,苯与氢发生加成反应: + 3H2 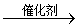
4、乙醇的重要化学性质
(1)乙醇与金属钠的反应:2CH3CH2OH+2Na 2CH3CH2ONa+H2↑
2CH3CH2ONa+H2↑
(2)乙醇的氧化反应
①乙醇的燃烧: CH3CH2OH+3O2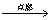 2CO2+3H2O
2CO2+3H2O
②乙醇的催化氧化反应: 2CH3CH2OH+O2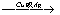 2CH3CHO+2H2O
2CH3CHO+2H2O
③乙醇在常温下的氧化反应:
CH3CH2OH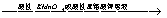 CH3COOH
CH3COOH
5、乙酸的重要化学性质
(1)乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
2CH3COOH+CaCO3 (CH3COO)2Ca+H2O+CO2↑
(CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2↑
2CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2)乙酸的酯化反应
①反应原理(与乙醇的反应):
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
6、①蔗糖水解反应:C12H22O11+H2O→C6H12O6+C6H12O6
②淀粉(纤维素)水解反应: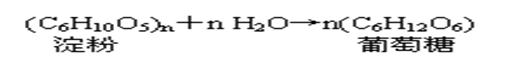
③油脂的重要化学性质——水解反应:
a)油脂在酸性条件下的水解:油脂+H2O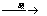 甘油+高级脂肪酸
甘油+高级脂肪酸
b)油脂在碱性条件下的水解(又叫皂化反应):
油脂+H2O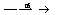 甘油+高级脂肪酸
甘油+高级脂肪酸
蛋白质+H2O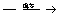 各种氨基酸
各种氨基酸
第四章 化学与可持续发展
1、HgO受热分解:2HgO 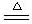 2Hg + O2↑
2Hg + O2↑
Ag2O受热分解:2Ag2O 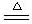 4Ag + O2↑
4Ag + O2↑
2、CO还原Fe2O3:Fe2O3 + 3CO  2Fe +3CO2 (高炉炼铁)
2Fe +3CO2 (高炉炼铁)
① C 还原ZnO :2 ZnO + C  2 Zn +CO2↑
2 Zn +CO2↑
② C 还原MgO : MgO +C  Mg + CO↑
Mg + CO↑
③ Al 还原Fe2O3(铝热反应): Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
④ Fe还原CuSO4: CuSO4 + Fe ==== FeSO4 +Cu (湿法炼铜)
3、电解
①电解NaCl:2NaCl(熔融)  2Na +Cl2↑
2Na +Cl2↑
②电解MgCl2: MgCl2(熔融)  Mg +Cl2↑
Mg +Cl2↑
③电解Al2O3: 2Al2O3(熔融)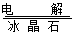 4Al + 3O2↑
4Al + 3O2↑
4、石油的催化裂化
例如:C4H10 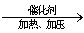 C2H4+ C2H6
C2H4+ C2H6
C16H34 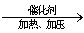 C8H18 +C8H16
C8H18 +C8H16
C8H18 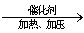 C4H10 +C4H8
C4H10 +C4H8
C4H10 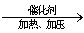 CH4 +C3H6
CH4 +C3H6
C4H10 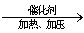 C2H4 +C2H6
C2H4 +C2H6
第二篇:高中化学苏教版必修二方程式总结



