燃烧热的测定
姓名: 学号: 班级:(同组实验者:)
实验日期:提交报告日期:
实验助教:
1 引言
1.1 实验目的
1.熟悉弹式量热计的原理、构造及使用方法。
2.明确恒压燃烧热与恒容燃烧热的差别及相互关系。
3.掌握温差测量的实验原理和技术。
4.学会用雷诺图解法校正温度改变值。
1.2 实验原理[1]
在一定温度及压力下,1mol物质完全燃烧时的定压反应热,称为该物质在此温度下的摩尔燃烧热,记?c?m。通常,完全燃烧指C→CO2(g),H2→H2O(l),S→SO2(g),氮、卤素、银等元素变为游离状态。上述条件下??=??,?c?m即该物质燃烧反应的等压热效应??。
实际测量中,燃烧反应在恒容条件下进行(如在弹式量热计中进行),这样直接测得的是反应的恒容热效应??(即?c?m)。若反应系统中的气体均为理想气体,??和??的关系为
??=??+????
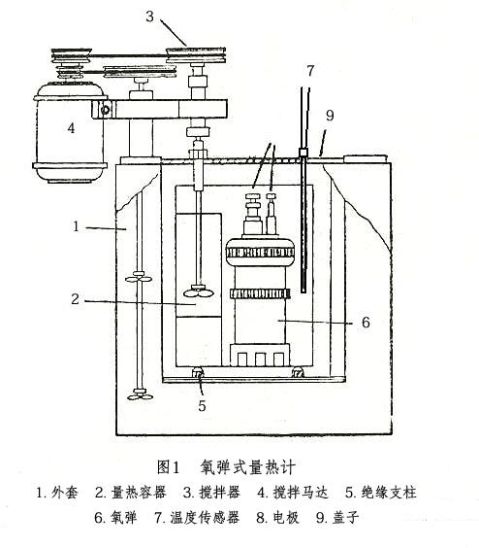
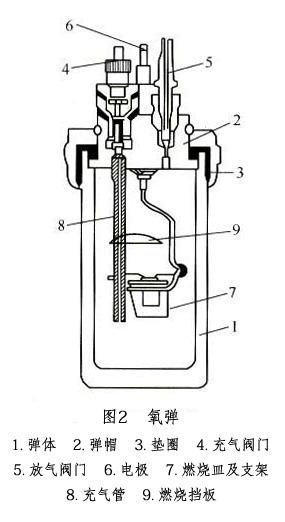
式中:?为反应温度,K;??为反应前后产物与反应物中气体的物质的量差;?为摩尔气体常数。 故通过实验测得??值,根据上式就可计算出??,即燃烧热的值。测量热效应的仪器称量热计,一般测量燃烧热用弹式量热计。本实验所用量热计和氧弹结构如图1、图2。实验过程中外水套保持恒温,内水桶与外水套之间以空气隔热;同时,还对内水桶的外表面进行了电抛光。内水桶连同其中的氧弹、测温器件、搅拌器和水近似构成一个绝热体系。
弹式量热计的基本原理是能量守恒定律。样品完全燃烧释放的能量使氧弹及其周围的介质和量热计有关附件的温度升高。测量介质在燃烧前后的变化值,可求算样品的恒容燃烧热。
??=???????棉线??棉线???点火线??点火线 r?
式中:?为待测物质量,kg;?r为待测物的摩尔质量,kg/mol;?为仪器常数,kJ/℃(本实验中单位为kJ/mV);??为样品燃烧前后量热计温度的变化值;??棉线、??点火线分别为棉线和点火丝的恒容燃烧热(-16736kJ/kg和-3243kJ/kg);?棉线、?点火线分别为棉线和点火丝的质量,kg。
先燃烧已知燃烧热的物质(如苯甲酸),标定仪器常数?,再燃烧未知物质,可由上式计算出未知物的恒容摩尔燃烧热,进而计算出摩尔燃烧热。
2 实验操作
2.1 实验药品、仪器型号及测试装置示意图
弹式量热计1套:2000mL容量瓶1个、1000mL容量瓶1个、水盆1个(容量大于3000mL)、压片机,镍丝,棉线,万用表,分析天平,剪刀,氧气瓶及减压阀公用;微机、计算机接口。
萘(AR),苯甲酸(AR)。
装置图见下页图1、图2。
2.2 实验条件
温度:19.4 ℃;湿度:56%;大气压:101.12 kPa。
2.3 实验操作步骤及方法要点
1
1.仪器常数的测定
(1)样品准备
取8cm镍丝和10cm棉线各一根,分别在分析天平上准确称量。
称量0.8g左右的苯甲酸,在压片机上压成片状,取出药片并轻轻去掉粘附在药片上的粉末,用称好的棉线捆绑在药片上,固定好。将镍丝穿入棉线,在分析天平上准确称量。
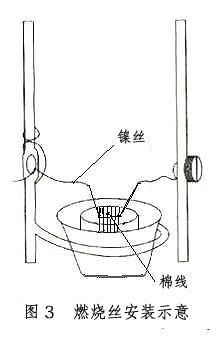
将苯甲酸片上的镍丝固定在氧弹的两根电极上,如图3,用万用表检查是否通路。确认通路后旋紧弹盖,通入1.0MPa氧气。再检查一次是否通路,然后将氧弹放入内水桶,接上点火电极。
(2)仪器准备
打开量热计电源,开动搅拌,将温度传感器置于外水套中,观察温度显示。待
温度稳定后,记下温度。
用水盆接取自来水(大于3000mL),将温度传感器放入水盆中,不断搅动,通
过加入凉水或热水调节水温,使温度低于外水套0.7℃左右(水倒入内桶后水会升温,
实际操作过程中可适当调节使更低,如0.8 ℃)。准确量取3000mL,倒入内桶,盖
上桶盖。
(3) 燃烧测量
将传感器放入内桶并开始搅拌,打开计算机,运行“数据采集程序”。点击“开
始”,开始记录体系温度。体系稳定后(所记录温度信号不波动),再记录约2 min,
点火。体系温度迅速上升,趋于稳定后,再记录约5 min左右。取出温度传感器放
入外水套中,记录外水套温度约2 min左右。点击“完成”、“存盘”保存数据。
切断量热计电源,取出氧弹,放出其中气体。打开氧弹,检查样品是否燃烧完全。若燃烧完全,将剩余镍丝取下称量(注意去除顶端熔融小球,这类小球可轻易去除);若未燃烧完全则应重新测量。
2. 未知物测量
取0.6 g左右的萘,按上述步骤进行,注意记录最后稳定时外水套水温。
3. 数据处理
打开数据处理程序,点击“燃烧焓测定”。按“打开”调出燃烧曲线,移动光标选择适当位置,作雷诺校正,计算出峰高??。标定物和未知物曲线均处理完后,将相关数据填入数据栏,按“数据处理”,即可得被测物样品的燃烧热(不准确,需要另行处理)。
4. 整理仪器
2
3 结果与讨论
3.1 原始实验数据
实验数据如下表1,并由计算机获得电压随时间变化的数据。
萘测量结束后的外水套水温为21.400 ℃。
表1 苯甲酸和萘的实验结果
测量物质
药品称量质量/g
棉线质量/g
燃烧前镍丝质量/g
药片、棉线、镍丝总质量/g
燃烧后镍丝质量/g
苯甲酸 0.8023 0.0205 0.0504 0.7747 0.0434 萘 0.5961 0.0185 0.0512 0.6624 0.0473 1. 仪器常数的测定
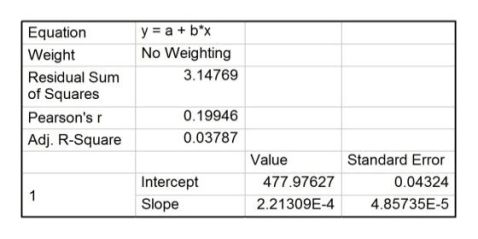
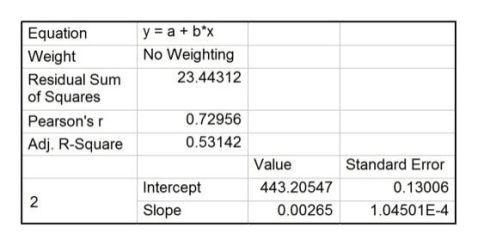
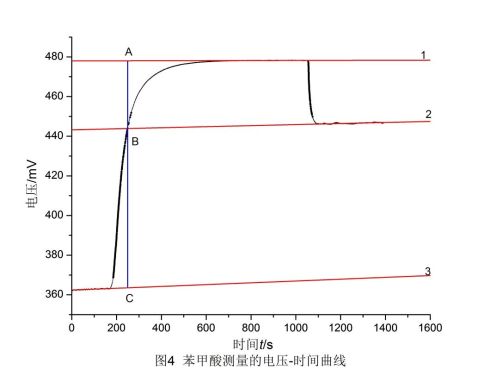
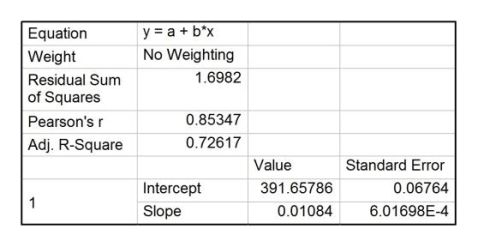
利用origin软件,由实验所记录的电压、时间数据可作出苯甲酸的电压-时间曲线,并作雷诺校正,如图4,直线1、2、3为校正直线。
从图中可读出:A点电压478.0 mV,B点电压443.9 mV,C点电压363.5 mV。
苯甲酸燃烧的反应方程式为(101.325 kPa,298.15 K下)
15O g →7CO2 g +3H2O l ,?c?m=?3226.0 kJ/mol 2
则苯甲酸的298.15 K下的恒容燃烧热
??=???????=?3224.8 kJ/mol C6H5COOH s +
由
??=???????棉线??棉线???点火线??点火线 r?
??=????
?
=
114.5 mV
近似的认为??值与温度无关,求得仪器常数
3
?=?166.74 J/mV
2. 萘燃烧热的测定
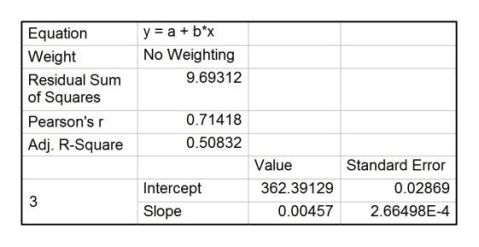
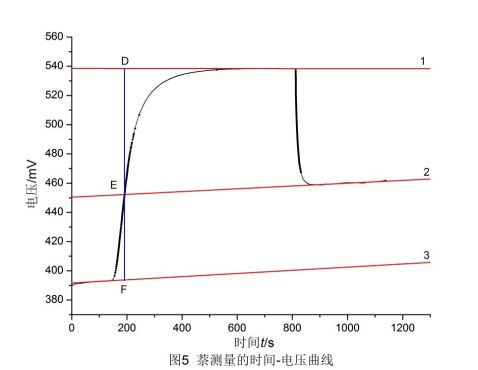
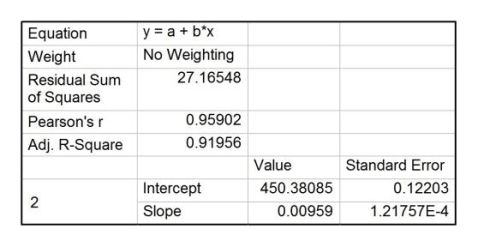
利用origin软件,作出苯甲酸的电压-时间曲线,并作雷诺校正,如图5,直线1、2、3为校正直线。
图中可读出:D点电压538.5 mV,E点电压452.2 mV,F点电压393.7 mV。
由
??=???????棉线??棉线???点火线??点火线 r?
??=?D??F=144.8 mV
可计算出萘的恒容燃烧热
??=?5151.4 kJ/mol
萘燃烧的反应方程式为
C10H8 s +12O2 g →10CO2 g +4H2O l
?=21.400+273.15=294.55 K
则实验条件下的恒压燃烧热
??=??+????=?5156.3 kJ/mol
或
??=?40230 kJ/kg
给出101.325 kPa,298.15 K条件下萘的燃烧热
?c?m=?5153.9 kJ/mol
计算出绝对误差为?2.4 kJ/mol,相对误差为0.05%,误差极小。
3.3 讨论分析
1. 实验中应注意水温的调节,由于水倒入内桶后水会升温,调节时时中可将水温控制在0.8 ℃,但不能过低,否则对实验曲线有影响,实验曲线最后的平台部分最好处于中间位置,这样误差较小。测量苯甲酸时所的曲线就略差一些,水温调节的过低。
2. 在计算过程中我们忽略了温度对燃烧热的影响,若精确考虑需要利用Kirchhoff公式进行校正:
4
?r?m ?2 =?r?m ?1 + ?r??,md?
?1?2
式中:?r??,m表示发生1 mol 反应时所引起的热容变化,即产物与反应物的热容差。
计算时,需要先将苯甲酸的燃烧焓值校正到实验温度下,在标定仪器常数,计算出实验温度下萘的燃烧热后再用上式校正到298.15 K下,再与标准值作比较。
3. 实验中可能的误差来源有:缠棉线和镍丝时药品可能出现掉落、损失;称量时镍丝顶端熔融小球是否去除;充氧气时药品的损失或线路的短路和断路等。
4 结论
用已知苯甲酸测量标定的仪器常数为?=?166.74 J/mV,进而测得萘的燃烧热为?5156.3 kJ/mol,与标准值?c?m=?5153.9 kJ/mol相比,绝对误差为?2.4 kJ/mol,相对误差为0.05%。
5 参考文献
[1] 贺德华,麻英,张连庆.《基础物理化学实验》.北京:高等教育出版社,2008.21-28.
6 附录
思考题
1.本实验中如何考虑系统与环境?系统与环境通过哪些途径进行热交换?这些热交换对结果影响怎样?如何校正?
答:系统是量热器内筒,即内水桶连同其中的氧弹、测温器件、搅拌器和水,它们近似构成一个绝热体系;环境为内筒之外的空间。系统与环境通过热辐射、热传导进行热交换,损失一部分热量。
在标定仪器常数时,由于认为不存在热交换,实际测量的电压差值偏小,即仪器常数测量的大小将偏大,测量的燃烧热大小偏小。实验中采用雷诺图解法校正。
2.使用氧气应注意那些问题?
答:(1)尽可能远离热源;
(2)在使用时特别注意在手上、工具上、钢瓶和周围不能占有油脂。扳子上的油可用酒精洗去,待干后再使用,以防爆炸和燃烧;
(3)氧气瓶应与应氧气表一齐使用,不能随便用在其他钢瓶上;
(4)开阀门及调压时,人不要站在钢瓶出气口,头不要在瓶头之上,而应在侧面;
(5)开氧气瓶总阀之前,必须检查氧气表调节阀门是否处于关闭。不要在调节阀处于打开状态时,突然打开气瓶总阀。
(6)钢瓶内压力在10个大气压以下则不能再用,应当灌气。
3.搅拌过快或过慢有何影响?
答:搅拌过快会加快热量散失,使得燃烧热测量大小结果偏低。搅拌过慢又不利于反应热量的扩散,体系内部温度不均匀,影响结果准确性。
4.氧弹中含有氮气,燃烧后生成HNO3。对结果有何影响?如何校正?
答:在氧弹内,N2和O2化合生成硝酸,并溶进水中,这些作用都会引起体系温度的升高,使燃烧热测量大小结果偏大。为了精确测量,应当在装氧弹时加1mL的蒸馏水于氧弹中,燃烧后将弹体用蒸馏水清洗,用0.1 mol/L的NaOH溶液滴定。每毫升的NaOH滴定液相当于5.99 J的热量,计算热量大小时减去之即可。
5.如果反应完后,剩余镍丝丢失,可不可以忽略,为什么?
答:镍丝的燃烧热大小比样品的燃烧热小10倍以上,而镍丝的质量相对于样品质量又极小,基本可忽略。
5
第二篇:燃烧热的测定
燃烧热的测定
一、实验目的
1、掌握燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别及相互关系;
2、熟悉热量计中主要部分的原理和作用,掌握氧弹热量计的实验技术;
3、用氧弹热量计测定苯甲酸和萘的燃烧热;
4、学会雷诺图解法校正温度改变值。
二、实验原理
1、燃烧与量热:根据热化学的定义,1mol物质完全氧化时的反应热称作燃烧热,燃烧的测定可以用于求算化合物的生成热、键能等。量热法是热力学的一种基本试验方法。在恒容或恒压条件下可以分别测得恒容燃烧热Qv和恒压燃烧热Qp。有热力学第一定律可知,Qv等于体积内能变化△U;Qp等于其焓变△H。若把参加反应的气体和反应生成的气体都作为理想气体处理,则它们之间存在以下关系:△H=△U+△(PV), Qp=Qv+△nRT
式中△n为反应前后反应物和生成物中气体的物质的量之差;R为摩尔气体常数;T为反应时的热力学温度。本实验所用的氧弹热量计是一种环境恒温式的热量计。
2、氧弹热量计:氧弹热量计的基本原理是能量守恒定律。样品完全燃烧后所释放的能量使得氧弹本身及其周围的介质和热量计有关附件的温度升高,则测量介质在燃烧前后体系温度的变化值,就可求算该样品的恒容燃烧热。关系式为:(m样/M)Qv +l?Ql=Cj水△T
式中m和M分别为样品的质量和摩尔质量;Qv为样品的恒容燃烧热;l和Ql是引燃用镍铬丝的质量和单位质量的燃烧热;Cj称为热量计的水当量,即热量
计升高1℃所需的热量;△T为样品燃烧前后水温的变化。
3、雷诺温度校正图:实际上,热量计与周围环境的热交换无法完全避免,它对温度测量值的影响可用雷诺温度校正图校正。具体方法为:称取适量待测物质,估计其燃烧热后可使水温上升1.5-2.0℃。预先调节内桶水温使其低于外桶夹套水温1.0℃左右。按操作步骤进行测定,将燃烧前后观察所得的一系列内桶水温和时间关系作图。本实验采用数字式精密温差测量仪来测量温度差。
三、实验仪器以及试剂
氧弹量热计、数字是精密温差测量仪、氧气钢瓶、氧气减压阀、压片机、塑料桶、剪刀、容量瓶(1000ml,2000ml)、万用表、案秤(10kg)、秒表、分析天平、引燃专用镍铬丝、苯甲酸(A.R.)、萘(A.R.)
四、实验步骤
1、测定热量计的水当量
1.1 样品制作:用天平称取大约1.15g左右的苯甲酸,在压片机上稍用力压成圆片。用镊子将样品在干净的称量之上轻击三次,除去表面松散粉末后再用分析天平称量,精确至0.0001g。
1.2 装样并充氧气:拧开氧弹盖,将氧弹内部擦干净,尤其是电极部位。测量金属小杯质量后,小心将样品片放置在金属小杯中部。称取约10cm长的引燃镍铬丝,在直径约2mm的万用电表笔上,将引燃镍铬丝的中段绕成螺旋形8圈。将螺旋部分紧贴在样片的表面,两端固定在电极上。旋紧氧弹,将导气口与氧气钢瓶上的减压阀相连接。打开氧气阀门,向氧弹中充入1.2-1.3MPa的氧气。
1.3 调水温并测量:取约40000ml水于塑料盆中,并不断搅拌,用冰块或热水调节水温至比外桶夹套中的水温低约1.0℃。开启精密数字温度温差仪,将测温探头置于外桶测温孔内,至温度变化不大于0.002℃/min时,此温度就记录为环境温度。将氧弹两电极用导线与点火变压器相连接,再将氧弹架放入盛水桶中,固定在氧弹架上。用磅秤准确称取已被调节到低于外桶夹套水温1.0℃的自来水3000ml于内桶。盖上盖子后,将其插入系统,开动搅拌马达。待温度稳定上升后,每隔1min读取一次温度(准确读至0.001℃)。10分钟后,按下变压器上电键通电4-5s点火。自按下电键后,温度读数改为每隔15s一次,直至两次读数差值小于0.005℃,读数间隔恢复为1min一次,继续10分钟后方可停止试验。
1.4 关闭电源后,取出数字式精密温差测试仪的探头,再取出氧弹,用放气帽把氧弹中余气放出。旋开氧弹盖,检查样品是否燃烧完全。氧弹中应没有明显的燃烧残渣,若发现黑色残渣,则应重做实验。称取剩余未燃烧的镍铬丝的重量。最后擦干氧弹和盛水内桶。
2、重复以上的实验步骤。
3、萘的燃烧热测定
称取约0.75g的萘,按上述方法测定。 五、数据处理 表一:
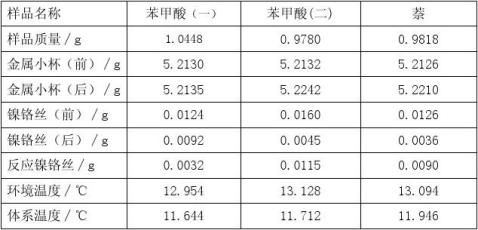
表二: t/min 0 1 2 3 4 5 6 7 8 9 10 10.25 10.5 10.75 11.00 11.25 11.50 11.75 12.00 12.25 12.50 12.75
苯甲酸(一)温
度/℃ 11.644 11.995 12.038 12.053 12.063 12.069 12.074 12.078 12.083 12.086 12.090 12.098 13.102 13.144 13.303 13.471 13.512 13.639 13.694 13.736 13.769 13.797
t/min 0 1 2 3 4 5 6 7 8 9 10 10.25 10.5 10.75 11.00 11.25 11.50 11.75 12.00 12.25 12.50 12.75
苯甲酸(二)温
度/℃ 11.712 11.980 11.989 11.997 12.002 12.008 12.014 12.020 12.025 12.029 12.033 12.058 12.234 12.565 12.962 13.324 13.523 13.686 13.79 13.886 13.92 13.968
t/min 0 1 2 3 4 5 6 7 8 9 10 10.25 10.5 10.75 11.00 11.25 11.50 11.75 12.00 12.25 12.50 12.75
萘温度/℃ 11.946 12.256 12.260 12.264 12.268 12.273 12.278 12.280 12.284 12.286 12.290 12.347 12.536 12.741 13.260 13.442 13.726 13.975 14.177 14.334 14.434 14.510
13.00 13.824 13.00 13.25 13.845 13.25 13.50 13.864 13.50 13.75 13.883 13.75 14.00 13.897 14.00 14.25 13.917 14.25 14.50 13.925 14.50 14.75 13.935 14.75 15.00 13.948 15.00 15.25 13.958 15.25 15.50 13.966 15.50 15.75 13.974 15.75 16.00 13.981 16.00 16.25 13.987 16.25 16.50 13.994 16.50 16.75 13.998 16.75 17.00 14.002 17.00 17.25 14.008 17.25 17.50 14.010 17.50 17.75 14.013 17.75 18 14.015 18 19 14.022 19 20 14.031 20 21 14.035 21 22 14.041 22 23 14.042 23 24 14.044 24 25 14.043 25 26 14.043 26 27 14.042 27 28 14.042 28 29 14.042 29 30 14.041 30 苯甲酸(一)的雷诺温度校正图:14.004 13.00 14.034 13.25 14.059 13.50 14.086 13.75 14.106 14.00 14.123 14.25 14.141 14.50 14.153 14.75 14.166 15.00 14.179 15.25 14.188 15.50 14.198 15.75 14.206 16.00 14.213 16.25 14.221 16.50 14.227 16.75 14.232 17.00 14.236 17.25 14.242 17.50 14.246 17.75 14.249 18 14.260 19 14.267 20 14.271 21 14.269 22 14.270 23 14.271 24 14.260 25 14.260 26 14.259 27 14.259 28 14.258 29 14.257 30 14.562 14.613 14.662 14.682 14.710 14.736 14.756 14.776 14.807 14.820 14.834 14.844 14.854 14.862 14.870 14.877 14.883 14.888 14.894 14.897 14.900 14.914 14.921 14.925 14.927 14.930 14.928 14.927 14.926 14.923 14.923 14.918 14.916
Ⅰ
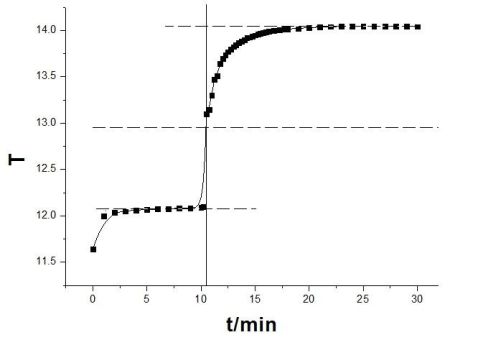
垂直线与三条线段相交于:
点A(10.513,12.061),I(10.512,12.954),B(10.513,14.045) 所以:△T1(苯甲酸一)=14.045-12.061=1.984℃
苯甲酸二的雷诺温度校正图:
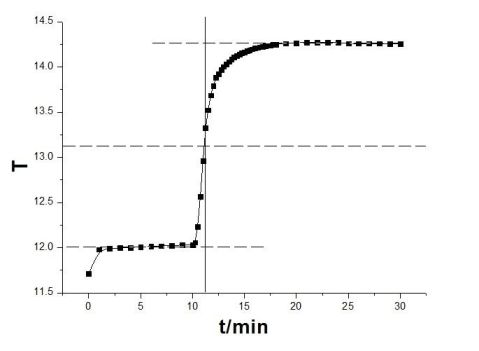
垂直线与三条线段相交于:
点A(11.215,12.316),I(11.215,13.132),B(11.215,14.212) 所以:△T2(苯甲酸二)=14.212-12.316=1.996℃
萘的雷诺温度校正图:
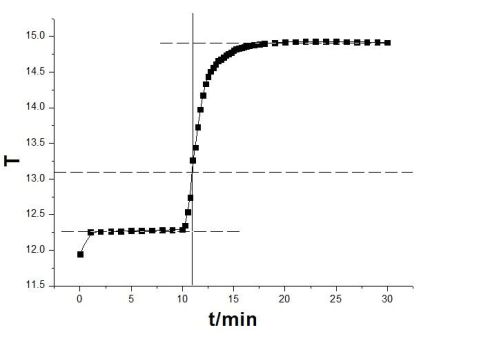
垂直线与三条线段相交于:
点A(10.951,12.252),I(10.951,13.094),B(10.951,14.916) 所以:△T(萘)=14.916-12.252=2.664℃
Ⅱ根据苯甲酸一和苯甲酸二的△T和恒容燃烧热计的平均值算水当量: Qv1 =Qp-△nRT1
=-3226.9-(-0.5)×8.314×286.104×10-3 =-3225.7kJ/mol
Cj水1 =((m样1/M)Qv1 +l?Ql)/△T1
=(-3225.7×1.0448/122.1-1400×10-3×0.0032)/ 1.984
=-14.2 kJ/K
Qv2 =Qp-△nRT2
=-3226.9-(-0.5)×8.314×286.273×10-3 =-3225.7kJ/mol
Cj水2 =((m样2/M)Qv2 +l?Ql)/△T2
=(-3225.7×0.978/122.1-1400×10-3×0.0115)/1.996
=-14.8kJ/K
所以平均水当量
Cj水=(-14.2-14.8)/2 =-14.6 kJ/K
Ⅲ 根据水当量和萘的△T,求出萘的Qv:
Qv =((Cj水×△T- l?Ql)×M)/m样
=((-14.6×2.664+1400×10-3×0.009)×128.2)/0.9818
=-5080.3 kJ/mol
Ⅳ 计算萘的恒容燃烧热Qp:
Qp =Qv+△nRT=-5080.3+(-2)×8.314×286.244×10-3
=-5085.1 kJ/mol
Ⅴ 相对误差:
E%=(Qp(实验值)- Qp(理论值))/ Qp(理论值)
=(-5085.1+5154)/(-5154)=-1.34%
七、实验思考题
1、固体样品为什么要压成片状?
答:压成片状有利于样品充分燃烧。
2、开始加入内筒的水温为什么要比环境低一度左右?
答:样品放出来的热量大约会使水温升高两度,有利于计算水当量。
3、在用苯甲酸标定水当量时与测定萘的燃烧热时,量热计内桶的水量是否一致,为什么?
答:一致的,水量只有保持一致才能保证水当量是一样的。
4、燃烧热实验中,哪些因素容易带来实验误差?如何改进实验精度? 答:体系与环境的热交换和镍铬丝的燃烧。应该改进实验装置。
八、实验小结
本次实验等待时间较长,所以需要耐心记录数据。对于本次实验,我觉得最大的收获在于了解了一般测量燃烧热的方法。不足之处是水温的调节不是很好,点火后温度的记录不是很及时,导致突越的点找的不是很准确。
