杭州师范大学学生实验报告
实验名称 燃烧热的测定
姓名: 陆亚红 同组者姓名: 王丹 日期: 20xx年3月18日
一 实验目的
1、掌握燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别及相互关系;
2、熟悉热量计中主要部分的原理和作用,掌握氧弹热量计的实验技术;
3、用氧弹热量计测定苯甲酸和萘的燃烧热;
4、学会雷诺图解法校正温度改变值。
二 实验原理
1、燃烧与量热
根据热化学的定义,1mol物质完全氧化时的反应热称作燃烧热,燃烧的测定可以用于求算化合物的生成热、键能等。
量热法是热力学的一种基本试验方法。在恒容或恒压条件下可以分别测得恒容燃烧热QV和恒压燃烧热Qp。有热力学第一定律可知,QV等于体积内能变化ΔU;Qp等于其焓变ΔH。若把参加反应的气体和反应生成的气体都作为理想气体处理,则它们之间存在以下关系:
ΔH=ΔU+Δ(pv) Qp=QV+ΔnRT
式中Δn为反应前后反应物和生成物中气体的物质的量之差;R为摩尔气体常数;T为反应时的热力学温度。本实验所用的氧弹热量计是一种环境恒温式的热量计。氧弹的剖面图如图1所示,氧弹热量计测量装置如图2。
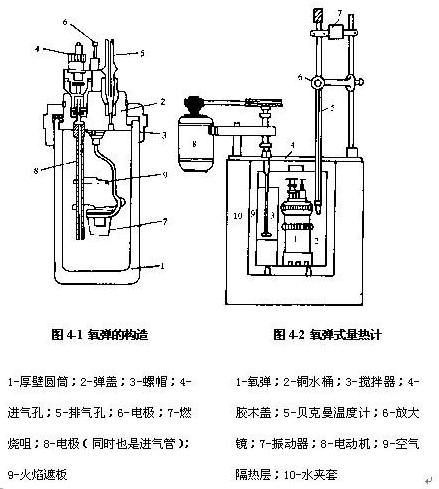
2、氧弹热量计:
氧弹热量计的基本原理是能量守恒定律。样品完全燃烧后所释放的能量使得氧弹本身及其周围的介质和热量计有关附件的温度升高,则测量介质在燃烧前后体系温度的变化值,就可求算该样品的恒容燃烧热。关系式为:
(m样/M)QV +l?Ql=Cj水ΔT
式中m和M分别为样品的质量和摩尔质量;Qv为样品的恒容燃烧热;l和Ql是引燃用镍铬丝的质量和单位质量的燃烧热;Cj称为热量计的水当量,即热量计升高1℃所需的热量;ΔT为样品燃烧前后水温的变化。
3、雷诺温度校正图:
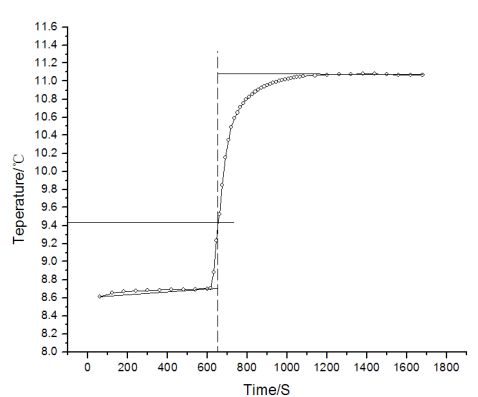
实际上,热量计与周围环境的热交换无法完全避免,它对温度测量值的影响可用雷诺温度校正图校正。具体方法为:称取适量待测物质,估计其燃烧热后可使水温上升1.5-2.0℃。预先调节内桶水温使其低于外桶夹套水温1.0℃左右。按操作步骤进行测定,将燃烧前后观察所得的一系列内桶水温和时间关系作图。
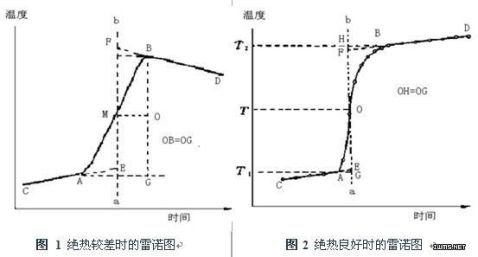
可得如图1所示的的曲线。图中A点意味着燃烧开始,热传入介质;B点作为观察到的最高温度值;从相当于外桶水温的T点做水平线交曲线于O点,过O点作垂线ab,再将CA线和DB线分别延长并交ab线于G F两点,G F间的温度差值即为经过校正的ΔT。
本实验采用数字式精密温差测量仪来测量温度差。
四 实验仪器
氧弹量热计、数字是精密温差测量仪、氧气钢瓶、氧气减压阀、压片机、塑料桶、剪刀、容量瓶(1000ml,2000ml)、万用表、案秤(10kg)、秒表、分析天平、引燃专用镍铬丝、苯甲酸(A.R.)、萘(A.R.)。
五 实验步骤
1、测定热量计的水当量
1.1 样品制作:用天平称取大约1.15g左右的苯甲酸,在压片机上稍用力压成圆片。用镊子将样品在干净的称量之上轻击三次,除去表面松散粉末后再用分析天平称量,精确至0.0001g。
1.2 装样并充氧气:拧开氧弹盖,将氧弹内部擦干净,尤其是电极部位。测量金属小杯质量后,小心将样品片放置在金属小杯中部。称取约10cm长的引燃镍铬丝,在直径约2mm的万用电表笔上,将引燃镍铬丝的中段绕成螺旋形8圈。
时间/S 温度/℃时间/S 温度/℃时间/S 温度/℃时间/S
温度/℃将螺旋部分紧贴在样片的表面,两端固定在电极上。旋紧氧弹,将导气口与氧气钢瓶上的减压阀相连接。打开氧气阀门,向氧弹中充入1.2-1.3MPa的氧气。 1.3 调水温并测量:取约40000ml水于塑料盆中,并不断搅拌,用冰块或热水调节水温至比外桶夹套中的水温低约1.0℃。开启精密数字温度温差仪,将测温探头置于外桶测温孔内,至温度变化不大于0.002℃/min时,此温度就记录为环境温度。将氧弹两电极用导线与点火变压器相连接,再将氧弹架放入盛水桶中,固定在氧弹架上。用磅秤准确称取已被调节到低于外桶夹套水温1.0℃的自来水3000ml于内桶。盖上盖子后,将其插入系统,开动搅拌马达。待温度稳定上升后,每隔1min读取一次温度(准确读至0.001℃)。10分钟后,按下变压器上电键通电4-5s点火。自按下电键后,温度读数改为每隔15s一次,直至两次读数差值小于0.005℃,读数间隔恢复为1min一次,继续10分钟后方可停止试验。 1.4 关闭电源后,取出数字式精密温差测试仪的探头,再取出氧弹,用放气帽把氧弹中余气放出。旋开氧弹盖,检查样品是否燃烧完全。氧弹中应没有明显的燃烧残渣,若发现黑色残渣,则应重做实验。称取剩余未燃烧的镍铬丝的重量。最后擦干氧弹和盛水内桶。 2、重复以上的实验步骤。 3、萘的燃烧热测定 称取约0.75g的萘,按上述方法测定。 六 数据处理 (1)苯甲酸1 样品质量:1.380g 反应用的镍铬丝质量:0.018-0.016=0.002g 水的质量:3000.7g 外桶温度:9.286℃ ①数据 60 120 180 240 300 360 420 480 8.204 8.214 8.211 8.225 8.229 8.231 8.232 8.234 600 点火 615 630 645 660 675 690 8.235 8.238 8.311 8.561 8.945 9.263 9.630 720 735 750 765 780 795 810 825 10.041 10.158 10.243 10.306 10.363 10.409 10.444 10.473 855 870 885 900 915 930 945 960 10.525 10.545 10.565 10.581 10.596 10.610 10.622 10.633 540 8.234 705 9.861 840 975 10.503 10.643
时间/S
温度/℃
时间/S
温度/℃ 990 1005 1020 1035 1050 1065 1080 1140 1200 10.650 10.657 10.671 10.676 10.681 10.685 10.689 10.701 10.709 1260 1320 1380 1440 1500 1560 1620 1680 10.713 10.714 10.714 10.712 10.710 10.707 10.704 10.701 时间/S
温度/℃
时间/S
温度/℃
时间/S
温度/℃ ②雷诺温度校正图
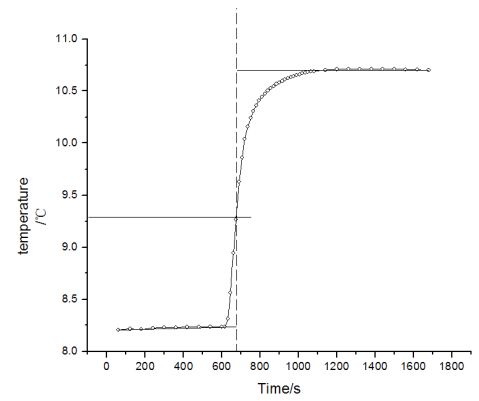
③苯甲酸的ΔT:10.725-8.250=2.475℃ (二)苯甲酸2 样品质量:1.063g 反应用的镍铬丝质量:0.017-0.010=0.007g 水的质量:3000.6g 外桶温度:9.517℃ ① 数据 60 120 180 240 300 360 420 480 540 8.467 8.471 8.503 8.518 8.528 8.535 8.540 8.545 8.552 600 点火 615 630 645 660 675 690 705 8.560 8.558 8.562 8.936 9.329 9.581 9.821 9.952 720 735 750 765 780 795 810 825 840 10.034 10.104 10.159 10.196 10.232 10.269 10.286 10.307 10.326
时间/S 855 870 885 900 915 930 945 960 975 温度/℃ 10.343 10.358 10.371 10.383 10.396 10.403 10.412 10.420 10.428 时间/S
温度/℃
时间/S
温度/℃
时间/S
温度/℃
时间/S 990 1005 1020 1035 1050 1065 1080 1140 1200 10.433 10.439 10.444 10.449 10.452 10.457 10.460 10.471 10.477 1260 1320 1380 1440 1500 1560 1620 1680 10.479 10.481 10.483 10.485 10.485 10.485 10.485 10.485 ②雷诺温度校正图
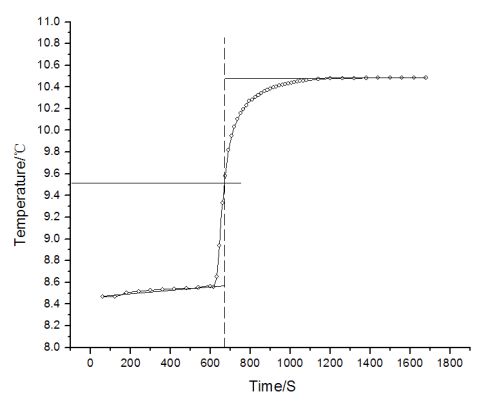
③苯甲酸的ΔT:10.490-8.458=2.032℃ (三)萘 样品质量:0.873g 反应用的镍铬丝质量:0.015-0.009=0.006g 水的质量:3000.5g 外桶温度:9.430℃ ①数据 60 120 180 240 300 360 420 480 540 8.609 8.650 8.666 8.675 8.680 8.684 8.690 8.692 8.693 600 点火 615 630 645 660 675 690 705
温度/℃ 时间/S 温度/℃ 时间/S 温度/℃ 时间/S 温度/℃ 时间/S 温度/℃ 8.695 720 735 10.487 10.587
855 870 10.904 10.923
990 1005 11.019 11.026 1260 1320 11.075 11.077 ②雷诺温度校正图
8.705 750 10.560
885 10.939 1020 11.033 1380 11.078 8.882 765 10.714
900 10.954 1035 11.039 1440 11.078 9.231 780 10.757
915 10.968 1050 11.043 1500 11.074 9.526 795 10.795
930 10.993 1065 11.048 1560 11.072 9.846 810 10.827
945 11.003 1080 11.052 1620 11.070 10.151 10.350
825 840 10.856 10.881
960 975 11.000 10.000 1140 1200 11.064 11.072 1680 11.067
③萘的ΔT:11.090-8.700=2.390℃
Ⅰ根据苯甲酸1和苯甲酸2的ΔT和恒容燃烧热计的平均值算水当量: Qv1=Qp-ΔnRT1=-3226.9-(-0.5)×8.314×282.976×10-3=-3226.78kJ/mol Cj水1=((m样1/M)Qv1 +l?Ql)/ ΔT1=-14.7485 kJ/K
Qv2=Qp-ΔnRT2=-3226.9-(-0.5)×8.314×282.677×10-3=-3325.725 kJ/mol
Cj水2=((m样2/M)Qv2 +l?Ql)/ ΔT2=-13.837 kJ/K
所以平均水当量Cj水=-14.293 kJ/K
Ⅱ根据水当量和萘的ΔT,求出萘的Qv:
Qv=((Cj水×ΔT- l?Ql)×M)/m样=((-14.293×2.390+1400×10-3×0.006)×128.2)/0.873=-5015.200 kJ/mol
Ⅲ计算萘的恒容燃烧热Qp:
Qp=Qv+ΔnRT=-5015.200+(-2)×8.314×282.581×10-3=-5019.899kJ/mol Ⅳ相对误差:
E%=(Qp(实验值)- Qp(理论值))/ Qp(理论值)=(-5019.899+5154)/(-5154)=-2.601%
七 思考题
1、固体样品为什么要压成片状?
答:压成片状有利于样品充分燃烧。
2、在量热学测定中,还有哪些情况可能需要用到雷诺温度校正方法?
答:需要准确测量温度的时候。
3、在燃烧热实验中,哪些是体系?哪些是环境?有无热交换?若有热交换,那么这些热交换对实验有何影响,如何处理?
答:在本实验装置中,氧弹的内部是被测物质的燃烧空间,是燃烧反应体系。氧弹壳及环境恒温式量热计及内外筒内的水为环境。盛水桶、3000ml水(刚好可以淹没氧弹)和氧弹三部分组成了测量体系,测量体系与环境之间有热量的交换,因为理想的绝热条件是不可能达到的,同时影响热量的交换量大小的因素也比较多,与体系、环境的材质有关;与体系、环境的接触界面积大小有关;与体系、环境的温差有关。处理:在本实验过程中,样品点火燃烧以后体系的温度肯定将高于环境的温度,体系将热传递给环境,因此就必须在样品点火燃烧以前使体系的温度低于环境的温度,使体系从环境处获得热量,并使体系获得的热量与传出的热量尽量抵消,这样测量的效果就相当于绝热体系的结果。
4、开始加入内筒的水温为什么要选择比环境低1℃左右?
答:减少因未采用绝热式热量计而引起的热辐射误差。
3、在用苯甲酸标定水当量时与测定萘的燃烧热时,量热计内桶的水量是否一致,为什么?
答:一致的,因为同一热量计的水当量一致。
4、燃烧热实验中,哪些因素容易带来实验误差?如何改进实验精度? 答:体系与环境的热交换容易带来实验误差,应该改进实验装置。
八 实验小结
通过此次实验我了解了燃烧热的定义,熟悉了热量计中主要部分的原理和作用,初步掌握了氧弹热量计的使用方法,并学会了用雷诺图解法校正温度改变值。 此次实验中在每次点火记录温度后需检查氧弹中是否有黑色残渣,即样品是否燃烧完全。在使用氧弹的时候应注意点火装置是否就位,否侧会造成点火失败。
第二篇:燃烧热的测定实验报告
燃烧热实验报告
一、实验目的
1、明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。
2、掌握量热技术的基本原理,学会测定奈的燃烧热。
3、了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。
4、学会雷诺图解法校正温度改变值。
二、实验原理
燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(Qv,m),恒容燃烧热这个过程的内能变化(ΔrUm)。在恒压条件下测得的燃烧热称为恒压燃烧热(Qp,m),恒压燃烧热等于这个过程的热焓变化(ΔrHm)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:
DcHm = Qp,m=Qv,m +ΔnRT (1)
本实验采用氧弹式量热计测量萘的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器。为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过雷诺矫正作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计)
量热原理—能量守恒定律
在盛有定水的容器中,样品物质的量为n摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,即量热计及水每升高1K所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为:
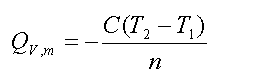
式中,Qv,m为样品的恒容摩尔燃烧热(J·mol-1);n为样品的摩尔数(mol);C为仪器的总热容(J·K-1或J /℃)。上述公式是最理想、最简单的情况。
但是,由于(1):氧弹量热计不可能完全绝热,热漏在所难免。因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。(2)多数物质不能自燃,如本实验所用萘,必须借助电流引燃点火丝,再引起萘的燃烧,因此,等式(2)左边必须把点火丝燃烧所放热量考虑进去就如等式(3):
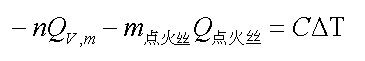
式中:m点火丝为点火丝的质量,Q点火丝为点火丝的燃烧热,为-6694.4 J / g,DT为校正后的温度升高值。
仪器热容的求法是用已知燃烧焓的物质(如本实验用苯甲酸),放在量热计中燃烧,测其始、末温度,经雷诺校正后,按上式即可求出C。
雷诺校正:消除体系与环境间存在热交换造成的对体系温度变化的影响。方法:将燃烧前后历次观察的贝氏温度计读数对时间作图,联成FHDG线如图2-1-2。图中H相当于开始燃烧之点,D点为观察到最高温度读数点,将H所对应的温度T1,D所对应的温度T2,计算其平均温度,过T点作横坐标的平行线,交FHDG线于一点,过该点作横坐标的垂线a,然后将FH线和GD线外延交a线于A、C两点,A点与C点所表示的温度差即为欲求温度的升高DT。图中AA’表示由环境辐射进来的热量和搅拌引进的能量而造成卡计温度的升高,必须扣除之。CC’表示卡计向环境辐射出热量和搅拌而造成卡计温度的降低,因此,需要加上,由此可见,AC两点的温度差是客观地表示了由于样品燃烧使卡计温度升高的数值
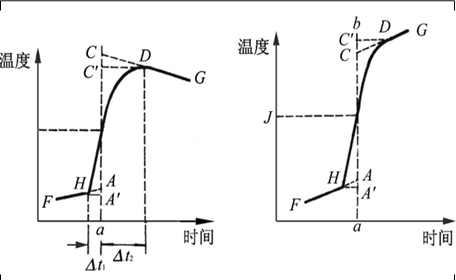
有时卡计的绝热情况良好,热漏小,而搅拌器功率大,不断稍微引进热量,使得燃烧后的最高点不出现,如图2-1-3,这种情况下DT仍可以按同法校正之。
三、仪器药品
外槽恒温式氧弹卡计(一个)
氧气钢瓶(一瓶)
压片机 (2台)
数字式贝克曼温度计(一台)
0~100℃温度计(一支)
万用电表(一个)
扳手(一把)
萘(A .R)
苯甲酸(A.R或燃烧热专用)
铁丝(10cm长)
四、实验步骤
(1)称取约0.5g左右的苯甲酸和点火丝质量,记录m苯甲酸和m铁,将称取的苯甲酸和点火丝一起压片,再将压成的样品称重,记录m样+铁。
(2)将样品点火丝分别绑在氧弹卡记的两极上,旋紧氧弹盖,用万用表检查电路是否通路,充氧气,反复充放3次。
(3)将氧弹插上电极,放入水桶内,加入水3000mL,盖上盖子,打开搅拌器,用温度计测定环境温度T。
(4)插上贝克曼温度计探头,待温度稳定后,每隔30s读贝克曼温度计一次,记录10个数据,迅速按下点火键,仍30s读数一次,直到温度出现最高点,此阶段的温度作为燃烧期间的温度,当温度升到最高点并开始下降后仍每隔30s记录一次数据,记录10个数据。
(5)关闭电源,取下贝克曼温度计,拿出氧弹,放气,旋开氧弹盖,检查样品燃烧结果。若燃烧安全,称量剩下的铁丝,倒去铜水桶的水并用毛巾擦干。
(6)称取0.5g左右萘,重复(2)-(5)操作。
五、注意事项
1、为避免腐蚀,必须清洗氧弹。
2、点火成败是实验关键,实验前应仔细安装点火丝。点火丝不应与弹体内壁接触,避免点火后发生短路。
3、实验结束后,一定要把未燃烧的铁丝重量从公式中减掉。
4、样品压片力度须适中。
六、数据处理
1.数据记录
(1)、数据整理如下:
第一次测量苯甲酸样品
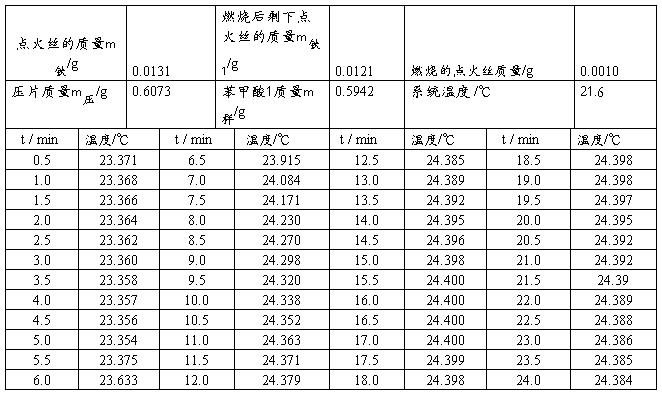
第二次测量苯甲酸样品

第一次测量萘样品
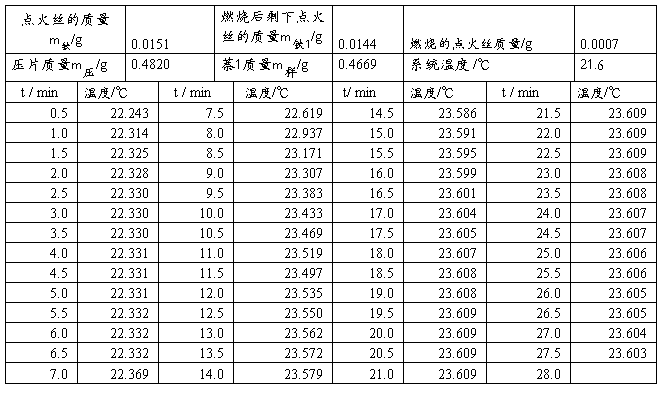
第二次测量萘样品

2.数据处理
(1)、计算仪器常数的计算
查表可得苯甲酸标准状况下其摩尔燃烧焓为△cHm= —3226.9KJ/mol
苯甲酸燃烧反应方程式为:

由 △rHm =DcHm = Qp,m=Qv,m +ΔnRT (1)
得苯甲酸标准状况下其恒压摩尔燃烧热为
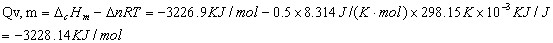
如果不考虑温度的变化对标准燃烧热的影响,我们将这次该实验条件下苯甲酸的恒容燃烧热近似认为恒容摩尔燃烧热。

计算仪器常数 C


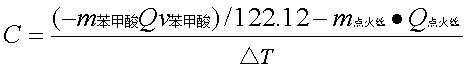 (2)
(2)
式中: ——为苯甲酸恒容摩尔燃烧热,
——为苯甲酸恒容摩尔燃烧热,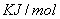 ;
;
C——仪器常数,kJ·K-1 ;
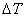 ——样品燃烧前后量热计温度的变化值;
——样品燃烧前后量热计温度的变化值;
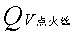 ——为点火丝的恒容燃烧热(-6.6944kJ·g-1)
——为点火丝的恒容燃烧热(-6.6944kJ·g-1)
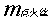 ——为点火丝的质量,g;
——为点火丝的质量,g;
 ——为苯甲酸的质量,g。
——为苯甲酸的质量,g。
利用雷诺作图法处理结果如下图:
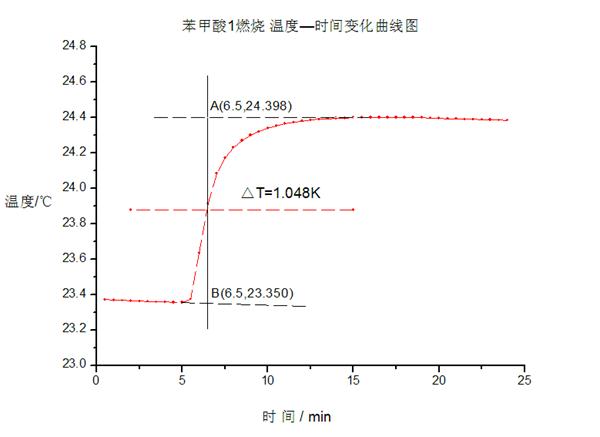
图一:苯甲酸1
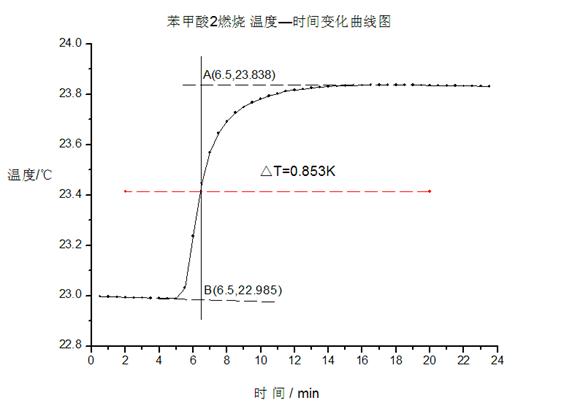
图二:苯甲酸2
由图一、二可得苯甲酸燃烧引起卡计温度变化差值分别为
△T1=1.048 K △T1=0.853 K
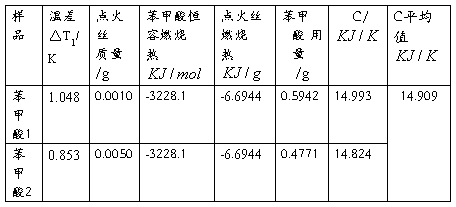
现将计算C值所需数据及计算结果整理如下:
(2)计算萘的燃烧热
由公式可得,萘的恒容燃烧热:
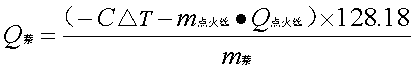
式中: ——为萘恒容摩尔燃烧热,
——为萘恒容摩尔燃烧热,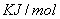 ;
;
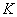 ——仪器常数,kJ·K-1 ;
——仪器常数,kJ·K-1 ;
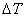 ——样品燃烧前后量热计温度的变化值;
——样品燃烧前后量热计温度的变化值;
 ——为点火丝的恒容燃烧热(-6.6944kJ·g-1)
——为点火丝的恒容燃烧热(-6.6944kJ·g-1)
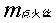 ——为点火丝的质量,g;
——为点火丝的质量,g;
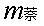 ——为萘的质量,g
——为萘的质量,g
利用雷诺作图法处理结果如下图:
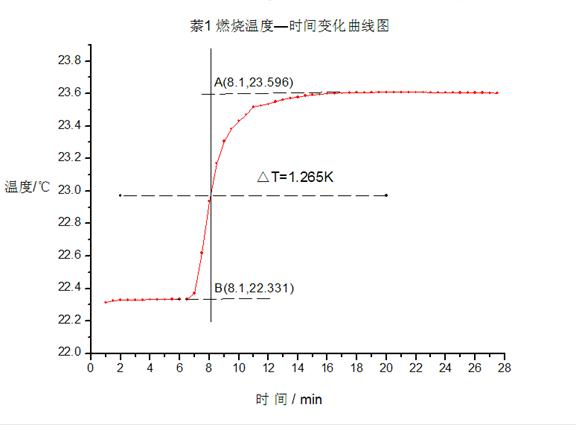
图三:萘1
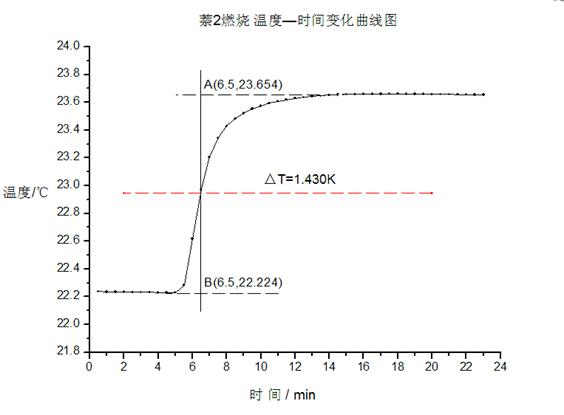
图四:萘2
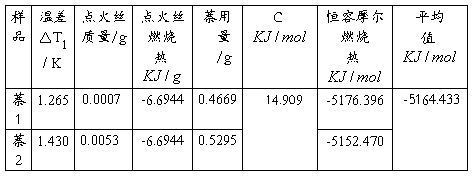
(3)萘的恒压摩尔燃烧热
由(2)可得萘的恒容摩尔燃烧热
故根据燃烧方程式:
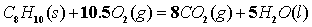
可得萘的燃烧焓:
两次实验其系统温度分别为21.6℃和21.6℃
计算后取平均值得萘在294.75K时其摩尔燃烧热为
DcHm =Qp,m =—5170.559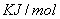
如果不考虑温度的变化对标准燃烧热的影响,我们将这次该实验条件下(294.75K)萘的恒压燃烧热近似认为恒压摩尔燃烧热。
七、讨论分析
1、实验结果讨论分析
(1) 实验误差计算
查表得, (萘,25℃ )=—5153.8 kJ/mol
(萘,25℃ )=—5153.8 kJ/mol
相对误差=
(2)实验误差来源分析
i. 药片质量:压片后称重总质量,通过简单计算得到药片质量。在固定药片至电极的过程中以及转移的过程中,可能有药片粉末的脱落。此外,考虑到实验中是徒手操作,手上的油脂等杂物可能粘附在药片上,导致实际燃烧的物质并不是理论质量的物质,使得测量结果不准确。因此,要药片要压实,且最好戴着手套操作。
ii. 系统绝热效果:系统并不是理想的绝对绝热,可能引入误差。
iii. 搅拌器功率较大,搅拌器不断引进的能量引入误差。
iv. 处理恒容摩尔燃烧热和恒压摩尔燃烧热时,没有找到苯甲酸和萘的比热,所以不能算得出298.15K时的值,本实验结果是近似处理。
2、实验过程等讨论
(1) 注意事项
i. 把苯甲酸在压片机上压成圆片时,压得太紧,点火时不易全部燃烧;压得太松,样品容易脱落;要压得恰到好处。样品的质量过大或者过小也会造成误差。
ii. 将压片制成的样品放在干净的滤纸上,小心除掉有污染和易脱落部分,然后在分析天平上精确称量。
iii. 安装热量计时,插入精密电子温差测量仪上的测温探头,注意既不要和氧弹接触,又不要和内筒壁接触,使导线从盖孔中出来,接触了对测温造成误差。防止电极短路,保证电流通过点火线。
iv. 氧弹充气不离人,一只手始终抓住充气阀,以免意外情况下弹盖或阀门向外冲出。
v. 热量计的绝热性能应该良好,但如果存在有热漏,漏入的热量造成误差;搅拌器功率较大,搅拌器不断引进的能量形成误差。
(2) 实验心得
充分体会到计算机程序的强大,数据的原始记录和进一步的处理,若有人工完成,一方面计算繁琐,另一方面误差较大。而计算机程序则迅速精确的实现数据的处理,无论对于实验者还是实验质量的提高都相当有益。
八、结论
DcHm(萘,294.75k)=-5170.559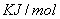
九、思考题
1、实验测量得到的温度差值为何要经过雷诺作图校正,还有那些误差来源会影响测量结果。
答:内水桶不是完全绝热,体系和环境之间的热交换途径有:传导、对流、辐射、蒸发和机械搅拌。为了校正这部分损失,用雷诺图解法进行校正。其他误差来源在结果讨论中已讨论。
2、什么是卡计和水的热当量?如何测得?
答:卡计和水的比热容C就是热当量。本实验通过样品苯甲酸可以测得。
3、测量燃烧热两个关键要求是什么?如何达到?
答:1、实验系统绝热 2、样品完全燃烧以及放出的热完全被吸收。保证系统绝热良好效果采用本实验外槽恒温式氧弹卡计,而样品完全燃烧需要保证样品的压片质量要高,以及充氧要充分。
十、参考文献
[1].南京大学物理化学教研室 傅献彩,沈文霞,姚天扬. 物理化学, 第四版(上,下册).高等教育出版社, 1990.
[2]. 崔献英,柯燕雄,单绍纯. 物理化学实验 , 中国科学技术大学出版社, 2000.
[3].《燃烧热测定实验研究》李森兰,杜巧云,王保玉 大学化学,2001.
