实验四燃烧热的测定
摘要:本实验采用氧弹量热计测定萘的恒容燃烧热,并计算萘的恒压燃烧热。在测量过程中
先用标准物质苯甲酸标定量热计的热容,通过雷诺校正图的方法校正过程的温度变
化,以获得同绝热系统相近的测量效果,然后用相同的方法进行萘的燃烧测定
关键词:氧弹量热计 燃烧热 雷诺校正图
The Determination of The Combustion Heat of Albocarbon
Abstract:Inthis experiment, we determined the combustion heat of Albocarbon at a constant volume by using Oxygen-bomb calorimeter and then calculated the combustion heat at a constant pressure. Benzoic acid, as standard substance, is used at the process of the experience first, and then we calculated the heat capacity of the whole instrument. Through the method of Renault correct figure we can measure the temperature variance to simulate a perfect insulator-system in the actual system. After that, we got the albocarbon’s combustion heat at a constant volume.
Key words:Oxygen-bomb calorimeter Combustion heat Renault correct figure
1.序言
摩尔燃烧热是指一摩尔纯净物完全燃烧时所放出的热量。所谓完全燃烧,即组成反应物的各元素,在经过燃烧反应后呈现本元素的最高化合价,同时反应物和生成物在指定的温度下都属于标准态。恒容过程的热效应Qv=ΔU;恒压过程的热效应Qp=ΔH,它们有如下的关系:Qp=Qv+Δn(RT)或ΔH =ΔU+Δn(RT),其中Δn为反应前后气态物质的物质的量之差,R为普适气体常数,T为环境的绝对温度。
本实验根据以上原理先测定萘完全燃烧时的恒容燃烧热,然后再计算出萘的恒压燃烧热。由于热比较难测量,而温度较易测得,所以在实验过程中通过记录体系温度的变化换算出热量的相对变化值,运用这种方法可以得到物质的燃烧热,从而求得物质的燃烧热。
燃烧热是重要的物理化学参数,利用氧弹及标准物质法进行测定是一种重要的方法,
2.实验部分
2.1 药品与仪器
GR 3500型氧弹式热量计控制箱 长沙仪器厂
JDW-3F电子温差测量仪 南京大学应用物理研究所
电子天平;压片机;扳手;欧姆表
氧气钢瓶,氧气减压器,充氧导管
苯甲酸(分析纯);萘(分析纯);Cu-Ni合金丝
2.2 实验步骤
1)样品压片:取Cu-Ni合金丝一根,对折后在中间位置打环,准确称量之。将其置于压片机的模具上并装上底板,把称量好的0.8克左右苯甲酸倒入模具内,将铁丝环浸埋,装上顶杆。下压压片机螺杆,稍用力使样品压牢;翻转底板后再次下压以取出样品,弹去周围粉末,准确称质量;
2)装置氧弹:拧开氧弹盖,清洁内壁,将样品上的铁丝小心的绑在氧弹中的两根电极上,旋紧氧弹盖,用万用表检查两电极是否通路,若通路则旋紧出气口。连接氧弹和氧气钢瓶,打开阀门充气2min,再用万用表核验两电极是否通路;
3)燃烧和测量温差:将氧弹卡计、内筒、搅拌器装配好,用容量瓶准确量取3000mL水置于内筒中。打开温差测定仪,将测温探头插入外套测温口中,待读数稳定后置0.000;开动搅拌马达,将温差仪插入内筒中,此时读数低于-1.000,用电吹风加热内桶中的水,在温差仪读数为约-0.850时停止加热。待温差仪读数为-0.800时,开启计算机计数同时准备好点火开关,待温差仪读数约为-0.750时点火。点火后继续计数10分钟。完毕后先放气,再旋开氧弹盖观察燃烧是否完全,若燃烧完全则称量Cu-Ni合金丝剩余的质量;
4)测定萘的燃烧热:称取约0.6克萘,将上述步骤重复一次,测萘的恒容燃烧热。
2.3 注意事项
1)氧弹充氧操作中,人应站在氧气减压表的侧面,以免意外;
2)压片时应将Cu-Ni合金丝压入片内;
3)氧弹充完氧后一定要检查确信其不漏气,并用万用表检查两极间是否通路;
4)将氧弹放入量热仪前,一定要先检查点火控制键是否位于“关”的位置;点火结束后,应立即将其关上。
3.结果与讨论
3.1 实验结果
萘的恒容摩尔燃烧热 ΔCUm= -5107KJ/mol ;
萘的恒压摩尔燃烧热 ΔCHm= -5102KJ/mol 。
3.2 结果分析
1)与文献值比对
查找相关文献得知萘的恒压燃烧热为-5153.9kJ/mol。
绝对误差:5102-5153.9=-51.9 kJ/mol
相对误差:51.9/5153.9=1.0%
由DQP’ =51.9 kJ/mol,DQP =68.0 kJ/mol,知:DQP’P
2)误差分析
由上面的结果我们可以看到相对误差较小,绝对误差也小于仪器带来的系统误差,下面讨论除仪器精度外的其他误差因素。
① 本实验实际为非绝热体系,我们只是尽量让热散失与热吸收的量相等。但实际操作中,由于燃烧物质量因素,造成了燃烧升温不足或略高,使得体系有了一定的净吸热或放热。最终燃烧后的体系温度比理想绝热条件下的温度高或低,从而影响了最后的结果。
② 尽管雷诺图进行了温差的修正,但仍然无法完全使测量情况与绝热环境一致,且绘图本身也存在着误差。
③ 一些小的误差因素:3000ml水有溅出,压片称量后有少量颗粒脱落,计算热容时忽略了消耗NaOH所相当的热当量5.98V,这些因素都会对结果产生影响。
3.3 补充和思考
1)关于异常值的讨论
在计算机自动采集的温差值数据中,出现了数次错误的“0.235K”,这在实验一中也出现过。这是JDW-3F精密电子温差测量仪的问题,因此在处理数据时要这些坏点去掉。出现错误的原因是仪器在采集快速变化的温度数据时表现出的“时滞”,即无法及时获取正确的采样值,只能用自动取默认值填充。
2)实验改进
我认为可以这样更好的模拟绝热环境:在外桶加冷却水管,电阻加热管,电子感温探头(内筒和外筒各一个),并由单片机控制形成双反馈环电路,使得在实验过程中使外套筒内水温变化始终跟踪着内筒水温的变化。这样只要内桶水温变化速率不太大,环境与体系的温度便能始终保持大致相同,从而达到绝热的目的。
3)心得体会
热是一个很难直接准确测定的物理量,而在本实验采用比较容易准确测量的温度来代替燃烧热,这种方法在物理化学实验中是一种比较常用的方法,我们应该理解这种思想并能将其灵活运用到其他实验中。
在实验过程中,我们用到了一些仪器设备都需要特别注意安全,此外在实验中要耐心细致,不能操之过急,否则会造成诸多麻烦,浪费很多时间。本次实验对我们的实验精神品质进行了训练,收获颇丰。
参考文献:
[1] 崔献英,柯燕雄,单绍纯.物理化学实验[M].中国科技大学出版社,2000: 29~32.
[2] 付献彩,沈文霞,姚天扬,侯文华.《物理化学》(第五版)下册[M].南京大学化学化工学院,高等教育出版社,2005.
附件:实验数据处理
1.数据记录
1.1 仪器药品参数
Cu-Ni合金丝的密度:0.9983mg/cm
苯甲酸的恒容燃烧热:26.460 kJ/g
长度误差Δl=n*0.1cm
质量误差Δw=0.0001g
温度误差ΔT=0.05℃
1.2 实验数据
外套温度:17.1℃(苯甲酸),18.5℃(萘)

苯甲酸:

萘:
另外计算机通过JDW-3F精密电子温差测量仪自动采集温差数据。
2. 数据处理
2.1 绘制雷诺校正图
使用origin软件对实验所得数据做雷诺校正图并去除坏点,得到Fig A1、FigA2如下:
Fig A1.
 Fig A2
Fig A2
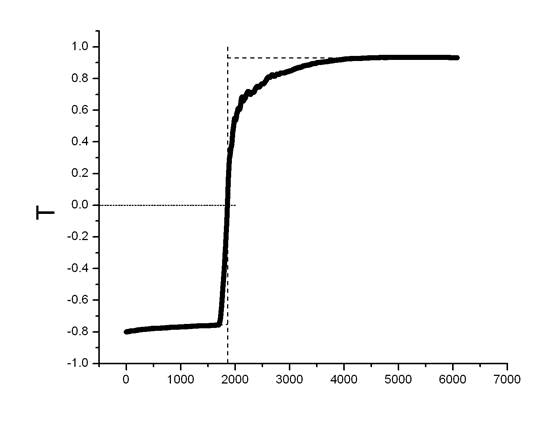
有图可得:
ΔT1=0.7398-(-0.7483) =1.4881℃
ΔT2=0.9302-(-0.7521) =1.6823℃
2.2 计算氧弹卡计的热容
Cu-Ni合金丝燃烧掉的质量:Δm=0.0211-0.0124=0.0087g
反应过程中Cu-Ni合金丝燃烧的长度:l=Δm/ρ=0.0087*1000/0.9983=8.7148cm
苯甲酸质量:m =0.8311-0.0211=0.8100g
C卡=Q / ΔT ≈ (m Qv +2.9l) / ΔT=(0.8100*26460+2.9*8.7148)/ 1.4881=14387J/k
2.3 计算萘的恒容和恒压燃烧热
Cu-Ni合金丝燃烧掉的质量:Δm=0.0212-0.0076=0.0136g
反应过程中Cu-Ni合金丝燃烧的长度:l=Δm/ρ=0.0136*1000/0.9983=13.623cm
苯甲酸质量:m =0.6276-0.0212=0.6064g
萘的恒容燃烧热QV=(C卡ΔT-2.9l)/m×M=(14387*1.6823-2.9*13.623)/0.6064*128.18
=5107KJ/mol
由反应式C10H8 (s) +12O2 (g) ®10CO2 (g) + 4H2O( l)得:Dn= -2
萘的恒压燃烧热QP=QV+DnRT=5107698-2*8.314*(18.5+273.15)= 5102KJ/mol
2.4 计算绝对误差
质量误差Dm=2*DW=2*0.0001=0.0002g
温差误差D(DT)= 2*0.005=0.01℃
温度误差DT=0.05℃
由C卡= (m Qv +2.9l) / ΔT=(m Qv +2905m’ )/ ΔT,得:
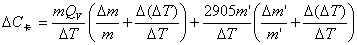
=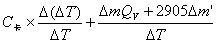
=14387*0.01/1.4881+0.0002* (26460+2905)/ 1.4881
=100.63J/K
由QV=(C卡ΔT-2.9l)/m×M=(C卡ΔT-2905m’)/m×M
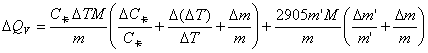
=14387*1.6823*128.18*(100.63/14387+0.01/1.6823+0.0002/0.6064)/ 0.6064+2905*0.0087
*128.18*(0.0002/0.6064+0.0002/0.0087)/ 0.6064=68.007KJ/mol
DQP=DQV+DnRDT= 68007+2*8.314*0.05=68.008KJ/mol
