实验名称:小鼠的一般操作 实验日期:
姓名: 学号: 专业:
一、 实验目的和要求
掌握小鼠实验的一般操作:动物的抓取和保定,性别鉴定,编号,给药,麻醉,采血,处死,解剖等。
二、 实验准备
1、 动物:昆明小鼠,雌雄各2只
2、 器械:毛笔,解剖剪,解剖镊,眼科剪,眼科镊,解剖板,灌胃针,注射器,头皮针,干棉球及酒精棉球,20ul采血针。
3、 药品:苦味酸,0.9%生理盐水及2%水合氯醛
三、 实验步骤
1、 抓取和保定
右手将小鼠尾巴提起,置于粗糙的平面上,此时小鼠向前挣扎,用左手拇指和食指捏住小鼠颈背部皮肤,翻转小鼠,其背部置于掌心,小指压住小鼠尾巴
2、 性别鉴定
 小鼠抓取后翻转,观察肛门与生殖器之间的距离,距离远者为雄性,近者为雌性。雄性小鼠睾丸降至阴囊内,生殖器有明显突起;雌性小鼠的肛门至会阴处为无皮毛覆盖的细线。
小鼠抓取后翻转,观察肛门与生殖器之间的距离,距离远者为雄性,近者为雌性。雄性小鼠睾丸降至阴囊内,生殖器有明显突起;雌性小鼠的肛门至会阴处为无皮毛覆盖的细线。
3、 编号
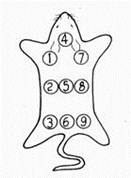
用苦味酸(黄色)的酒精饱和溶液逆着小鼠的毛染色(可维持1~2个月)不同的颜色部位代表不同的标号。一般习惯上的部位顺序为:1左前肢。2左腹部,3左后肢, 4头颈部,5背部,6尾根部,7右腹部9右后肢。
4、 给药
(1) 灌胃
左手抓取和固定小鼠,特别是其头颈部,右手持灌胃针,用灌胃针轻轻压其头部,尽量使其口腔和食道成一条直线再将灌胃针沿上腭壁轻轻进入食道,当灌胃针进入约3cm左右时即到达胃内,向胃内注射0.9%生理盐水后轻轻抽出灌胃针,小鼠每次最大灌胃量为0.5ml。
(2) 腹腔给药
 左手抓取和固定小鼠,右手持注射器,从左下腹部腹股沟上约0.5cm,腹中线旁外1cm进针,进针时腹部平面形成45度,进针深度约1cm。
左手抓取和固定小鼠,右手持注射器,从左下腹部腹股沟上约0.5cm,腹中线旁外1cm进针,进针时腹部平面形成45度,进针深度约1cm。
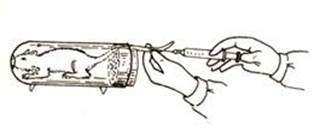
(3) 尾静脉注射
将小鼠放入固定的小笼内,尾巴滞留在外,消毒尾部,并挤压尾根部用左右拇指和食指控制小鼠尾巴角度。
 右手持注射器,使其与尾两侧的静脉平行,从尾下1/4处进针,将注射器外套置于拇指与中指交叉处,保持针头刺入点、血管、注射器成一条直线。向充盈的尾静脉刺入3—5mm,食指及中指夹住注射器外套,拇指推注射器,将0.9%生理盐水按一定速度推入。注射时若出现隆起的白色皮丘,说明针头未注入血管,应重新向尾巴根部移动进针注射。
右手持注射器,使其与尾两侧的静脉平行,从尾下1/4处进针,将注射器外套置于拇指与中指交叉处,保持针头刺入点、血管、注射器成一条直线。向充盈的尾静脉刺入3—5mm,食指及中指夹住注射器外套,拇指推注射器,将0.9%生理盐水按一定速度推入。注射时若出现隆起的白色皮丘,说明针头未注入血管,应重新向尾巴根部移动进针注射。
5、 采血
眼眶后静脉丛穿刺采血:左手抓取并保定小鼠,使右眼后侧皮肤绷紧,使眼球暴露突出,右手将针头从内侧眼角转动插入,由鼻侧眼眶壁平行向前推动,有突破感,血液流出。取血后,拔出针头,用干棉球压迫眼眶止血。
6、 麻醉
采用小鼠腹腔注射麻醉,麻醉剂为2%水合氯醛,用量为400mg/kg,注射量为0.5ml/25g。本组小鼠体重分别为①24.6g②23.5g③23.2g④23.5g。
7、 处死
小鼠处死一般采用引颈法。将教书置于一处其可抓住的地方,左手拇指和食指用力向下按住小鼠头部,右手抓住小鼠尾部用力向上向后拉,将脊髓拉断,小鼠即刻死亡。
8、 解剖
固定小鼠,以下腹部最低点起始,V字开口,沿中线剪开皮肤至剑突,再剪开腹膜,暴露腹盆腔器官。观察腹腔内器官(肝脏、胆囊、脾脏、胰腺、胃、肠道、肾脏、输尿管、膀胱、生殖器等)。
小鼠解剖学特点:
1、 小鼠腹腔内肝脏、胆囊、胃、肠、肾、膀胱、脾等。肝脏分为左、右、中、尾四叶,胆囊藏在肝分叶的深层,较透明;胰腺为弥散状,分散在十二指肠、胃底及脾门处,色淡红,似脂肪组织。推开肠管可见肾脏,左肾位置偏下被脾脏覆盖,右肾偏上被肝脏遮盖,肾上腺位于肾上极,白色,周围有较多脂肪组织包绕。
2、 小鼠胸腔有气管、肺、心脏和胸腺。肺脏有4叶组成,剪开胸部皮肤和肋骨,可见两侧肺脏和中间心脏,向上有气管。甲状腺位于气管旁,深红色。
3、 雌鼠生殖器官有卵巢、输卵管、子宫,阴道等。其子宫为“Y”型(双角子宫),分为子宫角、子宫体、子宫颈。沿两个角向上寻找卵巢,位于双侧肾脏下缘附近。卵巢被系膜包绕,不与腹腔相通。
4、 雄鼠的生殖器有睾丸、附睾、副性腺(如凝固腺)、输精管等。挤压雄鼠阴囊,腹腔内可见两椭圆形白色物质,即为睾丸。凝固腺附着于精液腺内侧,是半透明的半月形器官。副性腺分泌物有营养精子、形成阴栓等作用。
四、 实验注意事项:
1、 抓取和保定小鼠时多抓一些皮肤更易固定小鼠。并用小时固定小鼠后肢及尾巴,防止其挣扎影响操作。
2、 用苦味酸涂染小鼠毛法简便、清晰,适用于短期实验,如要做长期试验,为避免褪色,可每隔2~3周重染一次。
3、 经口灌胃时,插入灌胃针是不可强行差=插,可退回后在尝试插入,若小鼠强烈挣扎,提示插入位置不正确,需拔出重插,否则可将药物灌入气管内,造成小鼠死亡。
4、 腹腔进针注射时,针头不能插入太深,选择进针的地方应该尽量靠近下腹部,尽可能避免刺伤肝脏、脾和膀胱。推注射器前可先回抽,确认无血液及肠内容物后再注射。
5、 尾静脉注射时,选择起始进针位置应靠近尾尖,进针角度应该<30度,防止血管对穿。进针后由于小鼠血管较细,回抽也不一定有血,主要通过观察推药时血管的颜色和尾巴是否水肿出现。
6、 小鼠麻醉时:存在个体差异,对麻药量的耐受性也不同,应注射后观察小鼠的反应,如麻醉药剂量不足,理论上补1/3的原剂量。
7、 处死小鼠时:右手用力应从小逐渐增大,避免突然用力,以免小鼠尾拉断而脊髓未断。右手除向后用力还应该部分向上用力,使小鼠的身体和头部成一定的角度,更容易处死。
五、 实验讨论
1、 给药途径有经口灌胃法、经呼吸道吸入、经皮肤吸收和注射给药法等,选择歌谣途径的依据:
(1) 根据药物的性质悬着给药途径;如有刺激性的药物不适用于皮下、肌肉和腹腔注射,只能经口给药或静脉注射,如在消化道内破坏或吸收不好的药物应该注射给药。
(2) 根据实验要求选择给药途径;如要求药物作用出现快,可用注射给药。如要药物作用相对延长,可注射油剂。若为雾状药物或毒物则需要通过呼吸道吸入。有些毒物易经皮肤吸收,可采用皮肤给药。
(3) 根据剂型选择给药途径;水溶液可以采用任何给药途径,油剂溶液可经口给药,也可通过肌肉注射给药。
2、 尾静脉注射时,可将小鼠尾用45~50度的温水浸润半分钟或用酒精擦拭,可使血管扩张,同时也可软化表皮角质。以左手拇指和食指夹住鼠尾,使静脉充盈,中指帮助无名指和小指捏住鼠尾末梢,右手持注射器,针头与静脉夹角一般<30度,从距尾尖2 - 3厘米处进针,此处皮薄易进入,先抽回血,见到血后再缓慢注入少量溶液,如无阻力,表示针头已进入静脉,可继续注入。一般推注速度为0.05 - 0.10ml/秒,一次注入量为0.05 - 0.25ml/10g体重,单次小鼠尾静脉注射的剂量不易超过0.4ml,大剂量迅速推注容易造成小鼠超负载性死亡。如反复注入,应尽可能从尾末端开始,以后向尾根部方向移动注射。
第二篇:实验动物学实验报告
实验动物学实验报告
一、实验动物:小鼠
二、操作流程:抓取,固定,编号,给药,取血,麻醉,绝育,解剖。
三、具体操作
1、抓取:抓取小鼠时,右手抓住小鼠尾巴,不要过于用力,以免惊吓小鼠。左手从小鼠身体后部向前抓(以免小鼠向后缩咬伤自己),抓住小鼠颈部。固定住小鼠后,将小鼠皮肤往上抓,尽量将小鼠背部皮肤抓住。左手将小鼠腹部朝向自己,把小鼠尾巴用左手无名指和小指夹住,这时小鼠腹部皮肤紧绷,不能动弹。
2、固定: 通常使用固定器进行固定。将固定器拧开后,抓住小鼠尾巴,使其钻入固定器中,再将拧下的固定器部分装好,使小鼠尾部露出,再将可旋转的铁片固定住即可进行后续实验。
3、编号:编号方式有两种:①剪脚趾编号:把小鼠腹面朝上,在下的脚趾从左至右依次编为1~10号,剪10号脚趾加1~9号脚趾依次编为11~19号,在上的脚趾依次编为20,30,40,50,60,70,80,90号,其余编号与11~19号类似。②打耳钉编号:耳钉上均有唯一编号,通过使用耳钉钳将耳钉打在小鼠耳朵上即可。实验时通常使用的是第一种方式进行编号,第二种编号通常用于需要长距离运输的动物。
4、给药:常用的给药方式有:
①口服给药:即灌胃。将注射器装入药物溶液,装上灌胃针(灌胃针有直头和弯头两种,区别不大)。如上所述,抓取小鼠后,使其头部朝上,尽量呈一直线,取灌胃针,从小鼠嘴角一侧缓缓插入(保持刻度在自己能看到的位置),顺着小鼠口腔食道的弧度让小鼠将针咽入,灌胃过程中如果遇到阻碍一定要及时拔出灌胃针,不可强行灌胃以免伤及小鼠食道以及肺部。灌胃针顺利进入后基本与小鼠身体呈一条直线,注入适量体积后再顺着食道缓缓取出灌胃针。
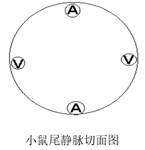
②静脉注射:小鼠尾部有3条静脉和1条动脉,3条静脉非别位于背部,及两侧。静脉注射时一般选取两侧静脉,因为其相对于背部静脉更为清晰饱满。将小鼠固定后,用酒精擦拭其尾部静脉,使其充血,以便注射。之后使注射器针孔处朝上,针与尾部呈约30°扎入尾部后向上轻挑,再向内扎入部分,此过程应该比较顺畅,没有阻碍,若阻碍较大则有可能扎入到了皮肤中。扎入后将活塞向后回抽一点可见到有血回流,则说明成功扎入静脉当中,注射适当体积后迅速拔针,用酒精进行消毒。
5、取血:有断尾取血法和眼眶取血法两种。本次实验使用的是眼眶取血法。抓取小鼠,固定其头部用手指将其上下眼睑分开,露出其眼球并且不能闭上。用玻璃毛细管从其上眼角处扎入眼球后方毛细血管从,使血液顺着毛细管留下,取血完成后快速将毛细管取下。
6、麻醉:抓取老鼠,使其头部朝下,使其腹部脏器向胸腔靠拢,露出腹部空腔,以免刺伤脏器。将注射器竖直扎入靠近后腿部腹腔,刺入之后稍微向前倾斜但不要向前刺入,一般注入0.5mL麻醉剂即可。随后拔出针,方向小鼠,等待几分钟后即可麻醉。
7、绝育:绝育手术是通过剪除雌鼠卵巢或雄鼠输精管来实现的。将麻醉的雌鼠背面朝上,从其胸腔和尾部之间向下三分之一处剪开一个小口,用镊子将其卵巢取出,上面呈现红色斑点的部分即为卵巢,用剪刀将这一部分剪除,然后用缝合针线将其缝合,缝合方法为将针穿过后,将线缠绕镊子两圈再逆时针缠绕两
圈,再重复缠绕一遍,将镊子夹住线头把缠绕的线移至线头系紧即可(缝合过程全程用镊子和剪刀操作),里面肌肉层以及外面皮层均需缝合。雄鼠则从外生殖器向上1-2cm处剪开小口,用镊子在其中找出输精管(较细长的乳白色小管),尽量多减掉一些,以免其长长愈合,以上述方法缝合伤口即可。
9、解剖:以颈椎脱臼法处死小鼠,使其腹面朝上。用镊子将其腹部皮肤夹起,然后用剪刀剪开,观察各个器官所在位置和形态,解剖完的小鼠放入尸体袋中。
