医疗器械临床试验报告
试验用医疗器械名称:
型号规格:
临床试验较高风险医疗器械目录 是□否□ 中国境内同类产品 有□无□
临床试验机构:
临床试验开始时间:
临床试验结束时间:
方案编号和日期:
方案修改编号和日期(若有): 研究者:
申办者:
监查员:
年 月编号: 日
填写说明
1、临床试验机构和研究者应本着认真负责的态度,严格按照临床试验方案组织开展临床试验,公正、客观地编制临床试验报告。
2、临床试验机构和研究者应当对试验报告的真实性和科学性负责。
3、本报告必须由研究者签字、临床试验机构签章方可生效。
内容:
一、摘要
二、简介
简单介绍试验用医疗器械的相关研发背景(例如原因、目的、目标人群、治疗、时间、主要终点)。
三、临床试验目标
四、临床试验方法
五、临床试验内容
六、临床一般资料
(一)试验范围(病种)
(二)病例的选择
1、入选标准 2、 排除标准
(三)样本量的计算
(四)病例数
入组情况
七、试验产品和对照产品(若有)
(一)试验产品 (二)对照产品(若有)
八、所采用的统计方法及评价方法
(一)统计分析方法
1、分析人群 2、统计分析方法
(二)统计评价指标
1、有效性指标 2、安全性指标
(三)缺失值和异常值的处理
九、临床评价标准
(一)有效性评价标准
1、主要指标 2、次要指标
(二)安全性评价标准
1、主要指标 2、次要指标
十、临床试验的组织结构
十一、伦理报告和知情同意书样张
十二、临床试验结果
十三、临床试验中发现的不良事件及其处理情况
(一)不良事件定义
(二)不良事件严重程度判定
(三)不良事件与试验产品及操作关系的判定
(四)严重不良事件定义
(五)本试验发现的不良事件及其处理情况
十四、临床试验结果分析、讨论
十五、临床试验结论
十六、适应症、适用范围、禁忌症和注意事项
(一)适应症
(二)禁忌症
(三)并发症
(四)警告与注意事项
十七、存在问题及改进建议
十八、试验人员名单
十九、其他需要说明的情况
二十、研究者签名及临床试验机构的试验管理部门意见。
第二篇:医疗器械临床试验报告
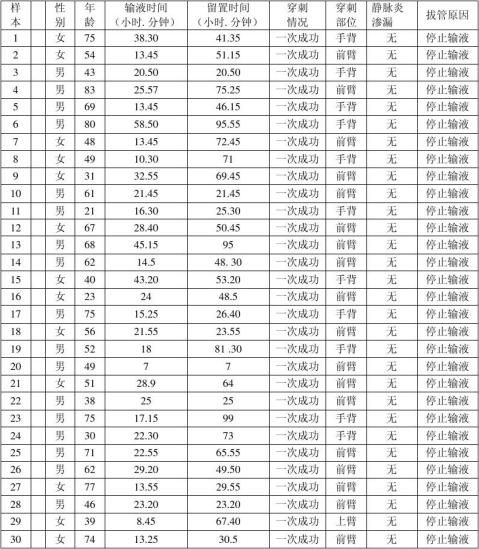
医疗器械临床试验报告
使用统计软件:Minitab 15 简体中文
统计结果:欢迎使用 Minitab,请按 F1 获得有关帮助。
单因子方差分析: C1, C2
来源 自由度 SS MS F P
因子 1 12470 12470 32.59 0.000
误差 58 22194 383
合计 59 34663
S = 19.56 R-Sq = 35.97% R-Sq(调整) = 34.87%
平均值(基于合并标准差)的单组 95% 置信区间 水平 N 平均值 标准差 -------+---------+---------+---------+-- C1 30 22.81 11.64 (-----*-----)
C2 30 51.65 25.09 (-----*-----) -------+---------+---------+---------+-- 24 36 48 60
合并标准差 = 19.56
————— 2012-2-19 13:55:15 ————————————————————
欢迎使用 Minitab,请按 F1 获得有关帮助。
统计结论:
P<0.01
差别有非常显著意义,
表明不同的输液时间、留置时间有显著差别,
试验例数30例具有高度统计学意义和临床代表性。
