化工专业实验报告
实验名称: 实验人员: 同组人: 杨晓武 实验地点:天大化工技术实验中心 室
实验时间:班级/学号:级组 指导教师: 实验成绩:
共沸精馏
一、 实验目的
1. 通过实验加深对共沸精馏过程的理解; 2. 熟悉精馏设备的构造,掌握精馏操作方法; 3. 能够对精馏过程做全塔物料衡算;
4. 学会使用气相色谱分析气、液两相组成。
二、 实验原理
精馏是利用不同组份在气-液两相间的分配,通过多次气液两相间的传质和传热来达到分离的目的。对于不同的分离对象,精馏方法也会有所差异。例如,分离乙醇和水的二元物系。由于乙醇和水可以形成共沸物,而且常压下的共沸温度和乙醇的沸点温度极为相近,所以采用普通精馏方法只能得到乙醇和水的混合物,而无法得到无水乙醇。为此,在乙醇-水系统中加入第三种物质,该物质被称为共沸剂。共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。这种方法就称作共沸精馏。
乙醇-水系统加入共沸剂苯以后可以形成四种共沸物。现将它们在常压下的共沸温度、共沸组成列于表1。为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表2。
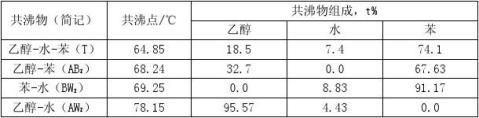

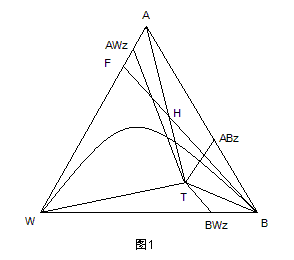
从表1和表2列出沸点看,除乙醇-水二元共沸物的共沸物与乙醇沸点相近之外,其余三种共沸物的沸点与乙醇沸点均有10℃左右的温度差。因此,可以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。 整个精馏过程可以用图1来说明。图中A、B、W分别为乙醇、苯和水的英文字头;ABZ,AWZ,BWZ代表三个二元共沸物,T表示三元共沸物。图中的曲线为25℃下的乙醇、水、苯三元共沸物的溶解度曲线。该曲线的下方为两相区,上方为均相区。图中标出的三元共沸组成点T是处在两相区内。
以T为中心,连接三种纯物质A、B、W及三个二元共沸点组成点ABZ、AWZ、BWZ,将该图分
为六个小三角形。如果原料液的组成点落在某个小三角形内。当塔顶采用混相回流时精馏的最终结果只能得到这个小三角形三个顶点所代表的物质。故要想得到无水乙醇,就应该保证原料液的组成落在包含顶点A的小三角形内,即在ΔATABZ或ΔATAWZ内。从沸点看,乙醇-水的共沸点和乙醇的沸点仅差0.15℃,就本实验的技术条件无法将其分开。而乙醇-苯的共沸点与乙醇的沸点相差10.06℃,很容易将它们分离开来。所以分析的最终结果是将原料液的组成控制在ΔATABZ中。
图1中F代表未加共沸物时原料乙醇、水混合物的组成。随着共沸剂苯的加入,原料液的总组成将沿着FB连线变化,并与AT线交于H点,这时共沸剂苯的加入量称作理论共沸剂用量,它是达到分离目的所需最少的共沸剂量。
上述分析只限于混相回流的情况,即回流液的组成等于塔顶上升蒸汽组成的情况。而塔顶采用分相回流时,由于富苯相中苯的含量很高,可以循环使用,因而苯的用量可以低于理论共沸剂的用量。分相回流也是实际生产中普遍采用的方法。它的突出优点是共沸剂的用量少,共沸剂提纯的费用低。
三、 装置、流程及试剂
1. 装置
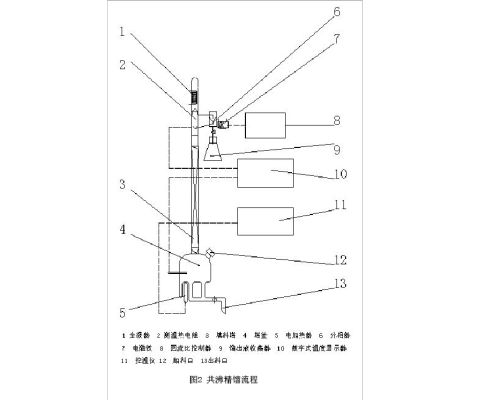
本实验所用的精馏塔为内径Ф20×200mm的玻璃塔。内部上层装有Θ网环型Ф2×2 mm的高效散装填料,下部装有三角网环型的高效散装填料。填料塔高度略高于1.2m。 塔釜为一只结构特殊的三口烧瓶。上口与塔身相连:侧口用于投料和采样;下口为出料口;釜侧玻璃套管插入一只测温热电阻,用于测量塔釜液相温度,釜底玻璃套管装有电加热棒,采用电加热,加热釜料,并通过一台自动控温仪控制加热温度,使塔釜的传热量基本保持不变。塔釜加热沸腾后产生的蒸汽经填料层到达塔顶全凝器。为了满足各种不同操作方式的需要,在全凝器与回流管之间设置了一个特殊构造的容器。在进行分相回流时,它可以用作分相器兼回流比调节器;当进行混相回流时,它又可以单纯地作为回流比调节器使用。这样的设计既实现了连续精馏操作,又可进行间歇精馏操作。
此外,需要特别说明的是在进行分相回流时,分相器中会出现两层液体。上层为富苯相、下层为富水相。实验中,富苯相由溢流口回流入塔,富水相则采出。当间歇操作时,为了保证有足够高的溢流液位,富水相可在实验结束后取出。
2. 流程
3. 试剂
实验试剂有80g乙醇(化学纯),含量95%;苯(分析纯)35g,含量99.5%。
四、 实验步骤
1. 将原料加入塔釜,打开电源,记录时间、塔釜及塔顶的初始温度和加热电流;
2. 30分钟后打开回流比,调至5:1,再20分钟后调至3:1;
3. 溢流开始后,仍有水珠连续流出的条件下,将回流比调至1:1,再过10分钟后调
至1:3至结束;
4. 3小时后开始蒸出过量的苯,根据色谱分析结果,分次放出若干量蒸出液,直至将
塔釜内苯内苯蒸净;
5. 将所有蒸出液放入分液漏斗内,静置5分钟,将分离后的富苯相和富水相分别称重,
并分别分析。
五、 实验原始数据
表3 精馏过程各时刻实验记录
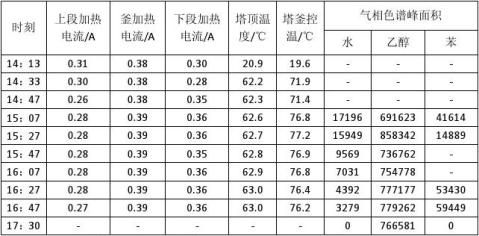
表4 塔顶塔釜产物分析记录
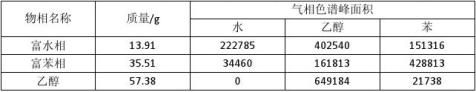
备注:1. 气相色谱操作条件:压力为0.065MPa,汽化室温度为130℃,柱箱温度为165℃。 2. 各物质校正因子:f(Water)=0.758,f(Alcohol)=1,f(Benzene)=1.330。
六、 实验数据处理
1. 做全塔物料衡算,并对共沸物形成的富水相和富苯相进行分析和衡算,求出塔顶三
元共沸物的组成。
1) 对塔内乙醇进行物料衡算 原料液中乙醇含量:80*0.95=76g 富水相中乙醇质量分数:
402540?1
=0.521
富水相中乙醇含量:13.91*0.521=7.247g 富苯相中乙醇质量分数:
xdwa=
161813?1
=0.213
富苯相中乙醇含量:35.51*0.213=7.564g 塔釜中乙醇含量:
xdba=
649184?57.38
=54.934g
649184+21738?1.330
则塔内残余乙醇的含量为:La=76-7.247-7.564-54.934=6.255g 2) 对塔内苯进行物料衡算
mba=mb?xba=
原料液中苯含量35g
富水相中苯含量:
mdwb=mdw?xdwb=
富苯相中苯含量:
mdbb=mdb?xdbb=
塔釜液中苯的含量:
21738?1.330?57.38=2.446g
则塔内残余苯的含量为:Lb=35-3.623-26.708-2.446=2.222g
3) 对塔内水进行物料衡算
原料液中水含量为80*0.05=4g
富苯相中水含量: mbb=mb?xbb=
mdbw=mdb?xdbw=
富水相中水含量:
222785?0.758?13.91=3.040g 塔内残余水含量:4-1.224-3.040=-0.264g
4) 塔内总持液量为:80+35-35.51-13.91-57.38=8.2≈6.255+2.222-0.264
5) 对物料衡算结果的分析:
塔内总持液比例: mdww=mdw?xdww=
8.2?100%=7.130% 从上述计算可以看出,塔内持液占了不小的比例,其中既包括了乙醇,也包括了苯。两者质量比例大约为2.8150:1。当然除了塔内残留一部分外,可能还有一些乙醇通过各种可能途径挥发了。对于塔内水的衡算结果为负值这一事实,我认为这是由于在进行塔釜产品衡算时,对气相色谱的分辨率设置过低,导致水的色谱峰没有被识别所造成。
6) 塔顶三元共沸物组成计算
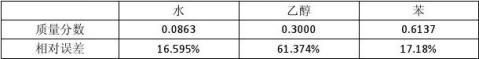
组分水所占比例: ω=
ωw=
相对误差:
rw=|
组分乙醇所占比例:
ωa=
相对误差: 7.247+7.564?100%=29.970% 0.08628?0.074|×100%=16.595% 1.224+3.040?100%=8.628% 34469?0.758?35.51=1.224g 428813?1.330?35.51=26.708g 34469?0.758+161813+428813?1.330151316?1.330?13.91=3.623g
ra=|
组分苯所占比例: 0.29970?0.185|×100%=62.000% 26.708+3.623?100%=61.374% ωb=
相对误差:
0.61374?0.741|×100%=17.18% 总结上述结果得到下表:
rb=|
七、 思考题
1. 如何计算共沸剂的加入量?
1) 在指定的压力下,做水-乙醇-苯的三角相图;
2) 根据相关文献在图上确定共沸物组成点(自
由度为1,所以务必确定是该压力下的共沸
点组成),包括三元共沸物,所有可能的二
元共沸物。按照实验原理中的说明做出下面
的连线。由沸点参数可知,原料液组成应控
制在ΔATABZ中;
3) 连接F,B两点,交ΔATABZ于H和I,这两
点分别是加入共沸剂的最小量和最大量。
4) 从图上可以读出各线段长度。利用杠杆规则,
若混合液的组成为I, 则mB=mF*|IF|/|BI|;若混合液组成为H,则
mB=mF*|HF|/|BH|。I和H之间的组成点所用到的共沸剂量应在这两个值之间。
2. 需要测出哪些量才可以作全塔的物料衡算?具体的衡算方法是什么?
总共需要六个数据才能对全塔进行物料衡算,具体分别是:1、塔釜液质量mb;2、塔顶富水相质量mdw;3、塔顶富苯相质量mdb;4、塔釜残液各组分质量分数xbi;5、塔顶富水相各组分质量分数xdwi;6、塔顶富苯相各组分质量分数xdbi;7、原料液质量mf;8、原料液各组分的质量分数xfi。
具体衡算方法如下:忽略塔内总持液量的影响,对塔内各个组分列算式:
mf*xfi-mdw*xdwi-mdbi*xdbi-mb*xbi,如果结果近似等于0,则认为该组分在全塔范围内守恒。否则需要将塔内损失考虑在内。
3. 将计算出的三元共沸物组成与文献值比较,求出其相对误差,并分析实验过程中产
生误差的原因。
相对误差见表5。之所以会引起误差,主要是因为该求算方法计算的只是塔顶馏出液的组成,而塔顶馏出液实际上是三元共沸物与二元共沸物的混合液。该实验过程并没有很好地对三元共沸物蒸尽的临界点进行控制,因而没法按照精确方法计算。
八、 参考文献
[1]. E A Coulson, etal ,Laboratory Distillation Practice, L.George News Ltd,1958
[2]. Erich Krel, Handbook of Laboratory Distillation, Amsterdam, Elsevier, 1982
[3]. 陈洪钫,基本有机化工分离工程,北京:化学工业出版社1985
[4]. F G Shinskey, Distillation Control for Productivity and Energy Conservation 2nd ed, New
York, Mc Graw-Hill Book co, 1984 2nd
[5]. Hoanh N Pham,et al. Chemical Engineering Science 1990,45(7):1823
第二篇:什么是恒沸精馏(共沸精馏)
一、什么是恒沸精馏(共沸精馏)
在被分离的物系中加入共沸剂(或者称共沸组分),该共沸剂必须能和物系中一个或几个组分形成具有最低沸点的恒沸物,以至于使需要分离的集中物质间的沸点差(或相对挥发度)增大。在精馏时,共沸组分能以恒沸物的形式从精馏塔顶蒸出,工业上把这种操作称为恒沸精馏。
下面以制取无水酒精为例,说明恒沸精馏的过程,水和酒精能形成具有恒沸点的混合物,所以用普通的精馏方法不能获得纯度超过96%(体积)的乙醇,若在酒精和水的溶液中加入共沸组分-苯,则可构成各种恒沸混合物,但以酒精、苯和水所组成的三组分恒沸混合物的沸点为最低(64.84℃)。当精馏温度在64.85℃时,酒精、苯和水的三元混合物首先被蒸出;温度升至68.25℃时,蒸出的是酒精与苯的二元恒沸混合物;随着温度继续上升,苯与水的二元恒沸混合物和酒精与水的二元恒沸混合物也先后蒸出,这些恒沸物把水从塔顶带出,在塔釜可以获得无水酒精。工业上广泛地用于生产无水酒精的方法,就是根据此原理。
恒沸精馏的过程中,所加入的共沸组分必须从塔顶蒸出,而后冷凝分离,循环使用。因而恒沸精馏消耗的能量(包括汽化共沸剂的热量和输送物料的电能)较多。
二、什么是萃取精馏?
在被分离的混合物中加入萃取剂,萃取剂的存在能使被分离混合物的组分间的相对挥发度增大。精馏时,其在各板上基本保持恒定的浓度,而且从精馏塔的塔釜排出,这样的操作称为萃取精馏。
例如,从烃类裂解气的碳四馏分费力丁二烯时,由于碳四馏分的各组分间沸点相近及相对挥发度相近的特点,而且丁二烯与正丁烷还能形成共沸物,采用普通的精馏方法是难以将丁二烯与其它组分加以分离的。如果采用萃取精馏的方法,在碳四馏分中加入乙腈做萃取剂,则可增大组分间的相对挥发度,使得用精馏的方法能将沸点相近的丁二烯、丁烷和丁烯分离。 碳四馏分经过脱碳三、和碳五馏分后,进入丁二烯萃取剂精馏塔,在萃取剂乙腈的存在下,使丁二烯(包括少量的炔烯)、乙腈与其它组分分开,从塔釜采出并进入解析塔,在此塔中,丁二烯、炔烯从乙腈中解析出来,萃取剂循环使用。丁二烯、炔烯进入炔烯萃取精馏塔,丁二烯从塔顶逸出,经水洗,得到成品丁二烯。
三、恒沸精馏和萃取精馏有什么区别?
(1)萃取精馏的萃取剂,不必要与分离系统中的某组分形成共沸物,而要求它的蒸气压远小于分离混合物的蒸气压,因此萃取剂的选用范围比较大。
(2)萃取精馏的操作条件与恒沸精馏相比,可以在较大的范围内变动。
(3)萃取精馏因萃取剂不从塔顶蒸出,因此,蒸气的消耗比恒沸精馏为少。
(4)萃取精馏适用于从塔顶蒸出较多的产品和从塔釜排出较少的产品的情况;而恒沸精馏适用于从塔顶蒸出较少的产品和从塔釜排出较多的产品的情况。因为在上述情况下萃取组分或共沸组分的加入量相对的较少,能量消耗也随之较少。
四、共沸组分选择的原则是什么?
(1)必须能与被分离物系中一个或几个组分形成具有最低沸点的恒沸物,这是最基本的一条。(2)对改变被分离物系组分间的相对挥发度足够有效,加入共沸组分后所形成的恒沸物,其沸点温度与被分离组分沸点间的假别愈大,共沸精馏越容易进行。这往往在所选择的共沸组分的沸点相当接近于被分离组分的沸点时能实现。
(3)其有效的分离作用而不需要很多的共沸组分。恒沸物中被分离组分的含量愈高,则共沸组分的用量愈少,汽化共沸组分所消耗的热能也就愈少,精馏就愈经济。
(4)共沸组分易分离和回收。
(5)共沸组分的性质稳定面对设备的腐蚀性要小,对人体的毒性要小。
(6)合理的挥发性。
(7)价格低廉。
五、萃取剂的选择原则是什么?
对于萃取精馏来说,萃取剂常常可以选择出许多种。如从碳四馏分种分离出丁二烯,就可以找出多种萃取剂。一般说来,选择萃取剂的主要依据如下:
(1)萃取剂的选择性要大。被分离组分在萃取剂种相对挥发度增大的赴欧,分离就容易,也就是所选择的萃取剂选择性大。选择性是选择萃取剂最主要的依据。因为选择性的大小也就决定了被分离组分种轻重关键组分分离的难易程度。因此塔板数的多少,回流比的大小(它影响到塔径)也与它有密切的关系。
(2)萃取剂对被分离组分的溶解度要大,这样塔板上的液体才能形成均相,不会分层。
(3)萃取剂的沸点应比被分离组分的沸点高的多,否则萃取剂易从塔顶挥发损失掉。
(4)热稳定性、化学稳定性要好,无毒性,不腐蚀设备。
(5)回收容易,价廉易得。
