实验4:配制100mL1.00 mol/L的NaCl溶液
班级: 姓名:
【实验目的】
1、练习配制一定物质的量浓度的溶液;
2、加深对物质的量浓度概念的理解;
3、练习容量瓶的使用方法
【实验仪器药品】
药匙、小烧杯、 、 、 、玻璃棒、量筒
【实验药品】
NaCl固体、
【实验步骤】
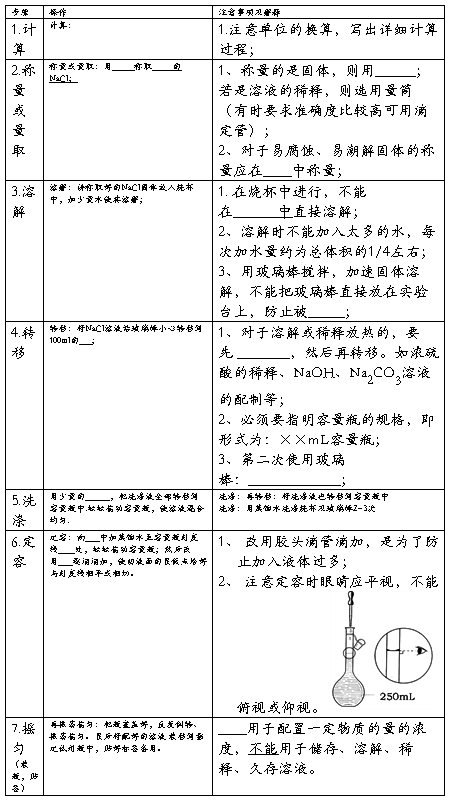
【交流与思考】
1、 容量瓶使用时应注意的事项:
2、 为什么要用蒸馏水来配置溶液而不能用自来水配置呢?
3、 为什么要洗涤玻璃棒和烧杯?如何洗涤?
4、 能否将溶解的NaCl溶液立即注入容量瓶中?为什么?
5、 为什么要将配好的溶液,从容量瓶里倒入试剂瓶?
6、 定容时不慎滴加液体超过刻度线,则该怎么做?
7、 谈谈你对本次实验的感受;
8、 下列实验操作会使所配制的溶液浓度偏高,偏低,还是不变?为什么?
①把溶液向容量瓶中转移,有少量溶液溅出;( ) 原因: ;
②未洗涤烧杯和玻璃棒;( ) 原因: ;
③定容时加水超过了刻线;( )原因: ;
④定容时仰视观察液面;( )原因: ;
⑤定容时俯视观察液面;( )原因: ;
⑥将溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;( )原因: ;
⑦将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;( )原因: ;
⑧定容时,俯视观察容量瓶刻度线;( )原因: ;
第二篇:水、饱和氯化钠溶液的电解实验报告
水、饱和氯化钠溶液的电解
一、 实验目的
1、 掌握演示电解水和电解饱和食盐水实验操作技能;
2、 初步掌握这两个实验的讲解方法;探索、设计电解水器的代用装置。
二、 实验原理
1、 水的电解:
阴极反应:4H++4e- →2H2↑
阳极反应:4OH--4e- →2H2O+O2↑
总反应:2H2O 通电 2H2↑+O2↑
电解水时,加入的电解质并不参与电极反应,主要是为了增加导电性。浓度过低,达不到效果,以5%以上为宜。
2、 饱和NaCl溶液的电解:
i 正接:阴极:Fe;阳极:碳棒。
阴极反应:2H++2e- →H2↑
阳极反应:2Cl--2e- →Cl2↑
总反应:2NaCl+2H2O 通电 H2↑+Cl2↑+2NaOH
ii 反接:阴极:碳棒;阳极:Fe。
阴极反应:2H++2e- →H2
阳极反应:Fe-2e- →Fe(OH)2↓
总反应: 2H2O +Fe通电 Fe(OH)2↓+H2↑
iii 直接反接:阴极:碳棒;阳极:Fe。
阴极反应:2H++2e- →H2
阳极反应:Fe-2e- →Fe2+
总反应:2H2O +Fe通电 Fe(OH)2↓+H2
三、 主要仪器、材料与药品
霍夫曼电解水器、直流低压电源、具支U形管、烧杯石墨电极、铁电极、导线。
固体NaOH、酚酞试液、淀粉KI试纸、饱和NaCl溶液。
四、 实验内容
1、 水的电解
i 使用霍夫曼电解水器电解水
使用前,先用水检验霍夫曼电解水器(图一)的气密性。方法是将上部的两个旋钮关闭,塞紧下面的塞子,从贮液器加入水,到一定高度时,在贮液器液面处做一标记,数分钟后看液面是否下降,若不下降则说明气密性良好,否则需要给旋钮涂抹凡士林,并检查塞子是否塞好。
打开霍夫曼电解水器上部的两个旋钮,加水加到最高刻度处,量取加入水的体积,这就是需要加入的5%的NaOH溶液的体积。
配制5%的NaOH溶液,冷却至室温后,由贮液器加入5%的NaOH溶液到刻度管的最高刻度处,赶尽气泡后关闭旋钮,连接导线与低压直流电源。接通电源,调解电压为20V(电压范围为14~24V,但是20V时,现象最为明显)时,可看到刻度管内有大量的气泡放出,电解大约有1-2cm气柱时停止电解,静置一会使管内的气泡全部上升后,将气体放出。

图1.1霍夫曼电解水器
再次接通电源开始电解,约10min,可以看到阴极产生的气体的体积为阳极的2倍
ii 检验电解出来的气体
打开阴极旋钮,调节速度使液面缓慢上升(先徘一会,将导气管内的空气排出,防止氢气中混有空气,发生爆炸),在阴极的尖嘴处点燃(若尖嘴口太大,可用比尖嘴稍细一点的木棍塞上使气体能够出来,而空气不能够进去),用干燥的小烧杯罩住火焰,看到烧杯壁上有水雾生成,说明阴极生成的是H2。
打开阳极旋钮,调节速度使液面缓慢上升,将带火星的木条放在阳极的小型漏斗内,发现木条复燃,说明阳极生成的是O2。
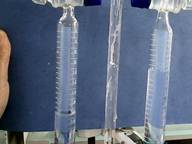


图1.2气体体积比2:1 图1.3阴极气体燃烧 图1.4阳极气体助燃
2、 饱和NaCl溶液的电解
如图二所示,向具支U形管中滴加饱和NaCl溶液至支管以下约2cm处,并从两管口各滴加2滴酚酞试液,装上铁阴极和石墨阳极(铁电极和石墨电极使用时,要想进行预处理,用砂纸打磨铁电极,除去铁锈,用水清洗石墨电极),接通低压直流电源(6~12V)。可以看到电极附近有大量气泡产生。在阴极区,溶液变红,说明阴极区溶液呈碱性;在阳极区上方,用润湿的KI淀粉试纸试之,变蓝,说明在阳极区有Cl2生成。
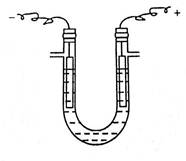


图2.1 电解NaCl水溶液装置 图2.2电解NaCl水溶液现象
3、 探究实验
i 不换溶液在上述实验的基础上反接阴极和阳极,发现在铁电极的一侧出现白色絮状沉淀,并且沉淀向下移动,在具支U型管底部慢慢变为灰绿色,这是因为Fe(OH)2在向Fe(OH)3转变。溶液中的氧化性物质渐渐将Fe(OH)2氧化为Fe(OH)3。


图3.1(反接)电解NaCl水溶液现象
ii 直接反接(铁电极做阳极,石墨电极做阴极),电解时发现电极附近没有Fe(OH)2絮状沉淀生成,看见铁电极附近溶液变黄,且黄色渐渐向下移动,在具支U形管底部生成灰绿色沉淀。该过程为:电解产生的Fe2+被向阴极移动与向阳极移动的OH-反应,生成Fe(OH)2,溶液中的氧化性物质会将Fe(OH)2氧化成Fe(OH)3,所以底部有灰绿色沉淀生成。

图3.2(直接反接)电解NaCl水溶液现象
