
《环境化学》实验报告
实验项目:空气中氮氧化物的日变化曲线
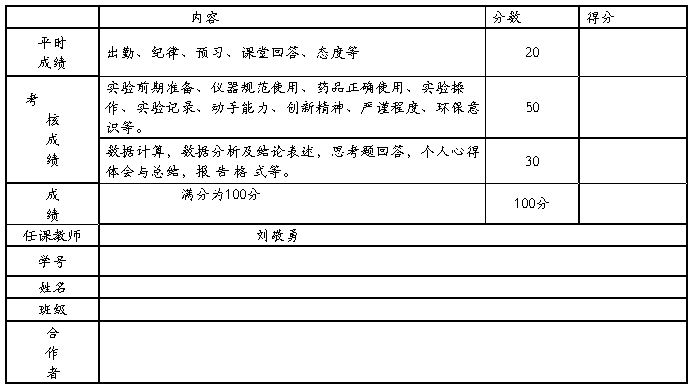
实验考核标准及得分
一、实验目的与要求
1、了解氮氧化物的具体种类及其来源。
2、掌握氮氧化物测定的基本原理以及实验方法。
二、实验方案
1、实验仪器:大气采样器:流量范围0.2L/min、分光光度计(波长540nm)、多孔吸收玻管、比色管(两个)、移液管、洗耳球、比色皿、烧杯。
2、实验药品:氮氧化物吸收原液、蒸馏水、亚硝酸钠标准溶液。
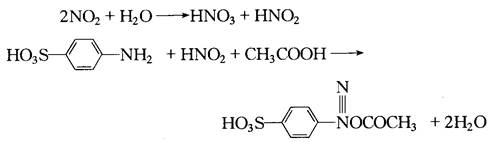
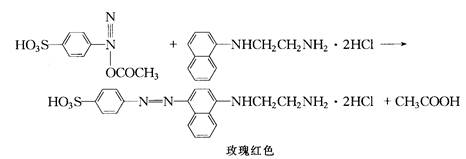
3、实验原理:在测定氮氧化物时,先用三氧化铬将一氧化氮等低价氮氧化物氧化成二氧化氮,二氧化氮被吸收在溶液中形成亚硝酸,与对氨苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,用比色法测定。方法的检出限为0.01mg/L(按与吸光度0.01相应的亚硝酸盐含量计)。限行范围为0.03-1.6mg/L。当采样体积为6L时,氮氧化物(一二氧化氮计)的最低检出浓度为0.01ug/m³。盐酸萘乙二胺盐比色法的有关反应式如下:
4、实验步骤:
(1)氮氧化物的采集:向一支多孔吸收玻管中加入4mL氮氧化物吸收原液和1mL蒸馏水,接上大气采样器,置于椅子上,以每分钟0.2L流量抽取空气30min。记录采样时间和地点,根据采样时间和流量,算出采样体积。把一天分成几个时间段进行采样7次,分别为10:00~10:30、11:00~11:30、12:00~12:30、13:00~13:30、14:00~14:30、15:00~15:30、16:00~16:30。
(2)氮氧化物的测定:
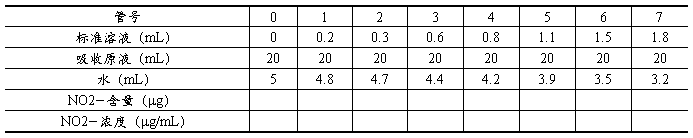
标准曲线的绘制:吸取100mg/L的亚硝酸钠标准溶液5mL定容至100mL,再取7支比色管,按下表配制标准系列。

将各管摇匀,避免阳光直射,放置15 min,以蒸馏水为参比,用1cm比色皿,在540nm波长处测定吸光度。
样品的测定:采样后放置15min,将吸收液直接倒入1cm比色皿中,在540nm处测定吸光度。
三、实验结果与数据处理
根据吸光度与浓度的对应关系,用最小二乘法计算标准曲线的回归方程式:
y = bx+a
式中:y——(A-A0),标准溶液吸光度(A)与试剂空白吸光度(A0)之差;
x——NO2-含量,μg;
a、b——回归方程式的截距和斜率。
ρNOx = 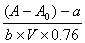
式中:ρNOx——氮氧化物浓度,mg/m3;
A——样品溶液吸光度;
A0、a、b表示的意义同上;
V——标准状态下(25℃,760mmHg)的采样体积,L;
0.76——NO2(气)转换成NO2-(液)的转换系数。
根据实验测定的数据,稀释后亚硝酸钠标准溶液吸光度如下表所示:
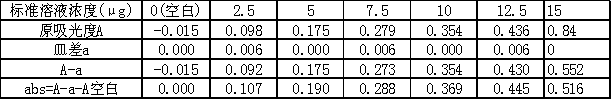 根据上表,绘制稀释后亚硝酸钠标准曲线如下图所示:
根据上表,绘制稀释后亚硝酸钠标准曲线如下图所示:
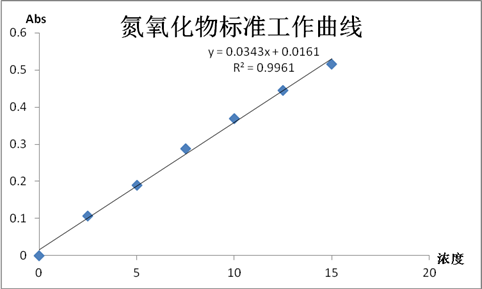
根据上式y=0.0355x+0.0111可知,a=0.0343,b=0.0161。
计算示例:在10:00-10:30时,对于采样流速为0.2L/min的溶液,A=0.073(扣除皿差),A空白=-0.015,V=0.2L/min*30min=6L,根据公式ρNOx = 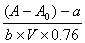 则氮氧化物的浓度C=(0.073+0.015-0.0343)/(0.0161*0.76*6)=0.731mg/m³。
则氮氧化物的浓度C=(0.073+0.015-0.0343)/(0.0161*0.76*6)=0.731mg/m³。
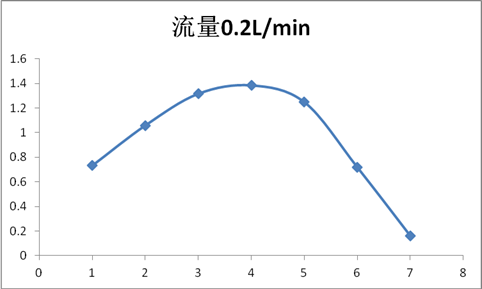
根据实验测得的数据以及计算得到,空气中氮氧化物的吸光度及其浓度如下表所示:

根据上表绘制氮氧化物日变化曲线如下图所示:
四、结论
A、数据评价:
由于实验设备出问题,我们小组的采样器只有一个流量能用,因此只做了流量为0.2L/min的日变化曲线。
因为只做了一个流量,所以有一个U形管闲置,被我们提前装好了吸收液,而且在空气中暴露了很长时间,导致测得的数据远远超过实际值。到最后一组实验时,我们小组终于意识到了这个问题,用了现配现用的方式测了最后一组数据。
B、判定污染程度:
查阅《环境空气质量标准》(GB3095-1996)知氮氧化物在空气中的浓度限值:

此次实验测得的氮氧化物日变化浓度,氮氧化物最大浓度Cmax=1.385 mg/m3>0.15 mg/m3,即空气中氮氧化物不符合环境空气质量的三级标准,故实验当天的空气质量是有污染,应对其进行控制防范。
C、处理方案:在大气中的氮氧化物污染物主要来源于燃料燃烧。因此氮氧化物污染物的防治技术是根据燃烧过程的特点来设计的,目前正在使用的减少氮氧化物排放量的措施有三种,即燃烧前的处理、燃烧技术的改进和燃烧后的治理。
(1)燃烧前的处理:通过脱氮,减少燃料中的含氮量,从而减少燃烧过程氮氧化物的生成量。
(2)燃烧技术的改进形式:一是低氧燃烧,二是排气循环燃烧,三是注入蒸汽或水,四是二级燃烧,五是分段燃烧,六是降低空气比,七是浓差燃烧。其中效果最好的是二级燃烧和差燃烧。
另外,人们在二级燃烧的基础上又发展了三级燃烧法,即扩大还原燃烧法和采用碳氢化合物在炉内进行脱硝反应的燃料再注入法。具体做法是在一次燃烧后加入燃料,制造一个缺乏空气的还原领域,把一次燃烧成的氮氧化物还原,最后加入空气完全燃烧。
(3) 燃烧后处理:燃烧后处理也就是对燃烧后产生的烟气进行脱氮处理,有时也称为烟气脱硝。烟气脱硝是当前治理氮氧化物中最重要的方法。目前废气脱硝技术有干法和湿法两大类。干法包括催化还原法、吸附法和电子束照射法,而催化还原法又分为选择性催化还原法和选择性非催化还原法;湿法则包括直接吸收法、络合吸收法、氧化吸收法、液相还原和微生物净化法等。
其中,湿法烟气脱硝是利用液体吸收剂将NOx溶解的原理来净化燃煤烟气其最大的障碍是NO很难溶于水往往要求将NO首先氧化为NO2 。为此一般先将NO通过与氧化剂O3 、ClO2 或KMnO4反应氧化生成NO2 然后NO2 被水或碱性溶液吸收实现烟气脱硝。
五、问题与讨论
1、查资料简要说明光化学烟雾形成的机理,危害和控制对策。
答:光化学烟雾的形成条件是大气中有氮氧化物和碳氢化物存在,大气温度较低,而且有强烈的阳光照射,这样在大气中就会一系列复杂的反应,生成出一些二次污染物,如O3、醛、PAN、H2O2等。
光化学烟雾是一个链式反应,其中关键性的反应可以简单地分成3组:
(1)NO2的光解导致O3的生成: 链引发反应主要是NO2的光解,反应如下: NO2 +hv→NO +O O +O2 +M→O3 +M NO +O3→ NO2 +O2
(2)(HC)氧化生成了具有活性的自由基,如HO、HO2、RO2等。 在光化学反应中,自由基反应占很重要的地位,自由基的引发反应主要是由NO2和醛光解引起的: NO2 +hv→NO +O RCHO +hv→RCO +
碳氢化合物的存在是自由基转化和增殖的根本原因: RH +O →R +HO
RH + HO →R +H2O H + O2 →HO2 R + O2→RO2 RCO+ O2→[RC(O)O2]
其中:R—烷基;RO2—过氧烷基; RCO—酰基; [RC(O)O2]—过氧酰基。
(3)通过以上途径生成的HO2、RO2、[RC(O)O2]均可将NO氧化成NO2。
NO +HO2 →NO2 +HO NO +RO2→NO2 +RO RO +O2 →HO2 +RCHO
NO + RC(O)O2→NO2 + RC(O)O RC(O)O→R +CO2
其中:RO—烷氧基; RCHO—醛。
光化学烟雾的危害:光化学烟雾成分复杂,但是,对动物、植物和材料有害的主要是O3、PAN、醛、酮等二次污染物。人和动物受到的主要伤害是眼睛和黏膜受到刺激、头痛、呼吸障碍、慢性呼吸道疾病恶化、儿童肺功能异常等。植物受到臭氧的损害,开始时表皮褪色,呈蜡质状,经过一段时间之后色素发生变化,叶片上出现红褐色斑点。PAN使叶子背面呈银灰色或古铜色,影响植物的生长,降低植物对病虫害的抵抗力。O3、PAN等还能造成橡胶制品老化,脆裂,使染料褪色,并损害油漆涂料、纺织纤维和塑料制品等。
光化学烟雾的控制对策:工业上,较好的措施是对煤进行加工,改进燃烧技术,同时改进生产工艺,对污染物进行后处理及合理排放。使用前对煤进行脱硫加工,并尽可能除去灰分;使用过程中,通过对锅炉进行适当改进,同时加人固硫剂,可减少烟尘利二氧化硫的发生量;最后,对废气进行综合利用后,对不能利用的进行无害处理后再进行排放。对于生活燃煤,除了对煤迹行加工外,比较好的措施是改进用能和供能方式,采用集中供热、城市燃气化。集中供热和城市燃气化,是城市节能和综合整治的重要内容,能有效地改善城市大气环境质量,减少室内空气污染。 此外,重点研究改革燃料和改进汽车设备结构, 试制无公害汽车和发展高效交通系统。具体举措为: (1 )改革燃料。(2 )改进汽车设备结构。(3 )研究无公害汽车和发展高效交通系统。
2、假如调查大学城中环西路汽车尾气的排放情况,该如何布点,请简要画图并说明理由?
答:对大学城中环西路监测点的布设根据以及理由如下:
A、监测点周围附近无强大的电磁干扰,周围有稳定可靠的电力供应,通信线路容易安装和检修。
B、对于道路交通的污染监测点,其采样口离地面高度应为2-5米。
C、根据点式监测仪器采样口与道路边缘之间最小间隔距离表知,在道路日平均机动车流量小于3000辆的中环西路上,采样点与道路边缘之间最小间隔距离为10米,但是最大距离间隔不得超过20米,故在距公路边缘13米处设置采样点。D、根据我国空气污染例行监测的采样点设置数目,在广州这个人口大于400万人的城市,最少要设置7个采样点,又根据中环西路长约5000米,故每500米设一个采样点,总共设10个采样点。
E、由于大学城没有较严重的污染源且污染程度小、分布较为均匀,故采用网格布点法。
F、查阅气象资料知,12月份大学城的主要风向是北风,故采样点总数的60%应设在下风向处,即对于总共10个采样点,应有六个采样点设置在下风向区,其余四个采样点设在上风区。
布点图略
3.空气中氮氧化物日变化曲线说明什么?
说明大气中的氮氧化物不是一成不变的,会随着时间变化而变化。当然,引起这些变化的原因不是时间,而是不同时间段里人为(车流量、工厂废气排放)或自然(温度、风向)因素的变化而引起的。
4.通过实验测定结果,你认为交通干线空气中氮氧化物的污染状况如何?
汽车尾气是大气中氮氧化物污染的主要来源之一,所以交通干线空气中氮氧化物的污染应该是非常严重的,污染的严重程度与车流量有直接关系,上下班高峰期或节假日出行高峰期的污染应该是最严重的。
六、体会
本次试验,由于吸收液不但没有现用现配,而且还在空气中暴露了很长时间,导致试验结果跟别的小组相比存在非常大的误差,这让我明白,实验过程中一定要细心,一定要把会影响到实验结果的因素考虑周全,有些课本上没提及的注意事项如果没有注意到,往往会导致事倍功半。
第二篇:空气中氮氧化物
空气中氮氧化物(NOx)的测定
(盐酸萘乙二胺分光光度法)
1、实验目的
(一)熟悉、掌握小流量大气采样器的工作原理和使用方法;
(二)熟悉、掌握分光光度分析方法和分析仪器的使用;
(三)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。
2、实验原理
大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO2),测定氮氧化物浓度时,先用三氧化铬(CrO3)氧化管将一氧化氮成二氧化氮。 二氧化氮被吸收在溶液中形成亚硝酸(HNO2),与对氨基苯磺酸起重氧化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料。于波长540~545之间测定显色溶液的吸光度,根据吸光度的数值换算出氮氧化物的浓度,测定结果以二氧化氮表示。 本法检出限为0.05μg/5mL,当采样体积为6L时,最低检出浓度为0.01μg /m3。
3、实验仪器和试剂
(一)实验用仪器
除一般通用化学分析仪器外,还应具备:多孔玻板吸收管、 空气采样器(KC—6型)、 双球玻璃氧化管(内装涂有三氧化铬催化剂的石英砂)、 分光光度计(7220型)、KC—6D型大气采样器
(二)实验用试剂
所有试剂均用不含硝酸盐的重蒸蒸馏水配制。检验方法是要求用该蒸馏水配制的吸收液的吸光度不超过0.005(540~545nm,10mm比色皿,水为参比)。
1. 显色液:称取5.0克对氨基苯磺酸,置于200毫升烧杯中,将50毫升冰醋酸与900毫升水的混合液分数次加入烧杯中,搅拌使其溶解,并迅速转入1000毫升棕色容量瓶中,待对氨基苯磺酸溶解后,加入0.03克盐酸萘乙二胺,用水稀释至标线,摇匀,贮于棕色瓶中。此为显色液,25℃以下暗处可保存一月。
采样时,按四份显色液与一份水的比例混合成采样用的吸收液。
2. 三氯化铬—砂子氧化管:将河砂洗净,晒干,筛取20~40目的部分,用(1+2)的盐酸浸泡一夜后用水洗至中性后烘干。将三氧化铬及砂子按(1+20)的重量混合,加少量水调匀,放在红处灯下或烘箱里于105℃烘干,烘干过程中应搅拌数次。做好的三氧化铬—砂子应是松散的,若粘在一起,说明三氧化铬比例太少,可适当加一些砂子,重新制备。
将三氧化铬—砂子装入双球玻璃管中,两端用脱脂棉塞好,并用塑料管制的小帽将氧化管的两端盖紧,备用。
3. 亚硝酸钠标准贮备液:将粒状亚硝酸钠(优级纯)在干燥器内放置24小时,称取0.3750克溶于水,然后移入1000毫升容量瓶中,用水稀释至标线。此溶液每毫升含250微克NO 2- ,贮于棕色瓶中,存放在冰箱里,可稳定三个月。
4. 亚硝酸钠标准水溶液:临用前,吸取1.00毫升亚硝酸纳标准贮备液于100毫升容量瓶中,用水稀释至标线。此溶液每毫升含2.5微克NO 2- 。
4、实验步骤
1. 采样:将10毫升采样用的吸收液注入多孔玻板吸收管中,吸收管的进气口接三氧化铬—砂子氧化管,并使氧化管的进气端略向下倾斜,以免潮湿空气将氧化剂弄湿污染后面的吸收管。吸收管的出气口与大气采样器相连接,以0.4升/分的流量避光采样至吸收液呈浅玫瑰红色为止(采气4~24升)。如不变色,应加大采样流量或延长采样时间。在采样同时,应检测采样现场的温度和大气压力,并做好记录。
2. 测定步骤:
①标准曲线的绘制:取6支10毫升比色管,按表1所列数据配制标准色列。
测定二氧化氮时所配制的标准色列
加完试剂后,摇匀,避免阳光直射,放置20分钟,用1厘米比色皿,于波长540纳米处,以水为参比,测定吸光度。扣除空白试剂的吸光度以后,对应NO 2- 的浓度ug/mL,用最小二乘法计算标准曲线的回归方程。用测得的吸光度对5毫升溶液中亚硝酸根离子含量(微克)绘制标准曲线,并计算各点比值。
②样品的测定:采样后,室温放置二十分钟,20℃以下时放置四十分钟以上。将吸收液移入比色皿中,与标准曲线绘制时的条件相同测定空白和样品的吸光度。
5、实验结果与数据处理
1. 计算:
氮氧化物(NO2?,mg/m3)
式中: A—试样溶液的吸光度;
A0—空白液的吸光度;
a—标准曲线截距;
b—标准曲线斜率;
Vr—换算为参比状态下的采样体积;
f—实验系数(0.88),当空气中NO2的浓度高于0.720 mg/m3时,为0.77;
D—气样吸收液稀释倍数
2. 注意事项:
①配制吸收液时,应避免在空气中长时间曝露,以免吸收空气中的氮氧化物。光照射能使吸收液显色,因此在采样、运送及存放过程中,都应采取避光措施。
②采样过程中,如吸收液体积显著缩小,要用水补充到原来的体积(应预先作好标记)。
③氧化管应于相对湿度为30%~70%时使用,当空气相对湿度大于70%时,应勤换氧化管;小于30%时,在使用前,用经过水面的潮湿空气通过氧化管,平衡1小时后再使用。
6、讨论
(一)小流量大气采样器的基本组成部分及其所起作用。
(二)简要说明盐酸萘乙二胺分光光度法测定大气中NOx的原理和测定过程。
(三)分析影响测定准确度的因素,如何消减或杜绝在样品采集、运输和测定过程中引进的误差。
