实验二 循环伏安法研究Fe(CN)63-/Fe(CN)64-
【实验目的】
1. 了解循环伏安法的基本原理及操作技术
2. 通过测定标准电化学可逆电对Fe(CN)63-/Fe(CN)64-在不同浓度、不同扫描速度和不同支持电解质条件下的循环伏安曲线,熟悉各种因素对循环伏安曲线形状的影响
【实验原理】
1.电子转移机理
电子转移机制氧化还原反应为原子转移反应和电子转移反应两大类。以配合物反应为例:


 (1)[Co(NH3)5Cl]2+ + [Cr(H2O)6]2+ [(NH3)5CoCl: Cr(H2O)5 ]
(1)[Co(NH3)5Cl]2+ + [Cr(H2O)6]2+ [(NH3)5CoCl: Cr(H2O)5 ]

 [(NH3)5Co :Cl-Cr(H2O)5 ] [Co(H2O)6]2++ [Cr(H2O)5Cl]2+ + 5NH4+
[(NH3)5Co :Cl-Cr(H2O)5 ] [Co(H2O)6]2++ [Cr(H2O)5Cl]2+ + 5NH4+
 (2)[Fe(CN)6]4- + [IrCl6]2- [Fe(CN)6]3- + [IrCl6]3-
(2)[Fe(CN)6]4- + [IrCl6]2- [Fe(CN)6]3- + [IrCl6]3-
反应(1)是通过两种互相反应的配离子之间转移一个氯原子来实现的,属于原子转移反应。反应(2)是通过电子由一种配离子向另一种配离子转移实现的,属于电子转移反应。
根据反应机理的不同,电子转移反应还有外层机理和内层机理两类。像反应(2)所示的[Fe(CN)6]4-和[IrCl6]2-之间的反应。在反应过程中,电子由一种配离子向另一配离子转移,参与反应的两种配离子的中心离子在整个过程中除氧化态发生变化外,其配位层都保持不变。这类机理叫外层机理。若在反应过程中,一种配离子先释放一个配体,然后与另一种配离子的某种配体配位形成桥接双核中间体,电子再通过桥接配体进行转移。这样的机理叫内层机理。
外层机理通常在两种取代惰性的配离子之间发生,反应速度和配合物的电子结构及中心金属离子和配体之间的距离有关。对八面体配合物来说,从电子结构来看,要求在配合物的π* (t2g)轨道上有可以给出的电子或接受电子。从中心金属和配体之间的距离来看,则要求电子转移前后,它们之间的距离变化不大。
[Fe(CN)6]4-和 [Fe(CN)6]3-都是取代惰性的配合物,它们的电子构型分别为:
 [Fe(CN)6]4- [Fe(CN)6]3- + e-
[Fe(CN)6]4- [Fe(CN)6]3- + e-
π*(t2g)6 π*(t2g)5
且两者都是低自旋的配合物,在电子得失前后,中心铁离子和和CN-根之间的距离变化不大。当它们参与电子转移反应时,都能以极快的速度进行。Fe(CN)63-/Fe(CN)64-体系的电极反应应当是快速而可逆的。因而用循环伏安技术考察体系的伏安特性,能求出体系的标准还原电位Eθ和在电极反应中转移的电子数n。
2.循环伏安法
典型的CV图横轴为工作电极电位,纵轴为电流,也可认为横轴是时间轴。CV曲线中最重要的参数是:阴、阳极峰值电流ipc、ipa和阴、阳峰值电位Epc、Epa。由这些参数可以估计研究对象的电化学性质。对于可逆体系,电位由方程决定:
E = Eθ –  lg
lg 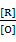
[R]、[O]分别代表还原态、氧化态的浓度。对于电极表面电子交换过程迅速进行的电化学可逆电对,具有如下关系:
Eθ= 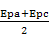
ΔEp = Epa– Epc ≈ 
由此可从CV曲线上的参数估算出标准电位Eθ和电子得失数n。对于电化学可逆电对,峰值电流的大小可用Randles-Sevcik方程描述:
ipc = ipa= (2.69 * 105)n3/2 AD1/2 v1/2 C
式中n为得失电子数,A为工作电极面积(cm2),D为扩散系数(cm2/s),为扫描速度(V/s),为溶液浓度(mol/L),i的单位为A。
【实验部分】
1. 试剂
铁氰化钾K3Fe(CN)6,硝酸钾KNO3,无水硫酸钠Na2SO4
2. 仪器
容量瓶23ml(5只),移液管5ml(2支)、10ml(2支),烧杯25ml(若干),CV三电极电解池,工作铂电极,Ag/AgCl参比电极,电位分析仪
3. 实验步骤
(1)支持电解质溶液和铁氰化钾的配制
甲液:

乙液:

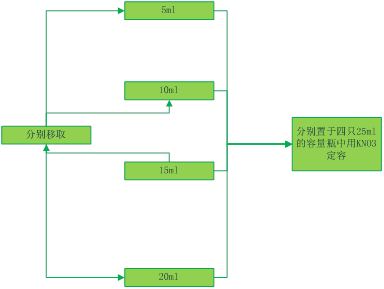
(2)循环伏安曲线的绘制
接好电极,设置好参数,进行Fe(CN)64-/Fe(CN)63-体系CV曲线绘制,从CV曲线求E0、ipa、ipc和n值
【实验结果】
1.0.002mol·L-1K3Fe(CN)6在1mol·L-1KNO3中的溶液

Epa=0.28V Epc=0.2V ipa=2.5e-5A ipc=-2.9e-5A
E0 =0.24V
=0.24V
n=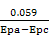 =0.74
=0.74
2.0.004mol·L-1K3Fe(CN)6在1mol·L-1KNO3中的溶液

Epc= 0.196V ipc = -5.616e-5A Epa= 0.281V ipa= 5.424e-5A
E0 =0.2385V
=0.2385V
n=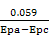 =0.694
=0.694
3.0.006mol·L-1K3Fe(CN)6在1mol·L-1KNO3中的溶液

Epc= 0.182V ipc= -7.842e-5A Epa= 0.290V ipa= 7.496e-5A
E0 =0.236V
=0.236V
n=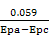 =0.546
=0.546
4.0.008mol·L-1K3Fe(CN)6在1mol·L-1KNO3中的溶液

E0 =0.236V
=0.236V
n=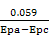 =0.431
=0.431
5.0.004mol·L-1 K3Fe(CN)6在1mol·L-1Na2SO4中的溶液

Epc=0.166V ipc=-3.727e-5A Epa=0.319V ipa=3.185e-5A
E0 =0.2425V
=0.2425V
n=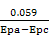 =0.3856
=0.3856
【结果与讨论】

由实验数据可得,当电解质为KNO3溶液时,在KNO3浓度相同的条件下,随K3Fe(CN)6浓度的增大,Epa、Epc基本无变化,ipa,ipc明显增大。对比实验(2)和(5)数据可以得出: 当反应物K3Fe(CN)6浓度相同时,同相浓度的电解质溶液:1mol/L KNO3溶液和1mol/L Na2SO4溶液,Na2SO4溶液使|ipa|减小,ipc减小。由于反应物质一定,氧化还原反应发生的电位一定,Eθ基本不变.由于反应方程为[Fe(CN)6]4- [Fe(CN)6]3- + e-,电子转移数为1,因此由实验数据可以看出,随着溶质浓度增大,实验精确度逐渐变差,而改用Na2SO4为电解液后实验的精确度明显不如KNO3为电解液。所以,溶质的浓度和电解液的种类均对循环伏安法有影响。
第二篇:同济大学研究生离校循环表
同济大学研究生离校循环表

