实验名称 电导的测定及其应用
一、实验目的
1.测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率;
2.用电导法测量醋酸在水溶液中的解离平衡常数;
3.掌握恒温水槽及电导率仪的使用方法。
二、实验原理
 1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1
1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1
2、电导率或比电导:κ=Gl/A (2.5.1)
其意义是电极面积为及1m2、电极间距为lm的立方体导体的电导,单位为S·m-1。
对电解质溶液而言,令l/A = Kcell,Kcell称为电导池常数。
所以 κ=G l/A =G Kcell
3、摩尔电导率:Λm=κ/ C (2.5.2)
强电解质稀溶液的摩尔电导率Λm与浓度有如下关系:
Λm= Λ∞m- A (2.5.3)
(2.5.3)
Λ∞m为无限稀释摩尔电导率。可见,以Λm对 作图得一直线,其截距即为Λ∞m。
作图得一直线,其截距即为Λ∞m。
弱电解质溶液中。在无限稀释的溶液中可认为弱电解质已全部电离。此时溶液的摩尔电导率为 Λ∞m =V+ Λm ,+ + V- Λm ,- (2.5.4)
根据电离学说,可以认为,弱电解质的电离度α等于在浓度时的摩尔电导Λ与溶液在无限稀释时的电导Λ∞m之比,即:α=Λm/Λ∞m (2.5.5)
4、弱电解质电离平衡常数:弱电解质AB型的电离平衡常数:Kθ=(Cα2)/Cθ(1-α) (2.5.6)
所以,通过实验测得α即可得Kθ值。
把(2.5.4)代入(2.5.6)式可得
Kθ=(CΛ∞m2)/ Λ∞mCθ(Λ∞m-Λm) (2.5.7)
或 CΛm=(Λ∞m2) KθCθ1/Λm -Λ∞mKθCθ
以CΛm对1/Λm作图,其直线的斜率为(Λ∞m2) KθCθ,如知道Λ∞m值,就可算出Kθ。
三、实验仪器、试剂
仪器:梅特勒326电导率仪1台;电导电极一只,量杯(50mL)2个;移液管(25mL)3只;
洗瓶一只;洗耳球一只。
药品:10.00(mol/m3)KCl溶液;0.093mol/dm3)HAc溶液;电导水。
四、实验步骤
1.打开电导率仪开关,预热5min。
2.KCl溶液电导率的测定:
(1)用移液管准确移入10.00(mol/m3)KCl溶液25.00mL,至于洁净、干燥的量杯中;测定
其电导率3次,取平均值。
(2)再用移液管准确移入25.00mL电导水,置于上述量杯中;搅拌均匀后,测定其电导率3
次,取平均值。
(3)再用移液管准确移出25.00mL上述量杯中的溶液,弃去;再用移液管准确移入25.00mL
电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)重复(3)的步骤。
(5)重复(3)的步骤。
(6)倾去电导池中的KCl溶液,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
3.HAc溶液和电导水的电导率的测定:
(1)用移液管准确移入0.093(mol/dm3)KCl溶液25.00mL,至于洁净、干燥的量杯中;测定
其电导率3次,取平均值。
(2)再用移液管准确移入25.00mL已恒温的电导水,置于上述量杯中;搅拌均匀后,测定其
电导率3次,取平均值。
(3)再用移液管准确移出25.00mL上述量杯中的溶液,弃去;再用移液管准确移入25.00mL
电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)再用移液管准确移出25.00mL上述量杯中的溶液,弃去;再用移液管准确移入25.00mL
电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(5)倾去电导池中的HAc溶液,用电导水洗净量杯和电极;然后注入电导水,测定其电导率
3次,取平均值。
(6)倾去电导池中的电导水,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
五、数据记录与处理
1.数据记录
大气压:101.10KPa 室温:25.2℃ 实验温度:25.2℃
已知数据:25℃下10.00(mol/m3)KCl溶液电导率=0.1413S·m-1;25℃时无限稀释的HAc水溶液的摩尔电导率=3.907×10-2(S·m2·mol-1)。
(1)测定KCl溶液的电导率:
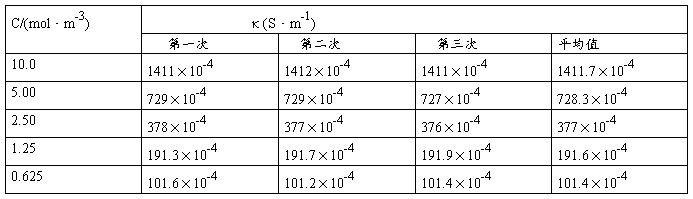
(2)测定HAc水溶液的电导率:
电导水的电导率κ=(H2O)/(S·m-1)=8.90×10-4

2.数据处理
(1)KCl溶液的各组数据
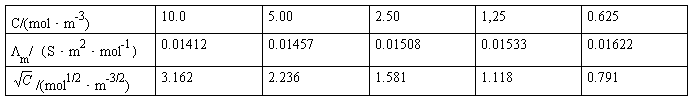
以KCl溶液的Λm对 作图得一直线,其截距即为KCl的Λ∞m。
作图得一直线,其截距即为KCl的Λ∞m。
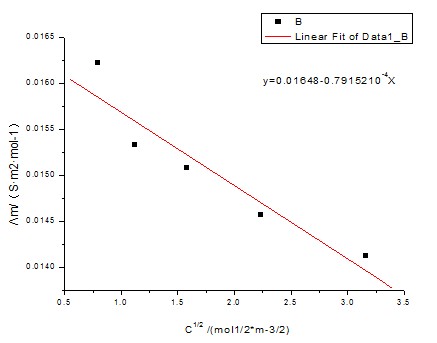
由图可知斜率为-7.98152×10-4,截距为0.01648
由Λm= Λ∞m- A 得出Λ∞m= 0.01648S·m2·mol-1
得出Λ∞m= 0.01648S·m2·mol-1
(2)HAc溶液的各组数据
HAc原始浓度:0.093mol/L
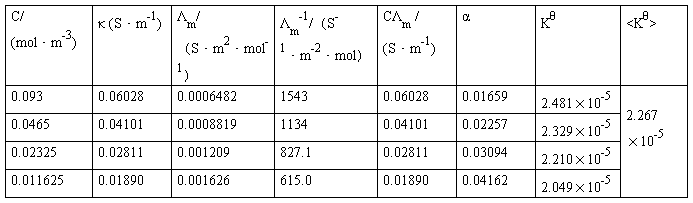
κ = κ′-κH2O
以CΛm对1/Λm作图,其直线的斜率为(Λ∞m2) KθCθ,如知道Λ∞m值,就可算出Kθ,并与上述结果进行比较。
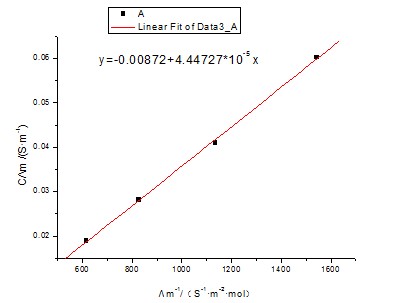
由图可知此直线的斜率为4.44727×10-5,所以(Λ∞m)2 KθCθ=4.44727×10-5,
又因为Λ∞m=3.907×10-2(S·m2·mol-1),Cθ=1mol/L;
所以Kθ=4.1963×10-5/((3.907×10-2)2×1×1000)=2.749×10-5
实验计算所得结果相对图得到的结果的相对误差=(2.749×10-5-2.267×10-5)×100%=17.5%
六、结果与讨论
误差分析:
1、 移液管使用时存在误差,使得溶液浓度非理想浓度;
2、 更换待测液时,电导率仪的电极与未洗干净或未擦干,导致误差;
3、 电导水的电导率的测定误差;
4、 移液管操作时没有进行搅拌。
有关已知数据:25℃下0.01000mol/L KCl溶液电导率К =0.1413 S·m-1 无限稀的HAc水溶液的摩尔电导率(25℃)∧∞m=3.907×10-2S·m2·mol-1
第二篇:实验报告 电导法测定乙酸乙酯皂化反应的速率常数
电导法测定乙酸乙酯皂化反应的速率常数实验目的1.掌握电导法测定反应速率常数的原理和方法2.了解二级反应的特点,学会用图解计算法求取二级反应的速率常数3.用电导法测定乙酸乙酯皂化反应的速率常数,了解反应活化能的测定方法实验原理乙酸乙酯皂化是一个二级反应,其反应式为:反应速率方程为:在反应过程中,各物质的浓度随时间而变。测定该反应体系组分浓度的方法很多,例如,可用标准酸滴定测出不同时刻OH-离子的浓度。本实验使用电导率仪测量皂化反应进程中体系电导值G随时间的变化,可以监测反应的进程,进而可求算反应的速率常数。二级反应的速率与反应物的浓度有关。若反应物和的初始浓度相同(均设为c),设反应时间为t时,反应所产生的和的浓度为x,若逆反应可忽略,则反应物和产物的浓度时间的关系为:t=0: c c o ot=t: c-x c-x x x上述二级反应的速率方程可表示为:..........(1)作积分得:或 .........(2)显然,只要测出反应进程中任意时刻t时的x值,再将已知浓度c代入上式,即可得到反应的速率常数k值.因反应物是稀水溶液,故可假定全部电离.则溶液中参与导电的离子有Na+、OH-和等,Na+在反应前后浓度不变,OH-的迁移率比的大得多.随着反应时间的增加,OH-不断减少,而不断增加,所以体系的电导值不断下降.在一定范围内,可以认为体系电导值的减少量与的浓度x的增加量成正比,即:…….(3)…….(4)式中, 和分别是溶液起始和t时的电导值, G∞为反应终了时的电导值,β是比例系数.将(3)、(4)代入(2)得:.........( 5)或写从直线方程式可知,只要测出G0、G∞和一组值,据(11.5)式,由对t作图,应得一直线,从其斜率即可求得速率常数k值.实验仪器与试剂DDS-307型数字电导率仪 1台 双管电导池 1个移液管(10 mL) 2支 DJS-1型铂黑电极 1支洗耳球 1只 (0.0100、0.0200 mol/L) 一瓶CH3COONa(0.0100 mol/L) 一瓶 CH3COOC2H5(0.0200 mol/L) 一瓶实验步骤本实验用烧杯作电导池,如下:1. G0的测定(1)洗净烧杯并烘干,倒入适量0.0100 mol/L溶液(以能浸没铂黑电极并高出1cm为宜)。(2)用电导水洗涤铂黑电极,再用0.0100 mol/L 溶液淋洗,然后置入烧杯中。(3)测量溶液的电导(率)值,每隔2 min测量一次,共3次。2.G∞的测定 实验测定过程不可能进行到t=∞,且反应也并不完全可逆,故通常以0.0100 mol/L 的溶液的电导(率)值作为G∞,测量方法与G0的测量方法相同。
但必须注意,每次更换测量溶液时,须用电导水淋洗电极和烧杯,再用被测溶液淋洗三次。3.Gt的测定(1)电导池和电极的处理方法与上述相同,装后置烧杯中.(2)用移液管量准确取10 mL 0.0200 mol/L 溶液放入洗净并干燥的烧杯, 用另一支移液管吸取10 mL 0.0200 mol/L 溶液注入烧杯中。(3)将CH3COOC2H5溶液快速倒入烧杯中,溶液倒入一半时,开始记时,并继续倒完,使溶液混合均匀,并立即测量溶液的电导(率)值.注意不要使溶液逸出!(4)每隔2 min测量一次,直至电导(率)值基本不变为止。除记录第一个数据的外,其它各数据在测量时,应该尽量保持在整数分钟时测定,以便于进行数据处理。整个反应约需时45 min~1 h。(5)反应结束后,倒掉反应液,洗净烧杯和电导电极.实验数据记录及处理表一:t/min246/ 1948194619411945表二:t/min2461312131713181315.67表三:t/min246810121416177917401697165816321583155115210.35830.48310.65040.83840.98951.35411.67422.0697t/min1820222xxxxxxxxxxxx14851455144614301418139913822.43282.71663.51683.82814.50455.15006.55238.4879根据测试结果,以对t作图:直线的斜率0.1756,则k=17.56所以反应速率常数实验小结1 .本实验要在恒温条件下进行,且和溶液在混合前还要预先恒温是因为温度对反应速率常数K影响很大,故反应过程应在恒温条件下进行,本实验是在室温下下进行。2.反应分子数与反应级数是两个完全不同的概念,反应级数只能通过实验来确定。试问如何从实验结果来验证乙酸乙酯皂化反应为二级反应?答:利用不同浓度下的乙酸乙酯和氢氧化钠,来测定相同反应条件下的不同浓度的反应物的反应速率。3.乙酸乙酯的皂化反应为吸热反应,试问在实验过程中如何处置这一影响而是使实验得到较好的结果?答:采用稀溶液控制反应速率,并适当搅拌。4.如果和溶液均为浓溶液,试问能否用此方法求得K值?为什么?答:不能。因为影响因素太多,实验结果更差。5.为什么两溶液混合一半是就开始计时?答:因为溶液要尽快混合,而且反应速率较快,电导率也下降较快,所以加入一半时,就开始计时。
