
物理化学实验报告
实验名称: 电解质溶液活度系数的测定
学 号:
班 级: 有色冶金
姓 名:
实验日期: 20##-3-13
一、实验目的
测定不同浓度盐酸溶液中的平均离子活度系数,并计算盐酸溶液中的活度。
二、实验原理
将理想液体混合物中一组分B的化学势表示式中的摩尔分数 代之以活度,即可表示真实液体混合物中组分B的化学势。

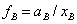
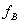 为真实液体混合物中组分B的活度因子。真实溶液中溶质B,在温度T、压力P下,溶质B的活度系数为:
为真实液体混合物中组分B的活度因子。真实溶液中溶质B,在温度T、压力P下,溶质B的活度系数为: 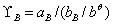
其中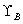 为活度因子(或称活度系数)。
为活度因子(或称活度系数)。
电池:Ag,AgCl|HCL|玻璃|试液||KCL(饱和)| 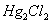
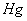
 (液接电势)
(液接电势)


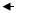 玻璃电极 | | 甘汞电极
玻璃电极 | | 甘汞电极
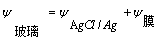
上述电池的电动势: 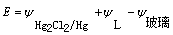 (1)
(1)
其中: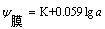 (K是玻璃膜电极外、内膜表面性质决定的常数)
(K是玻璃膜电极外、内膜表面性质决定的常数)
当实验温度为25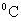 时
时 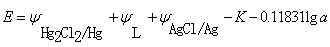
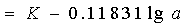
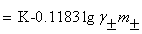 (2)
(2)
上式可改写为: 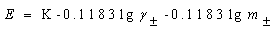
即
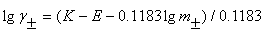 (1)
(1)
根据得拜——休克尔极限公式,对1——1价型电解质的稀溶液来说,活度系数有下述关系式
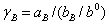
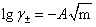
所以 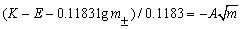
或 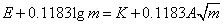
或将不同浓度的HCl溶液构成单液电池,并分别测出其相应的电动势E值,以0.11831gm为纵坐标,以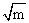 为横坐标作图,可得一曲线,将此曲线外推,即可求得K。求的K后,再将各不同浓度m时所测得的相应E值代入(2)式,就可以算出各种不同浓度下的平均例子活度系数γ±,同时根据
为横坐标作图,可得一曲线,将此曲线外推,即可求得K。求的K后,再将各不同浓度m时所测得的相应E值代入(2)式,就可以算出各种不同浓度下的平均例子活度系数γ±,同时根据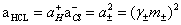 之关系,算出各溶液中HCl相应的活度。
之关系,算出各溶液中HCl相应的活度。
三、仪器药品
仪器: 离子活度计、干电池、移液管若干支;
药品: 0.1mol/L盐酸溶液。
四、试验步骤
1、溶液配制
分别配置0.005mol/L、0.01mol/L、0.02mol/L、0.05 mol/L及0.1 mol/L溶液50mL
2、不同浓度的盐酸溶液的电动势测定
测定不同浓度HCl溶液的E。
五、数据记录
1、配置不同浓度的盐酸溶液所需0.1 mol/L HCl溶液如下:
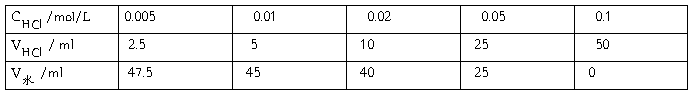
2、不同浓度的50mL盐酸溶液的电动势的测定

六、数据处理
1、根据E值和质量摩尔浓度m及其他值绘制曲线求K'值。
对于一般稀溶液来说,其密度近似等于水的密度,可以近似认为
C(mol/L)=m(mol/kg),这种近似常用于计算中。
由m = CHCl /ρ水,其中 ρ水 = 1.0 Kg/m3 。可计算出 E+0.1183lgm和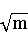 。数据如下表:
。数据如下表:
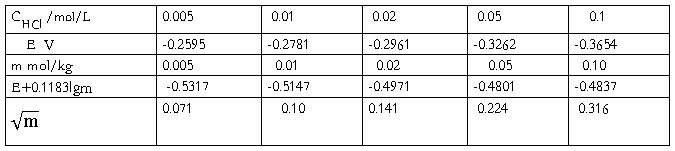
将不同浓度的HCl溶液分别测出其相应的电动势E值,以
E +0.11831gm为纵坐标,以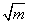 为横坐标作图,将此曲线外推,求K'。
为横坐标作图,将此曲线外推,求K'。
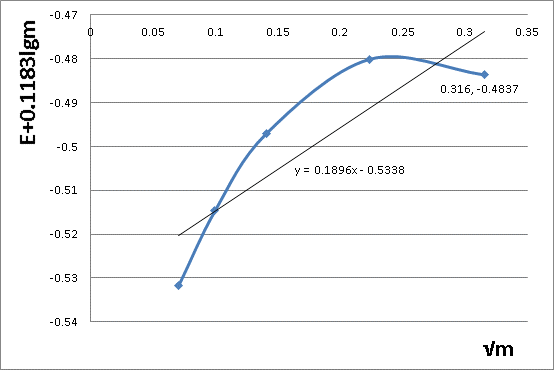
有图可求出K'= -0.5338
2、计算出各种不同浓度下的平均离子活度系数 。
。
将各不同浓度的m时所测得的相应E值代入
lg =1/0.1183 (k'- E – 0.1183lgm)
=1/0.1183 (k'- E – 0.1183lgm)
可计算出各种不同浓度下的平均离子活度系数 。
。
lg 1 =1/0.1183 (k'- E1 – 0.1183lgm)
1 =1/0.1183 (k'- E1 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.2595 – 0.1183lg0.005}
= -0.0177
 1 =0.9600
1 =0.9600
lg 2 =1/0.1183 (k'- E2 – 0.1183lgm)
2 =1/0.1183 (k'- E2 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.2781 – 0.1183lg0.01}
=-0.1614
 2 =0.6896
2 =0.6896
lg 3 =1/0.1183 (k'- E3 – 0.1183lgm)
3 =1/0.1183 (k'- E3 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.2961 – 0.1183lg0.02}
=-0.3103
 3 =0.4894
3 =0.4894
lg 4 =1/0.1183 (k'- E4 – 0.1183lgm)
4 =1/0.1183 (k'- E4 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.3262 – 0.1183lg0.05}
=-0.5438
 4 = 0.2829
4 = 0.2829
lg 5 =1/0.1183(k'- E5 – 0.1183lgm)
5 =1/0.1183(k'- E5 – 0.1183lgm)
=1/0.1183{-0.5338 + 0.3654 – 0.1183lg0.1}
=-0.4235
 5 = 0.3771
5 = 0.3771
3、根据公式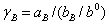 及
及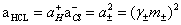 之关系,算出各溶液中HCl相应的活度。
之关系,算出各溶液中HCl相应的活度。
由公式可计算出 B
B
 B1 = (
B1 = ( 1m1)2 = (0.9600 * 0.005)2 = 2.304 * 10-5
1m1)2 = (0.9600 * 0.005)2 = 2.304 * 10-5
 B 2 = (
B 2 = ( 2m2)2 = (0.6896 * 0.01)2 = 7.562 * 10-5
2m2)2 = (0.6896 * 0.01)2 = 7.562 * 10-5
 B3 = (
B3 = ( 3m3)2 = (0.4894 * 0.02)2 = 9.580 * 10-5
3m3)2 = (0.4894 * 0.02)2 = 9.580 * 10-5
 B4 = (
B4 = ( 4m4)2 = (0.2829 * 0.05)2 = 2.000 * 10-4
4m4)2 = (0.2829 * 0.05)2 = 2.000 * 10-4
 B5 = (
B5 = ( 5m5)2 = (0.3771 * 0.1)2 = 2.304 * 10-4
5m5)2 = (0.3771 * 0.1)2 = 2.304 * 10-4
七、思考讨论
1、试述电动势法测定平均离子活度系数的基本原理。
答:平均离子活度系数  ±的测定,测定 ±的方法有溶解度法、依数性法及电动势法。其中以电动势法最简便。用电动势法测电解质离子的
±的测定,测定 ±的方法有溶解度法、依数性法及电动势法。其中以电动势法最简便。用电动势法测电解质离子的 ±时,常利用该电解质溶液设计出一个原电池。设计此原电池的条件是:它的电池反应中只含该电解质溶液而无其它溶液。如测定HCl水溶液HCl的
±时,常利用该电解质溶液设计出一个原电池。设计此原电池的条件是:它的电池反应中只含该电解质溶液而无其它溶液。如测定HCl水溶液HCl的  ±,可设计的原电池同前,由前式可得:ln =F/2RT( Emf - + )由此式可见,该电池的Nernst公式中只含HCl的活度而无其它电解度溶液的活度。
±,可设计的原电池同前,由前式可得:ln =F/2RT( Emf - + )由此式可见,该电池的Nernst公式中只含HCl的活度而无其它电解度溶液的活度。
2、当实验温度接近25℃时,为何可用外推法来确定标准电动势?
答:因为在25℃时电动势E与K'成线性关系,所以可以用外推法来确定标准电动势
第二篇:用微扰理论状态方程计算电解质水溶液的活度系数
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!""#
""""""#
""#
第!"卷第#期
"))*年#月
+%,-./&%0
化工学123456/&7.8,9:-;/.8报
<.=5.33-5.=(125./)$%&’!"(#>?-5&"))*
研究简报
用微扰理论状态方程计算电解质水溶液的活度系数
李春喜
(北京化工大学化学工程学院,北京*)))"@)
""""""#
关键词中图分类号
宋红燕
(北京化工大学应用化学系,北京*)))"@)
李以圭陆九芳
(清华大学化学工程系,北京*)))A#)
微扰理论
势能函数
电解质溶液
状态方程
>
活度系数
文章编号
)#DAE**!F("))*))#E)DGDE)!
BC)*D’*文献标识码
引言
[*]
近年来,电解质溶液理论的研究日益活跃’
见文献[F]’
采用带电硬球和中性硬球混合物作为新的参考流体,势能函数对体系自由能&的三阶微扰项可
[F]
分别表示为
&*$"
"
因为理论模型能反映微观粒子参数与溶液结构和性质间的关系,参数物理意义明确,预测功能强’电解质溶液的原始模型中,忽略了离子E溶剂和溶剂E溶剂相互作用,而只考虑在溶剂平均场中离子之间的相互作用’这类模型不能反映溶液的本质和溶质E溶剂间的真实相互作用,因此很难推广到混合溶剂电解质溶液’用微扰理论研究电解质溶液的状态
["][D]
方程已经取得很大进展和离子’硬球离子流体[#]
模型流体的微扰理论处理结果已经被成功E偶极
[!]
地用于构筑实际电解质溶液的状态方程’作者采[G]用微扰理论研究了电解质溶液的密度性质,本文
(((8#*8#"!"!"#)!"*")$$’!’%
!
"
(")
*
"
&"$)$$’!’"
!"&D
D"
!
"
*8#8#!(*")%((*")
?$$$$’’’
&((*"D)G
!"
"
!"
!"*
!"*
"
%…(D)
(((*D)8#*8#"8#D%…!!!!"*")!""D)*!
&$&#%&*%&"%&D%…
(#)
体系的&为参考项&#和各阶微扰项&!之和,即
(!)
!"#
参考流体性质
参考流体自由能&#由硬球项和静电项组成,
将进一步研究活度系数的计算问题’
(K%,O&5PE即&#I&29J&66,二者分别由KL1MN
和平均球近似L/.9%%-5E1/-./2/.EM:/-&5.=EN3&/.8)
[F]
(LM>)方程来计算,即
*
!"!
理论部分
基本原理
假定电解质在溶液中完全电离,离子和水分子
29
$+*,
(
D
D-*-"-D)-")
""%)!-D!-D(-D!
)(
-D"
(G))*&.%-"D
)
均可作为球形粒子处理,而且粒子间作用的势能函数为
29
((#)%!66(#)%!859(#)%!88(#)%!!"#)$!!"!"!"!"
68
(#)%!858%!658!!"!"(#)!"(#)
""D
66"23!0!%%$)+*,/9*,&$*%&1!"%D"!
[]
(F)
(*)
式(*)右边依次表示粒子间硬球、离子E离子、色散、偶极E偶极、离子E偶极、偶极E诱导偶极和离子E诱导偶极作用能,这些势能函数的表达式参
")))E)#E)D收到初稿,")))E)GE*@收到修改稿’联系人及第一作者:李春喜,男,DG岁,博士,副教授’基金项目:国家自然科学重点基金(H%’"@FDG*F))和国家教委留学回国人员科研基金资助项目’
-4I$’!14-DRG;%I!,4I*QD;$I""!
[G],*E$’中间变量23、’和&的公式参见文献
它们可由离子的浓度和特征性质计算出来’!"$自由能微扰项其中
!"$"!色散作用项色散作用是粒子之间普遍存
[A]
在的一种吸引作用,1%::3-4/.等采用二阶微扰理论导出了与分子模拟结果符合良好的&859方程,即
&859*859859
&*5,’]$’%"&"
+*,,&859*
$+*,
#
(A)(@)
’("5
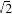
$6*,4
4$*
4
*$*或"
?:98?
化工学报-//.年3月
#!方程的系数!","$%&,#参见原始文献!式中!"!
$!""$%#$%&,混合粒子的色散能参数"$%&和#$%&分
#
别采用’()混合规则计算,即"#"’&’,$%&"""(&(
&
’
!-!-!!0(%(%/"$*.3!!/%$/23%!.
#!-!3!-()%))(--%!!!%A)/$%&!/%$/2./
%79
(.1)
C%(
%/"$*.
!!-!!/$/2-
!!!
!&3&()$%&%)&)%!."
&%79
--
#
#$%&*"$%&
"
#
""(&(#"&’,组合规则为#&’’&’
&
’
"
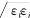
,
!!-(!%-)2)/!/$/2(
"&’"("&+"’),-!"$%&与)$%&的关系为
)$%&!*
.+/,##.2$!+/,//./311$!-"$%&
(./)
!!3%)$%&)"!&3&)$%&%)&
&
#
(.B)
#!"对比极化率$/$/,)/!
[A]
离子的色散能参数采用45’678599%:;<=>?@>9公式估算,即
因此各种微扰势能函数对体系0的贡献与#&’
的表达式(.)类似,可写为
0*0@:+0CC+0(%:+0((+0C(+0(%(+0C%((.0)
#&%"*-,-1B0-
!"#"$偶极作用项
((作用和离子与溶剂之间的C(作用!由于在一阶
((
微扰项中#((#&’的方位角平均值均为零,因此它&’和们只存在二阶和三阶微扰项,其表达式分别为
((
0-%
偶极作用包括溶剂分子之间
.,
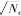
A
./...$&%"2&
(..)
!"%离子平均活度系数
根据0的表达式和经典热力学关系6"
()(0%/"$)和&可导&"!%"&",,!$7!!’$&
[][]
出压缩因子和组分的化学势方程,二者可分别用于
[3]
/"$*.-1123%B!!
-!
(.-)(.#)
-
!和’的计算!取无限稀释为参考态,则以摩尔分
数为浓度标度的活度系数’&(为
[%>&((&).%>&((&%/)]E9’&(*&&&
(-/)
((!0#%/"$*-11#2(((%.2!!
%79
C(
0-%/"$*
!!-.(-!!/%%#)
(&2-)&%)$%&)(.3)"(&3!
&*.
离子的平均活度系数与单个离子活度系数的关系为
("(+(;!一般实验’’;(’值都采用质量摩尔浓F(’+(
度标度,二者关系为’F#"’F((%.+/,/.B#[0]"(&)!
-!-!3C(
0#%/"$*(.2!!/%%.B?)
%79
)&%)$%&&(#2C((..,-.AA2-)"(&3!
&*.
-
(.A)
-!式中1*(3!#/)&&,!&%0&*.%"$,!*"&(%#
)#$%&*!)$%&,
-$"!
结果与讨论
粒子参数
(&(’)&’,)&’""&’
#
!%-,*()&+)’)%*
-(4为正整3!*&3-&&%)&,积分函数24%
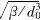
数)、2(((以及2C((都只是!!的普适函数,具体函数关系及方程系数参见文献[2]!需要说明的是在
水分子的偶极矩(%)和极化率(分别采用文$/)
献值[2]?2!.1.*./;#/G$,.!A0*./;#/$#,色散能汽压得到:"/"#!..A*./;./$,#%""--.!0H!根据离子$&、D5IE%9J直径"&的文献值[./]和方程(..)可以求出离子的色散能参数,如表.所示!$"$
溶液介电常数
在微扰理论中,体系的自由能是通过独立地考虑粒子间各种势能函数的相互作用得到的!事实上,当粒子间存在不同的作用力时,各种势能函数以及相应的自由能项是相互耦合的,而这种耦合作用在三阶微扰理论中考虑得还很不充分!很多研究参数可通过本文的状态方程回归水的!和饱和蒸
0((和0C(的计算中均采用了D5(>近似加速微扰项
的收敛,即
0*0-(%..0#%0-)
(.2)
!"#"#诱导作用项诱导作用包括分子之间(%(
作用和离子;溶剂之间的C%(作用!由于诱导项的作用比较小,因此微扰处理只作到二阶项!将势能
C%(
函数#(%(&’(5)和#&’(5)经方位角平均后代入方程(-)、(#)即可分别得到这两种诱导作用的自由能
表达式
&’()*!
K79:L5+H+4J<6
-+
#/#
$&*./,$
+,-./0’1’2*3*145,16,)’1.7’(.).38,6’9).-:;.’2*3*1’-;;.40*14.,-*-*1:8
&&&&&&&&&&
./
"&*./,$
/!-.//!B1//!.-/!A#./!B3#
.!0/-!22.!A2-!.--!32
,H.31!3--.!A2-/!22-/!0103!#
K79:M9-+GE;N6
;
#/#
$&*./,$./
"&*./,$
/!..-#!/-3!.12!-B
.!0/#!2-#!0/3!#-
,H3#/!.--A!A##/!03/A!A
G5-+
-+
K;


第P3卷第O期李春喜等:用微扰理论状态方程计算电解质水溶液的活度系数
?10/?
(可见,介电常数对离子化学势的影响很大$%H)
由图(可见,若取真空介电常数,离子的化%*)学势是一个特别大的负值,因此在极稀的浓度范围内,离子的$值迅速衰减为零,其他参数的任意调整都无济于事$由图(可见,当取纯水(曲线F,%H)或电解质溶液(曲线%,3)的介电常数时,离子化O)
学势的计算值比较合理,但两种取法给出的化学位随离子浓度变化的规律不同$介电常数取纯水和取
+
(3%)
3
真空值时,离子化学势随浓度的变化趋势相同,但前者似乎夸大了介质水对离子间库仑作用的屏蔽效?L#D%以后,化应,因此电解质溶液的浓度在3<’,
学势随浓度的变化很小$当取电解质溶液的介电常数时,离子的化学势随电解质浓度的增加几乎呈线性降低$!"$
离子活度系数的计算
理论上,离子的硬球直径应该与水化作用无关,但因对于强烈的水化作用目前还没有比较好的统计力学处理方法,因此需要靠调节分子参数来弥补因忽略水化作用带来的误差$考虑到阴离子水化作用较弱,因此其硬球直径可以用S*.,"2#直径近似,但对于高价体积小的阳离子,其水化作用比较强,因此本文将阳离子硬球直径表示成离子强度的
!3?O!
!
!
,-,"#!
,%%
)J%(J.FFFF’J.F433#(J.OOP%#
!3
’
(33)
!F!O!PJ.OJF%#(J.3O4%#’J.JN%PP#
$J,&M分别为纯水的介电常数和折光指数,
对3PQ的水其值分别为N5$F和%$FO$在用上式计算$0时,水的“有效偶极矩”取N$4JKR%JDFJ
[%O]?+<$
!"#介电常数对离子化学势的影响
式中
图%(*)表示了采用真空介电常数,3456的
(%)和氯离子(3)化学势随离子)*+,水溶液中钠离子
浓度的变化关系$图(是3456时JEK<’,?L#D%%H)(%,F)和氯离子(3,O)的化学)*+,水溶液中钠离子
势与离子浓度和介电常数的关系$比较图%(*)和图
?<;;?
!"#$%&
!"#$%&"’-./#)/567)-.67)!767);’67)/5<)-.<)!7<);’<)=5/#>/#
化工学报)++(年:月
’"$()$"*+,-.%/)$*/,0+,-+(1%"-"(*+2+*3(,%00+(+%-*/"-41,4%$5"."1%*%./0,.6"$+4%"7)%,)//,$)*+,-"*&89:
!(+0,1(1+0,8,9+0,11(+0,8::+0,:((+0,821+0,4,(+0,441+0,1)9+0)):,+0)4::
!)*(+,)(0,23(,0))40+(,3(:04:3890443(0,+13,+0:23(:0)83()0):3901+93(0(9:
!,*(+,3()01(,041::08)1)08(9()0,,+0:,81408,,3(088))0,)83(90(93)80)8
"#*(+))0,)0:)01+02,0(+04+09+01,0(+02+01
$$#(04(01)04+04)04+0:+02+02)04+04+02
函数,所采用的函数形式为
%?&!(’!,())(+*1((’!)
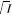
():)
——积分函数.’,.NNN,.?NN—
——离子强度,B"#?(—C.3(F)O——6"#%IB5’’常数,J?/—>3(
——质量摩尔浓度,B"#?0—C.3(F)O——粒子数1—
——离子的电子数目1G—
——水的折光指数2P—
——离子的电量,/3—
——粒子间距离,B-—
——气体常数,J??4—B"#>3(——标准方差"#—
——绝对温度,>5—
——组分7的摩尔分数67—
——压缩因子8—
——离子7价态97—
——极化率,B,"—
——量纲(化学势#$7—
——离子7活度系数!7—
——离子平均活度系数!D—
——粒子间作用势能函数%7:—
——真空介电常数(%+—!+M9094:*(+
?=3(B3)
?/3(———色散能参数,>%
——偶极矩,/?B$—
——粒子数密度,B3,&———粒子的QJ直径,B’—
——离子7的计算系数(7—
上角标
——对比量"———离子?———偶极N—
——色散项N&L—
——过量性质GR—
——硬球项HL—
3()
采用这种方法本文计算了几种)@(型和(@(型卤化物(>/#和=5/#至饱和溶解度)在)19>、(为+
?C.3(的!D0离子参数和计算结果如表)所A1B"#
示,几种)@(型卤化物水溶液在)19>时!D的计算结果如图)所示0
结果表明,用这种方法计算离子的!精度较高,且浓度适用范围可达到中等浓度电解质水溶液0
,结论
(()应用平均球近似处理离子间静电作用,用微扰理论处理离子和溶剂分子间的其他相互作用,建立了电解质溶液的状态方程0
())以=5/#分子为例,考察了阴阳离子化学位随电解质浓度和介电常数的变化规律,发现在电解质溶液的微扰理论模型中,取电解质溶液的介电常数值比较合理0
(,)采用阴离子E5$#&’.直径近似离子的硬球直径,将阳离子硬球直径表达为离子强度的函数,并取电解质溶液的介电常数计算离子间的静电作用能,该方程可用于中等浓度的电解质溶液活度系数的计算,而且具有比较好的精确度0
符
号
说
明
),/)?
——FG#BH"#%I自由能,J$—
——平均相对偏差,$$#—K——电解质溶液的介电常数#L—
——硬球直径,B%—
——质子电量(+M(08+)(1*(+3(1),/+—
———径向分布函数,(-)
第6&卷第@期
——诱导项!"#—
下角标
——水$—
李春喜等:用微扰理论状态方程计算电解质水溶液的活度系数
(’):&63—&::%33:,(-4
?IHG?
(吴建中),*0.!0HB"8(陆九芳),*!7!80!(李以圭)I0.!B"J-+"82(&’!19)(化工学报),)-8,196-:&’/2!;96%1<803,491<(1.!1//,!1.(&):%:5—%46%33@,(.
——分别为一阶,二阶和三阶微扰项%,&,’—
——组分!,"———混合(!)—
——摩尔分数#—
53%$%%%&%’%@
9+KK,<(B"L*,DM-NB<J>.,O<B0="!KJ.12$%&’()2,%35:,,)(%%):%454—%435
;0B"8P!Q!"8(黄子卿)2R"K<+#0MK!+"+HS?,MK<+?EK,D+?0K!+"A-,+<E(电解质溶液理论导论)2>,!T!"8:DM!,"M,O<,==,%35’
(徐英年),;07!"8(胡英)U07!"8"!B"2)-8,196-:&’/2!;96%1<80=(&’!19)(化工学报),%354,()):%@:—%663,491<(1.!1//,!1.
*!07,;B<V,EC;,O<B0="!KJ.12&’/2*(1.*&-222,%353,--:@’—::
D!(+"W,>,<"B<#X,>?0(*2)*+’4*&’/2*,%333,/+,::33—4$@
(&):%66&—S88,Y<,M-K.,XJ?,<O2)*&’/2*+’402,%33’,0*%6:6
*!9U,*!7G,*0.Z,7B"8*72>68!<+’90/(?8!6!@,!9,%33:,/)(:33—%%$
!"#"$"%&"’
%&’@6:
(%):%5$—%36*+,-,.*,/+"+-0,1/2$%&’()*,%334,()
(李以圭),*!9-0")!(李春喜)(化*!7!80!2+,-.,/00!1&’/2!03,4学进展),%33:,(:%66—%:%*&)
(:):%6$3—%6%%;,"#,<=+"/,>?0(*25-6*+’40*,%35$,(+
;,"#,<=+"/,>?0(*,AB"!C2C9DDE(F+=!0(,%35:,,++:&5%—&3:.!"G,/+"+-0,1/2%(&7/02,%355,)-:%$4’—%$5@;%4’4—%4@’
(李春喜),*!7!80!(李以圭),*0.!0HB"8(陆九芳)*!9-0")!2(&’!19)(化工学报),)-8,196-:&’/2!;96%1<803,491<(1.!1//,!1.
123143256782156965:1;<==616<75>
;=<3<15!;3:5<2?4<;4>>;3456;7@65A
B<!54!C256;75A<;!:DC2><E<?4256;7;=>525<
361FG%HI/J%K>;78AL%MNJ%)
&
(%&-66/./-:&’/2!;96(1.!1//,!1.,A/B9,32/13-:$BB6!/<&’/2!03,4,
36:IMGIJ%K34OIG#J%M
(A/B9,32/13-:&’/2!;96(1.!1//,!1.,F0!1.’89D1!E/,0!34,C/!"!1.%$$$5@,&’!19)
C/!"!1.D1!E/,0!34-:&’/2!;96F/;’1-6-.4,C/!"!1.%$$$&3,&’!19)
2P’Q$J&QC",[0BK!+"+H=KBK,H+<,?,MK<+?EK,B[0,+0==+?0K!+"!=#,V,?+F,#YEK<,BK!"8K-,!+"\!+",?,MK<+=KBK!MB"#!+"\=+?V,"K(+?,M0?,!"K,<BMK!+"=N!K-F<!(!K!V,1DCB"#F,<K0<YBK!+"K-,+<E,<,=F,MK!V,?E2A-,,HH,MK+HK-,#!,?,MK<!MM+"=KB"K+"K-,!+"!MM-,(!MB?F+K,"K!B?B"#K-,MB?M0?BK!+"BMM0<BME+H!+"!M(,B"BMK!V!KEM+,HH!M!,"K=H+<&]%B"#%]%KEF,-B?!#,B[0,+0==+?0K!+"B<,#!=M0==,#2>EKB^!"8!+"!MOB0?!"8#!B(,K,<B=!+"!M-B<#=F-,<,#!B(,K,<H+<B"!+"=B"#K<,BK!"8K-,MBK!+"-B<#=F-,<,#!B(,K,<B=!+"!M=K<,"8K-#,F,"#,"K,K-,,[0BK!+"MB"Y,0=,#K+MB?M0?BK,!+"!MBMK!V!KEM+,HH!M!,"K=!"K-,(+#,<BK,M+"M,"K<BK!+"<B"8,N!K-8++#BMM0<BME2R"NSL$K’
F,<K0<YBK!+"K-,+<E,FB!<F+K,"K!B?,,?,MK<+?EK,=+?0K!+",,[0BK!+"+H=KBK,,BMK!V!KEM+,HH!M!,"K
!"&"IT"KKJQ":&$$$\$@\$’21L$$"’UL%KI%MJGQFL$:*R9-0")!2
=LG%KJQIL%IQ"V:=0FF+<K,#YEK-,WBK!+"B?WBK0<B?DM!,"M,Z+0"#BK!+"+H9-!"B(W+2&34’:%4$)2



用微扰理论状态方程计算电解质水溶液的活度系数
作者:
作者单位:
刊名:
英文刊名:
年,卷(期):
被引用次数:李春喜, 宋红燕, 李以圭, 陆九芳, Li Chunxi, SONG Hongyan, Li Yigui, LuJiufang李春喜,Li Chunxi(北京化工大学化学工程学院,), 宋红燕,SONG Hongyan(北京化工大学应用化学系,), 李以圭,陆九芳,Li Yigui,Lu Jiufang(清华大学化学工程系,)化工学报JOURNAL OF CHEMICAL INDUSTRY AND ENGINEERING2001,52(4)7次
参考文献(14条)
1.Loehe J L.Donohue M D 查看详情 1997(01)
2.李以圭.李春喜 查看详情[期刊论文]-化学进展 1996(02)
3.Henderson D.Blum L 查看详情 1980(06)
4.Henderson D.Blum L.Tani A 查看详情 1986
5.Jin G.Donohue M D 查看详情 1988
6.李春喜.李以圭.陆九芳 查看详情 1996(03)
7.吴建中.陆九芳.李以圭 查看详情 1994(02)
8.Cotterman R L.Schwarz B J.Prausnitz J M 查看详情 1986(11)
9.黄子卿 电解质溶液理论导论 1983
10.徐英年.胡英 查看详情 1987(02)
11.Liu Y.Harvey A H.Prausnitz J M 查看详情 1989
12.Simon N.Bernard O.Blum L 查看详情 1999
13.Eggebrecht J.Ozler P 查看详情 1993(02)
14.Li C X.Li Y G.Lu J F 查看详情 1996
引证文献(7条)
1.李秀伟.张小松.王庚.曹熔泉 溶液除湿能力强化[期刊论文]-化工学报 2008(10)
2.李运刚.陈金.王丽丽 溶液理论的发展现状[期刊论文]-湿法冶金 2007(3)
3.卢贵武.李英峰.孙为.李春喜 硝酸钾电解质溶液水化结构的分子动力学模拟[期刊论文]-化学物理学报 2007(1)
4.徐敏强 水解木质素在超临界乙醇溶液中的液化研究[学位论文]博士 2006
5.史奇冰.郑逢春.李春喜.卢贵武.王子镐 用NRTL方程计算含离子液体体系的汽液平衡[期刊论文]-化工学报2005(5)
6.曾善军.刘国杰 初级的强电解质水溶液热力学模型[期刊论文]-化工学报 2003(3)
7.陆小华.王俊.朱宇.丁皓.周健.王延儒.时钧 分子动力学模拟研究流体微观结构和扩散性质[期刊论文]-南京工业大学学报(自然科学版) 2002(1)
本文链接:.cn/Periodical_hgxb200104016.aspx
授权使用:攀枝花学院(pzhxy),授权号:f89cdf66-4a18-4acb-be33-9e21011d6960
下载时间:20xx年11月1日
