实验十二 电解质溶液活度系数的测定
一、实验目的
测定不同浓度盐酸溶液中的平均离子活度系数,并计算盐酸溶液中的活度。
二、实验原理
将理想液体混合物中一组分B的化学势表示式中的摩尔分数 代之以活度,即可表示真实液体混合物中组分B的化学势。
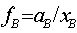
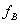 为真实液体混合物中组分B的活度因子。真实溶液中溶质B,在温度T、压力P下,溶质B的活度系数为:
为真实液体混合物中组分B的活度因子。真实溶液中溶质B,在温度T、压力P下,溶质B的活度系数为: 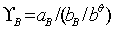
其中 为活度因子(或称活度系数)。
为活度因子(或称活度系数)。
电池:Ag,AgCl| HCL| 玻璃 | 试液 || KCL(饱和)| 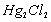 (g),
(g),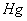
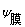
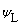 (液接电势)
(液接电势)



 玻璃电极 | | 甘汞电极
玻璃电极 | | 甘汞电极
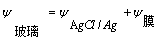
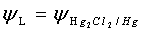
上述电池的电动势:
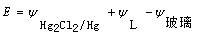 (1)
(1)
其中: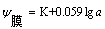 (K是玻璃膜电极外、内膜表面性质决定的常数)
(K是玻璃膜电极外、内膜表面性质决定的常数)
当实验温度为25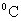 时
时 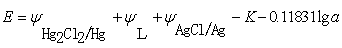
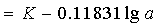
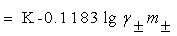 (2)
(2)
上式可改写为: 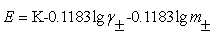
即
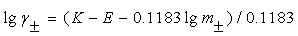
根据得拜——休克尔极限公式,对1——1价型电解质的稀溶液来说,活度系数有下述关系式 
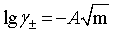
所以 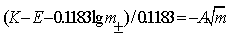
或 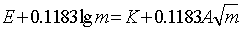
或将不同浓度的HCl溶液构成单液电池,并分别测出其相应的电动势E值,以0.11831gm为纵坐标,以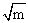 为横坐标作图,可得一曲线,将此曲线外推,即可求得K。求的K后,再将各不同浓度m时所测得的相应E值代入(2)式,就可以算出各种不同浓度下的平均例子活度系数γ±,同时根据
为横坐标作图,可得一曲线,将此曲线外推,即可求得K。求的K后,再将各不同浓度m时所测得的相应E值代入(2)式,就可以算出各种不同浓度下的平均例子活度系数γ±,同时根据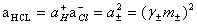 之关系,算出各溶液中HCl相应的活度。
之关系,算出各溶液中HCl相应的活度。
三、仪器药品
仪器:离子活度计、干电池、移液管若干支;
药品:0.1mol/L盐酸溶液
四、试验步骤
1、溶液配制
分别配置0.005mol/L、0.01mol/L、0.02mol/L、0.05 mol/L及0.1 mol/L溶液50mL
2、不同浓度的盐酸溶液的电动势测定
测定不同浓度HCl溶液的E。
五、注意事项
1、本实验中电池的电动势,存在一个平衡的问题,电动势由小到大,也需15min左右才能稳定不变,开始时可以较大的氢气流速把管路中的空气驱尽,随后应以稳定不变的氢气流进行工作。
2、铂黑电极有较强的吸附性能.在测定很稀的溶液时,需多次用待测液淋洗,否则可能改变电池的浓度。
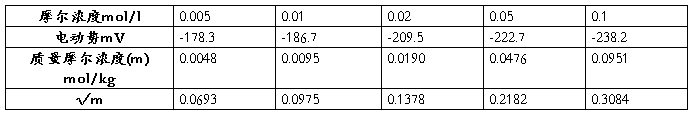
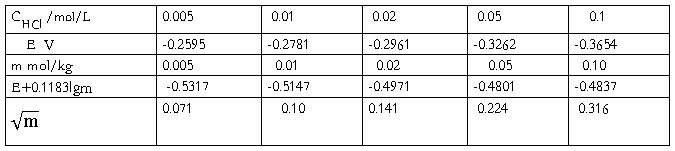
六、数据记录

七、数据处理
1、求E。
将不同浓度的HCl溶液分别测出其相应的电动势E值,以0.11831gm为纵坐标,以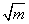 为横坐标作图,将此曲线外推,求K。
为横坐标作图,将此曲线外推,求K。
2、计算出各种不同浓度下的平均离子活度系数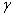 。
。
3、根据公式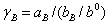 及
及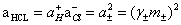 之关系,算出各溶液中HCl相应的活度。
之关系,算出各溶液中HCl相应的活度。
1、数据处理表:
按要求作图:

由图可知K’=-0.468
2、将K’带入公式(2)可得

3、根据公式计算可得:

八、思考题
1、试述电动势法测定平均离子活度系数的基本原理。
把电池电动势的公式 与德拜—休克尔的极限公式
与德拜—休克尔的极限公式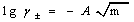 相结合得到
相结合得到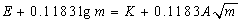 ;作出直线之后再外推得到K’,再将K’代到电动势公式中求出平均离子活度系数。
;作出直线之后再外推得到K’,再将K’代到电动势公式中求出平均离子活度系数。
2、当实验温度接近25℃时,为何可用外推法来确定标准电动势?
因为接近25时德拜—休克尔公式中的A才是我们确定的常数为0.509,而不是随浓度变化的值,才能用外推法。
九、误差分析
1、每次测量前,要用待测液洗干净,以免将溶液稀释。
2、由于离子活度计的读数不断地跳跃,最终读得稍微稳定的值都有偏差。

物 理 化 学
实验报告
实验名称:电解质溶液活度系数的测定
姓 名:刘炳成
班 级:12级应用化学
学 号:1220405005
指导老师:曹红翠
实验日期:20##/3/13
第二篇:电解质溶液活度系数的测定

物理化学实验报告
实验名称: 电解质溶液活度系数的测定
学 号:
班 级: 有色冶金
姓 名:
实验日期: 20##-3-13
一、实验目的
测定不同浓度盐酸溶液中的平均离子活度系数,并计算盐酸溶液中的活度。
二、实验原理
将理想液体混合物中一组分B的化学势表示式中的摩尔分数 代之以活度,即可表示真实液体混合物中组分B的化学势。

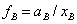
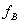 为真实液体混合物中组分B的活度因子。真实溶液中溶质B,在温度T、压力P下,溶质B的活度系数为:
为真实液体混合物中组分B的活度因子。真实溶液中溶质B,在温度T、压力P下,溶质B的活度系数为: 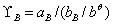
其中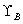 为活度因子(或称活度系数)。
为活度因子(或称活度系数)。
电池:Ag,AgCl|HCL|玻璃|试液||KCL(饱和)| 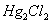
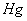
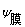
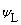 (液接电势)
(液接电势)


 玻璃电极 | | 甘汞电极
玻璃电极 | | 甘汞电极
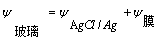
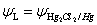
上述电池的电动势: 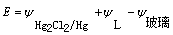 (1)
(1)
其中: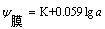 (K是玻璃膜电极外、内膜表面性质决定的常数)
(K是玻璃膜电极外、内膜表面性质决定的常数)
当实验温度为25 时
时 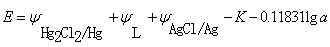
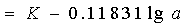
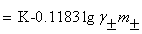 (2)
(2)
上式可改写为: 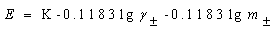
即
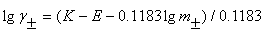 (1)
(1)
根据得拜——休克尔极限公式,对1——1价型电解质的稀溶液来说,活度系数有下述关系式
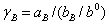
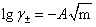
所以 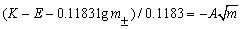
或 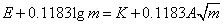
或将不同浓度的HCl溶液构成单液电池,并分别测出其相应的电动势E值,以0.11831gm为纵坐标,以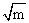 为横坐标作图,可得一曲线,将此曲线外推,即可求得K。求的K后,再将各不同浓度m时所测得的相应E值代入(2)式,就可以算出各种不同浓度下的平均例子活度系数γ±,同时根据
为横坐标作图,可得一曲线,将此曲线外推,即可求得K。求的K后,再将各不同浓度m时所测得的相应E值代入(2)式,就可以算出各种不同浓度下的平均例子活度系数γ±,同时根据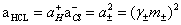 之关系,算出各溶液中HCl相应的活度。
之关系,算出各溶液中HCl相应的活度。
三、仪器药品
仪器: 离子活度计、干电池、移液管若干支;
药品: 0.1mol/L盐酸溶液。
四、试验步骤
1、溶液配制
分别配置0.005mol/L、0.01mol/L、0.02mol/L、0.05 mol/L及0.1 mol/L溶液50mL
2、不同浓度的盐酸溶液的电动势测定
测定不同浓度HCl溶液的E。
五、数据记录
1、配置不同浓度的盐酸溶液所需0.1 mol/L HCl溶液如下:
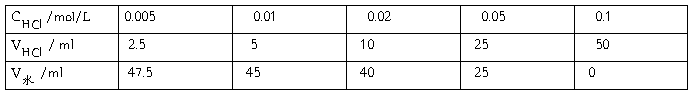
2、不同浓度的50mL盐酸溶液的电动势的测定

六、数据处理
1、根据E值和质量摩尔浓度m及其他值绘制曲线求K'值。
对于一般稀溶液来说,其密度近似等于水的密度,可以近似认为
C(mol/L)=m(mol/kg),这种近似常用于计算中。
由m = CHCl /ρ水,其中 ρ水 = 1.0 Kg/m3 。可计算出 E+0.1183lgm和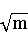 。数据如下表:
。数据如下表:
将不同浓度的HCl溶液分别测出其相应的电动势E值,以
E +0.11831gm为纵坐标,以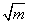 为横坐标作图,将此曲线外推,求K'。
为横坐标作图,将此曲线外推,求K'。
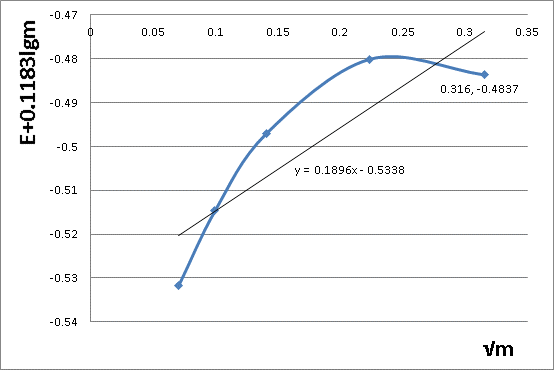
有图可求出K'= -0.5338
2、计算出各种不同浓度下的平均离子活度系数 。
。
将各不同浓度的m时所测得的相应E值代入
lg =1/0.1183 (k'- E – 0.1183lgm)
=1/0.1183 (k'- E – 0.1183lgm)
可计算出各种不同浓度下的平均离子活度系数 。
。
lg 1 =1/0.1183 (k'- E1 – 0.1183lgm)
1 =1/0.1183 (k'- E1 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.2595 – 0.1183lg0.005}
= -0.0177
 1 =0.9600
1 =0.9600
lg 2 =1/0.1183 (k'- E2 – 0.1183lgm)
2 =1/0.1183 (k'- E2 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.2781 – 0.1183lg0.01}
=-0.1614
 2 =0.6896
2 =0.6896
lg 3 =1/0.1183 (k'- E3 – 0.1183lgm)
3 =1/0.1183 (k'- E3 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.2961 – 0.1183lg0.02}
=-0.3103
 3 =0.4894
3 =0.4894
lg 4 =1/0.1183 (k'- E4 – 0.1183lgm)
4 =1/0.1183 (k'- E4 – 0.1183lgm)
=1/0.1183 {-0.5338 + 0.3262 – 0.1183lg0.05}
=-0.5438
 4 = 0.2829
4 = 0.2829
lg 5 =1/0.1183(k'- E5 – 0.1183lgm)
5 =1/0.1183(k'- E5 – 0.1183lgm)
=1/0.1183{-0.5338 + 0.3654 – 0.1183lg0.1}
=-0.4235
 5 = 0.3771
5 = 0.3771
3、根据公式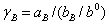 及
及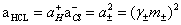 之关系,算出各溶液中HCl相应的活度。
之关系,算出各溶液中HCl相应的活度。
由公式可计算出 B
B
 B1 = (
B1 = ( 1m1)2 = (0.9600 * 0.005)2 = 2.304 * 10-5
1m1)2 = (0.9600 * 0.005)2 = 2.304 * 10-5
 B 2 = (
B 2 = ( 2m2)2 = (0.6896 * 0.01)2 = 7.562 * 10-5
2m2)2 = (0.6896 * 0.01)2 = 7.562 * 10-5
 B3 = (
B3 = ( 3m3)2 = (0.4894 * 0.02)2 = 9.580 * 10-5
3m3)2 = (0.4894 * 0.02)2 = 9.580 * 10-5
 B4 = (
B4 = ( 4m4)2 = (0.2829 * 0.05)2 = 2.000 * 10-4
4m4)2 = (0.2829 * 0.05)2 = 2.000 * 10-4
 B5 = (
B5 = ( 5m5)2 = (0.3771 * 0.1)2 = 2.304 * 10-4
5m5)2 = (0.3771 * 0.1)2 = 2.304 * 10-4
七、思考讨论
1、试述电动势法测定平均离子活度系数的基本原理。
答:平均离子活度系数  ±的测定,测定 ±的方法有溶解度法、依数性法及电动势法。其中以电动势法最简便。用电动势法测电解质离子的
±的测定,测定 ±的方法有溶解度法、依数性法及电动势法。其中以电动势法最简便。用电动势法测电解质离子的 ±时,常利用该电解质溶液设计出一个原电池。设计此原电池的条件是:它的电池反应中只含该电解质溶液而无其它溶液。如测定HCl水溶液HCl的
±时,常利用该电解质溶液设计出一个原电池。设计此原电池的条件是:它的电池反应中只含该电解质溶液而无其它溶液。如测定HCl水溶液HCl的  ±,可设计的原电池同前,由前式可得:ln =F/2RT( Emf - + )由此式可见,该电池的Nernst公式中只含HCl的活度而无其它电解度溶液的活度。
±,可设计的原电池同前,由前式可得:ln =F/2RT( Emf - + )由此式可见,该电池的Nernst公式中只含HCl的活度而无其它电解度溶液的活度。
2、当实验温度接近25℃时,为何可用外推法来确定标准电动势?
答:因为在25℃时电动势E与K'成线性关系,所以可以用外推法来确定标准电动势
