实验三:电解质溶液的电导测定实验

在浓度极稀的时候,额强电解质的Am与√C几乎成线性关系。
由于Kcl溶液是强电解质溶液,可以用外推法作当C ---- 0时,与纵坐标的交点即是溶液在无限稀释时的摩尔电导率Am

图一 :Kcl溶液的摩尔电导Am对√C作图
第二篇:电导法测定弱电解质的电离常
实验四电导法测定弱电解质的电离常数
一、实验目的
1. 学会用电导法测定醋酸的电离平衡常数;
2. 熟悉电导池、电导池常数、溶液电导(或电导率)等相关基本概念;
3. 掌握电桥法测量溶液电导的实验方法和技术。
二、实验原理
根据Arrhenius(阿累尼乌斯)的电离理论,弱电解质与强电解质不同,它在溶液中仅部分解离,离子和未解离的分子之间存在着动态平衡。如醋酸水溶液中,设c为醋酸的原始浓度,αc为解离度,其解离平衡为:
式中电导率κ的单位是S·m-1, 为测量的电导电极两极片间的间距,A为电极片的截面积,对于一个固定的电导池,l和A都是定值,故比值 l/A为一常数,称为电池常数Kcell。所以有
κ=Kcell/R (6)
根据以上关系,只要我们在指定温度下测得不同浓度下的电导率κ(用电导率仪)或溶液的电阻(用1000Hz交流电下的惠斯通电桥测),就可以计算出摩尔电导率∧m,再根据式(3),即可计算出解离常数K来。本实验我们采用测溶液电阻的方法,先用已知电导率的KCl标准溶液测出那个条件下的特征电阻值RS,算出Kcell;然后使用同一电导池测定待测乙酸溶液的电阻Rx,最后就可以得到解离常数K 
因此,实验中必须考虑的是,在增大交流电频率以防极化的同时,还要尽量消除相位差对电桥平衡的影响。比较好的办法是,选择1000Hz的交流频率,尽可能使电流通过电导池里的溶液电阻而不是寄生电容Cx,从而使电导池上的电压降的相位移动较小,而不至于影响测量精度。
三、仪器和试剂
仪器:XD-7型低频信号发生器1台,ZX56型电阻箱1台,SJ8001型示波器1台,恒温水浴1套,260型铂电导电极(镀铂黑)1支,带支管试管4支,25ml移液管1支,容量瓶2只(50ml),小烧杯,洗瓶,导线若干。
试剂:0.01000mol/L KCl溶液,0.1mol/L 左右的HAc溶液(准确浓度c标于瓶签)。
四、实验步骤
1. 调节恒温水浴温度为25.00±0.1℃
2. c/2和c/4浓度HAc溶液的配制:用移液管移取25.00ml真实浓度为c(标于瓶签上)的HAc溶液,注入50ml容量瓶中,然后加蒸馏水至刻度并摇匀即成,其真实浓度分别为原溶液浓度的1/2。然后取c/2浓度的HAc溶液同样方法配制c/4浓度HAc溶液。
3. 按图用导线连接电桥线路,接好后需经教师检查。检查并调节示波器及低频信号发生器(输出频率为1000Hz)的各有关旋钮,然后接通各自电源,观察示波器屏幕,如果出现稳定的正弦波图形,说明接线正确,仪器工作状态也正常,可以进行下一步测定工作。
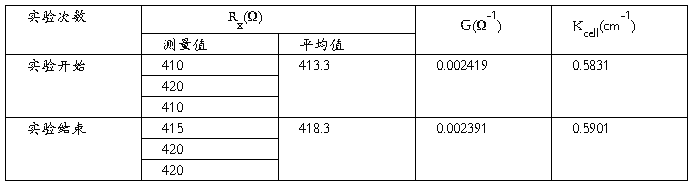
4. 电池常数的测定:
(1)将电导电极和试管用蒸馏水洗净,然后用少量0.01000mol/L的KCl溶液涮洗3次;在试管中加入1/4~1/3容积的KCl溶液,并插入电导电极,将试管置于恒温水浴中恒温5分钟以上。注意:
a. 操作时切勿触碰电极头镀铂黑处,以免损伤铂黑镀层而导致电池常数改变。
b. 测量时若观察到电极表面附有小气泡,应轻轻敲击振动试管,将其排除,以免引起测量误差。
(2)将电阻箱的所有档位旋至0处,选择B点的落位处(取一次中间点),然后从最大档位(×1000)开始调节,每旋转一格,观察示波器屏幕上的正弦曲线的波幅变化,调至波幅最小为止。依次调节下一个档位(×100,×10,×1),最终使得屏幕上波幅减小为0,即形成一条直线,这时可认为电桥达到平衡状态,将电阻箱各档位的读数相加,即为电阻箱阻值R3。
注意:如果从0开始调节某档位旋钮,发现正弦曲线波幅一直增大,说明前一档位调节过大,应将前一档位的数字减少为1个,再回头调节该档位。
(3)重复步骤(1)、(2)两次,即一共测定3次,计算时取其平均值。
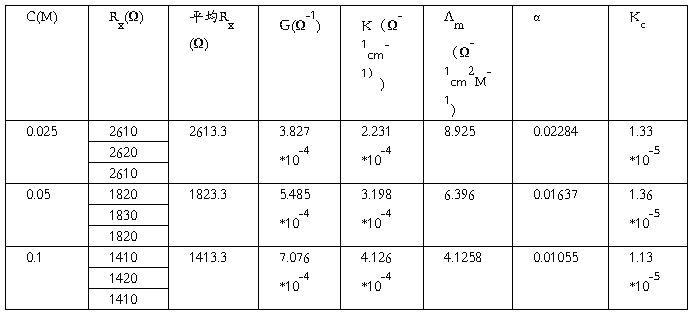
(4)HAc溶液电导的测定:按上述(1)~(4)的方法,依次测定浓度为c,c/2及c/4的HAc溶液的电阻值。
(5)实验完毕,关闭所有仪器电源,清洗玻璃仪器及电导电极,并将电导电极呈给老师看一眼后置于蒸馏水瓶中浸泡保养。
五、数据处理
有关已知数据:25℃下0.01000mol/L KCl溶液电导率К =0.1413 S·m-1 无限稀的HAc水溶液的摩尔电导率(25℃)∧∞m=3.907×10-2S·m2·mol-1
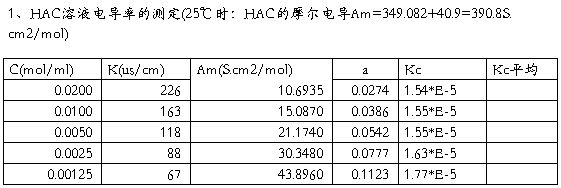
1. 将实验数据列表,然后按实验原理部分所述,分别计算电池常数Kcell和各浓度HAc溶液的解离常数K。
附:数据记录参考格式:
溶液温度___25.0_____℃
HAc溶液浓度:c:_0.1__mol/L c/2:_0.5__mol/L c/4:__0.025___mol/L
(1)电导池常数的测定:
(2)乙酸解离常数的测定:
六、思考题
1. 本实验的电桥为什么要选择使用1000Hz的交流电源?如为了防止极化,频率高一些不是更好吗?试权衡其利弊。
2. 结合本实验结果,分析当HAc浓度变稀时,Rx、к、∧m、αc、K等怎样随浓度变化?你的实验结果与理论是否相符合?为什么?
3. 公式是针对什么溶液的?是不是任何电解质的都能够通过作图法外推得到?
4. 你能否设计出一个方案很准确地测得溶液的电阻(或电导率)或者一个携带很方便的、精度不是很高的产品快捷地测出溶液的电阻(或电导率)吗?因为这两种产品都有它的卖点。
