化学实验报告单

第二篇:化学实验(物质的性质)
物质的性质
1.欲将含有盐酸的氯化钙溶液中和至中性,得到氯化钙溶液,在没有指示剂的情况下,
应加入的试剂是( )
(A)纯碱 (B)生石灰
(C)熟石灰 (D)石灰石粉末
分析 选项A,不符合题意。纯碱与盐酸反应生成氯化钠,成为氯化钙的新杂质。
选项B,不符合题意。生石灰与盐酸反应生成了氯化钙,待盐酸用完后,生石灰还能与水反应生成熟石灰,使溶液显碱性。
选项C,不符合题意。
选项D,符合题意。石灰石粉末主要是碳酸钙,与盐酸反应生成氯化钙。过量的石灰石因其本身难溶于水,不改变溶液的酸碱性。
本题的正确选项为D。
2.白色固体A经过高温煅烧可生成两种氧化物B、C。将B通过加热的木炭可转化成D,D通过灼热的氧化铁,又可以转化为B,同时生成一种单质E。将C放入水中,生成一种微溶于水的碱。写出各物质的化学式(或物质名称):
A________,B________,C________,D________,E________。
分析 读题分析,找到解题突破口。
(1)白色固体A高温分解成氧化物B、C,在初中化学中,涉及面很小,应为煅烧石灰石。
(2)氧化物B与木炭反应转化为D,估计是二氧化碳与木炭反应转化为一氧化碳。
(3)D通过灼热的氧化铁,又生成B,说明D是一种还原性物质。
(4)把氧化物C放入水中,生成一种微溶于水的碱,成为验证以上设想的关键,也是本题的突破口。微溶于水的碱即氢氧化钙。
通过以上分析,C为氧化钙,白色固体A为碳酸钙,氧化物B为二氧化碳,D是一氧化碳,E是铁。
本题的正确答案为:CaCO3 CO2 CaO CO Fe
3.根据下图的实验装置和实验程序,写出下列各物质的名称及各部分发生反应的化学方程式。已知:A和C都是无色气体,C能燃烧,B和D都是黑色粉末;当加热D时,黑色粉末逐渐变为红色,试管丙处的澄清石灰水变浑浊。

分析 读题分析,找到解题突破口。
(1)装置甲用酒精喷灯,说明反应条件为高温。生成的C为可燃性气体,范围确定为氢气和一氧化碳。
(2)C使装置乙中的黑色粉末变成红色,使装置丙中澄清石灰水变浑浊,成为本题的突破口,C为一氧化碳。
鉴于以上分析:
A为二氧化碳,黑色粉末B为炭粉,C为一氧化碳,黑色粉末D是氧化铜。
甲处的反应:CO2+C 2CO;
2CO;
乙处的反应:CuO+CO Cu+CO2;
Cu+CO2;
丙处的反应:Ca(OH)2+CO2—→CaCO3↓+H2O;
丁处的反应:2CO+O2 2CO2。
2CO2。
4.按要求写出下列反应的化学方程式,并完成题后的填空:
(1)一种固体加热分解产生一种盐、一种氧化物和一种单质:_______________,该单质根据其密度可用________法收集。
(2)验证铁的金属活动性比银强:______________________,反应类型:________。
(3)存放石灰水的试剂瓶内壁有白膜,用某溶液洗涤除去:________。
解 根据题中的信息,确认反应:
(1) 2KMnO4  K2MNO4+MNO2+O2↑,根据氧气的密度,可用向上排气法收集。
K2MNO4+MNO2+O2↑,根据氧气的密度,可用向上排气法收集。
(2) Fe+2AgNO3—→Fe(NO3)2+2Ag(注意铁的化合价),反应类型为置换反应。
(3)白膜为CaCO3,洗液为稀盐酸,CaCO3+2HCl—→CaCl2+CO2↑+H2O。
5.有甲、乙两组物质,乙组中有一种物质能跟甲组中所有物质反应,写出有关反应的化学方程式。
甲组:硝酸、碳酸钠溶液、二氧化碳。
乙组:氧化铜、石灰石、澄清石灰水。
______________________________________________________________________
分析 氧化铜:碱性氧化物,不溶于水。能发生的反应:①与酸生成盐和水,②与酸性氧化物生成盐,③被还原剂还原。
石灰石:主要成分是碳酸钙,不溶于水。能发生的反应:①与酸反应生成盐和水,放出二氧化碳,②与二氧化碳和水反应生成酸式盐,③高温分解。
澄清石灰水:主要成分是氢氧化钙。能发生的反应:①与酸反应生成盐和水,②与酸性氧化物反应生成盐和水,③与盐反应生成新碱和新盐。
鉴于以上分析,确认乙组中的澄清石灰水能与甲组中所有物质反应。
Ca(OH)2+2HNO3—→Ca(NO3)2+2H2O
Ca(OH)2+Na2CO3—→CaCO3↓+2NaOH
Ca(OH)2+CO2—→CaCO3↓+H2O
6.下列物质暴露在空气中一段时间后,质量增加且变质的是( )
(A)浓盐酸 (B)碳酸钠晶体 (C)氢氧化钠固体 (D)浓硫酸
分析 选项A,不符合题意。浓盐酸露置在空气中一段时间,因挥发使质量减小,不变质。
选项B,不符合题意。碳酸钠晶体露置在空气中一段时间,因风化质量减小,变成碳酸钠。
选项C,符合题意。氢氧化钠固体露置在空气中一段时间,因潮解和吸收二氧化碳而质量增加,与二氧化碳反应而变质。
选项D,不符合题意。浓硫酸露置在空气中一段时间,因其具有吸水性而质量增加,不变质。
本题的正确选项为C。
7.下列各种物质的溶液混合后,所得溶液一定呈酸性的是( )
(A)KOH、NaNO3、HCl (B)BaCl2、NaCl、H2SO4
(C)Ca(OH)2、KNO3、Na2CO3 (D)NaCl、NaNO3、KNO3
分析 选项A,不符合题意。不知KOH与HCl反应的物质的量,无法确定为酸性。
选项B,符合题意。因为BaCl2+H2SO4—→BaSO4↓+2HCl,无论BaCl2和H2SO4反应的物质的量为多少,混合后总有酸存在,溶液一定为酸性。
选项C,不符合题意。因为Ca(OH)2+Na2CO3—→CaCO3↓+2NaOH,无论Ca(OH)2和Na2CO3反应的物质的量为多少,混合后总有碱存在,溶液一定为碱性。
选项D,不符合题意。这三种物质间没有反应,且溶液均为中性。
本题的正确选项为B。
8.在M+H2SO4(稀)—→Fe2(SO4)3+N(M、N分别代表一种物质)反应中,M可能是下列物质中的( )
①Fe ②Fe2O3 ③Fe(OH)3 ④FeCl3
(A)①② (B)②③ (C)①②③ (D)全部
分析 本题的关键点是铁元素的化合价。由于生成物为硫酸铁,故参加反应的含铁的化合物中铁元素的化合价必须为+3价,且能与硫酸发生反应。
① Fe:Fe+H2SO4—→FeSO4+H2↑;
②Fe2O3:Fe2O3+3H2SO4—→Fe2(SO4)3+3H2O;
③Fe(OH)3: 2Fe(OH)3+3H2SO4—→Fe2(SO4)3+6H2O;
④FeCl3:与硫酸不反应,因没有满足复分解反应的条件。
本题的正确选项为B。
9.在氢气还原氧化铜的实验中,若试管出现炸裂现象,其可能的原因是( )
①实验开始时,先给盛有氧化铜的试管加热,然后通入氢气 ②盛有氧化铜的试管口向上倾斜 ③实验结束时,先停止通氢气,后停止加热 ④试管外壁有水珠 ⑤加热时,试管接触酒精灯的灯芯 ⑥通氢气的导管没有伸入到试管底部
(A)①②③ (B)④⑤⑥ (C)②④⑤ (D)①③⑥
解 试管损坏的原因有:受热不均、热胀冷缩引起的破裂;因可燃性气体与助燃性气体混合爆炸引起的炸裂;受过度外力引起的破碎等。本题中是“炸裂”现象,因此从原因中找可燃性气体与助燃性气体混合的情况。
①③⑥都是出现了氢气和试管内的空气或与管外进入的空气混合情况,遇明火会爆炸,引起试管的炸裂。
②是冷凝水倒流引起热试管的破裂,④是外壁水珠引起的试管受热不均,⑤是灯芯温度过低引起的试管破裂。
本题的正确选项为D。
10.下列选项中有两种或三种物质,在同一个化学反应中不可能生成的是( )
(A)CuCl2、KOH (B)H2、O2
(C)H2O、CO2 (D)CO2、H2O、Ca(NO3)2
解 本题的问法成为解题的突破口。“以下物质在同一反应中不可能生成”,实际上就是这些物质之间接触就有反应,无法共存在一起。
选项A,符合题意。CuCl2+2KOH—→Cu(OH)2↓+2KCl,这两种物质不可能在同一反应中生成。
选项B,不符合题意。电解水同时生成氧气和氢气。
选项C,不符合题意。碳酸盐与稀酸反应生成水和二氧化碳,关键是碳酸不稳定易分解。
选项D,不符合题意。碳酸钙和稀硝酸反应就可以生成这些物质。
本题的正确选项为A。
11.将无色的由二氧化碳、一氧化碳、氮气、水蒸气、氢气组成的混合气体,依次通过澄清石灰水、灼热氧化铜、干燥剂(不与混合气体反应)、灼热的炭层,假若在依次通过的过程中,气体物质完全吸收或反应完全,则最后导出的气体含有________。
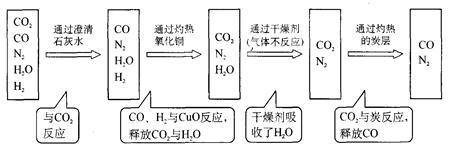 解
解
本题的正确答案为:CO和N2
12.A、B、C、D四种单质,在通常状况下A、B为无色气体,C为红色固体,D为灰黑色固体粉末,现将四种物质做以下实验,现象记录如下:
①在A中加热C得到黑色固体甲;②将D与甲混合,高温灼烧得到C与一种无色气体乙;③将B通过灼热的甲,又可得到C与一种常温下为无色液态的物质。试根据实验结果推断各物质并写出有关反应的化学方程式。
A________,B________,C________,D________。
第①步反应的化学方程式为________________;
第②步反应的化学方程式为________________;
第③步反应的化学方程式为________________。
分析 读题,找出关键信息:
①红色固体与无色气体反应得到黑色固体,估计铜与氧气反应得到氧化铜。
②灰黑色固体与黑色固体高温灼烧,得到红色固体和无色气体,结合信息①直接推断,以上估计成立。
③无色气体与氧化铜反应得到铜和液体,推断:氢气还原氧化铜。
解 A为O2,B为H2,C为Cu,D为C。
第①步:2Cu+O2 2CuO;
2CuO;
第②步:C+2CuO 2Cu+CO2↑;
2Cu+CO2↑;
第③步:H2+CuO Cu+H2O。
Cu+H2O。
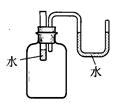 13.如右图所示,向小试管中分别加入下列一定量的物质,右面U形
13.如右图所示,向小试管中分别加入下列一定量的物质,右面U形
管中的液面未发生明显变化,则该物质是( )
(A)浓硫酸 (B)氢氧化钠固体
(C)氧化钙固体 (D)食盐固体
分析 读图,由图中U形管液面的不同,可分为三种情况。
U形管液面保持水平,说明液体两端的压强相同或瓶内气体体
积无变化;
U形管液面左低右高,说明广口瓶内压强大或广口瓶内气体体积增大;
U形管液面左高右低,说明广口瓶内压强小或广口瓶内气体体积缩小。
选项A,浓硫酸加入水中,释放大量热量,使瓶内气体体积增大,导致U形管液面左低右高。
选项B,氢氧化钠固体加入水中,也释放大量热量,使瓶内气体体积增大,导致U形管液面左低右高。
选项C,氧化钙固体与水反应释放大量热量,使瓶内气体体积增大,导致U形管液面左低右高。
选项D,食盐加入水中,溶解时温度没有明显变化,U形管液面保持水平。
本题的正确选项为D。
14.既不溶于水,也不溶于稀硫酸,但能溶于硝酸银溶液的物质是( )
(A)铜 (B)氯化钙 (C)碳酸铜 (D)硫酸钡

本题的正确选项为A。
15.将某气体通过灼热的CuO后,再通入澄清石灰水中,可观察到黑色粉末逐渐变红,并且石灰水变浑浊,下列结论中正确的是( )
①该气体一定为CO ②该气体只含碳、氧两种元素 ③该气体一定具有还原性
④该气体一定含有碳元素 ⑤该气体可能为混合物
(A)①②③ (B)②③⑤ (C)③④⑤ (D)②③④⑤
分析


本题的正确选项为C。
