s区、d区、ds区重要元素及其化合物
(s Block, ds Block, d Block Elements and Compounds)
9.1 s区元素
s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性
碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质
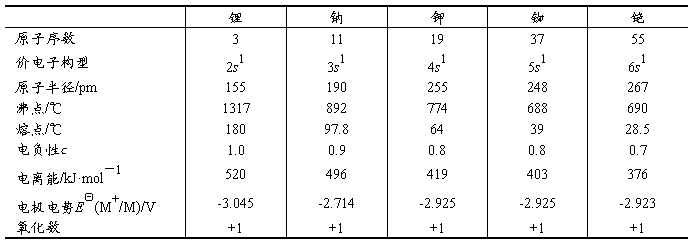
碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。因此,碱金属是同周期元素中金属性最强的元素。碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质
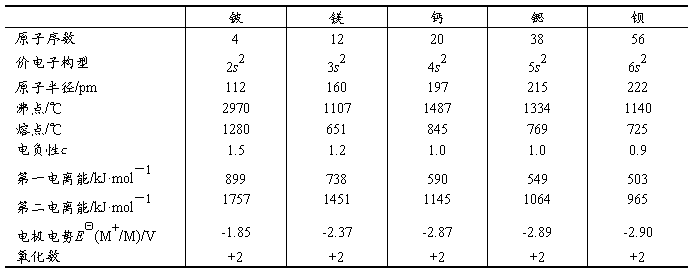
s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。密度最低的是锂(0.53g·cm-3),是最轻的金属,即使密度最大的镭,其密度也小于5(密度小于5的金属统称为轻金属)。碱金属、碱土金属的硬度除铍和镁外也很小,其中碱金属和钙、锶、钡可以用刀切,但铍较特殊,其硬度足以划破玻璃。从熔、沸点来看,碱金属的熔、沸点较低,而碱土金属由于原子半径较小,具有2个价电子,金属键的强度比碱金属的强,故熔、沸点相对较高。
s区元素是最活泼的金属元素,它们的单质都能与大多数非金属反应,例如极易在空气中燃烧。除了铍、镁外,都较易与水反应。s区元素形成稳定的氢氧化物,这些氢氧化物大多是强碱。
s区元素所形成的化合物大多是离子型的。第二周期的锂和铍的离子半径小,极化作用较强,形成的化合物基本上是共价型的,少数镁的化合物也是共价型的;也有一部分锂的化合物是离子型的。常温下s区元素的盐类在水溶液中大都不发生水解反应。
9.1.2 s区元素的重要化合物
(1)氧化物
(1.1)氧化物种类与制备
碱金属、碱土金属与氧能形成多种类型的氧化物:正常氧化物、过氧化物、超氧化物、臭氧化物(含有O3-)以及低氧化物,其中前三种的主要形成条件见表9-3。
表9-3 s区元素形成的氧化物

例如碱金属中的锂在空气中燃烧时,生成正常氧化物Li2O:
4Li + O2 2Li2O
2Li2O
碱金属的正常氧化物也可以用金属与它们的过氧化物或硝酸盐作用而得到的。
例如:
Na2O2 + 2Na 2Na2O
2Na2O
2KNO3 + 10K 6K2O + N2↑
6K2O + N2↑
碱土金属的碳酸盐、硝酸盐、氢氧化物等热分解也能得到氧化物MO。例如:
MCO3 MO + CO2↑
MO + CO2↑
除铍和镁外,所有碱金属和碱土金属都能分别形成相应的过氧化物M2ⅠO2和MⅡO2,其中过氧化钠是最常见的碱金属过氧化物。将金属钠在铝制容器中加热到300℃,并通入不含二氧化碳的干燥空气,得到淡黄色的Na2O2粉末:
2Na + O2 2Na2O2
2Na2O2
钙、锶、钡的氧化物与过氧化氢作用,得到相应的过氧化物:
MO + H2O2 + 7H2O MO2 · 8H2O
MO2 · 8H2O
工业上把BaO在空气中加热到600℃以上使它转化为过氧化钡:
2BaO + O2 2BaO2
2BaO2
除了锂、铍、镁外,碱金属和碱土金属都分别能形成超氧化物MO2和M(O2)2。一般说来,金属性很强的元素容易形成含氧较多的氧化物,因此钾、铷、铯在空气中燃烧能直接生成超氧化物MO2。例如:
K + O2  KO2
KO2
(1.2)磁性与稳定性
正常氧化物、过氧化物、超氧化物这三类常见氧化物分别含有O2—、O22—、O2—离子。
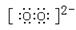 过氧化物中的负离子是过氧离子O22—,其结构式如下:
过氧化物中的负离子是过氧离子O22—,其结构式如下:
或 [—O—O 或[O-O-]2—
按照分子轨道理论,O22-的分子轨道电子排布式为:
(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2p)2(π2p)4(π*2p)4
其中只有一个σ键,键级为1。由于电子均成对,因而O22—为反磁性。
超氧化物中的负离子是超氧离子O2—,其结构式如下:
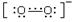
按照分子轨道理论,O2—的分子轨道电子排布式为:
(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2p)2(π2p)4(π*2p)3
O2—中有一个σ键和一个三电子键,键级为3/2。由于含有一个未成对电子,因而O2—具有顺磁性。
联系O2、O22—、O2—的结构可以看出:O22—和O2—的反键轨道上的电子比O2多,键级比O2小,键能(分别为142和398kJ·mol-1)比O2(498kJ·mol-1)小。所以过氧化物和超氧化物稳定性不高。
(1.3)性质
(1.3.1)熔点及硬度
由于Li+的离子半径特别小,Li2O的熔点很高。Na2O熔点也很高,其余的氧化物未达熔点时便开始分解。碱土金属氧化物中,唯有BeO是ZnS型晶体,其他氧化物都是NaCl型晶体。与M+相比,M2+电荷多,离子半径小,所以碱土金属氧化物具有较大的晶格能,熔点都很高,硬度也较大(金刚石硬度为10的话,BeO的硬度等于9)。除BeO外,由MgO到BaO,熔点依次降低。
BeO和MgO可作耐高温材料,CaO是重要的建筑材料,也可由它制得价格便宜的碱Ca(OH)2。
(1.3.2)与水及稀酸的反应
碱金属氧化物与水化合生成碱性氢氧化物MOH。Li2O与水反应很慢,Rb2O和Cs2O与水发生剧烈反应。碱土金属的氧化物都是难溶于水的白色粉末。BeO几乎不与水反应,MgO与水缓慢反应生成相应的碱。
M2O + H2O 2MOH
2MOH
MO + H2O M(OH)2
M(OH)2
过氧化钠与水或稀酸在室温下反应生成过氧化氢:
Na2O2 + 2H2O 2NaOH + H2O2
2NaOH + H2O2
Na2O2 + H2SO4(稀) Na2SO4 + H2O2
Na2SO4 + H2O2
超氧化物与水反应立即产生氧气和过氧化氢。例如:
2KO2 + 2H2O 2KOH + H2O2 + O2↑
2KOH + H2O2 + O2↑
因此,超氧化物是强氧化剂。
(1.3.3)与二氧化碳的作用
过氧化钠与二氧化碳反应,放出氧气:
2Na2O2 + 2CO2 2Na2CO3 + O2↑
2Na2CO3 + O2↑
超氧化钾与二氧化碳作用放出氧气:
4KO2 + 2CO2 2K2CO3 + 3O2↑
2K2CO3 + 3O2↑
KO2较易制备,常用于急救器中,利用上述反应提供氧气。
另外,过氧化钠也是一种强氧化剂,工业上用作漂白剂,也可以用来作为制得氧气的来源。Na2O2在熔融时几乎不分解,但遇到棉花、木炭或铝粉等还原性物质时,就会发生爆炸,使用Na2O2时应当注意安全。
(2) 氢氧化物
碱金属和碱土金属的氢氧化物在空气中易吸水而潮解,故固体NaOH和Ca(OH)2常用作干燥剂。
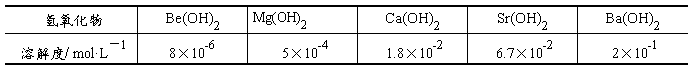
(2.1)溶解性
碱金属的氢氧化物在水中都是易溶的,溶解时还放出大量的热。碱土金属的氢氧化物的溶解度则较小,其中Be(OH)2和Mg(OH)2是难溶的氢氧化物。碱土金属的氢氧化物的溶解度列入表9-4中。由表中数据可见,对碱土金属来说,由Be(OH)2到Ba(OH)2,溶解度依次增大。这是由于随着金属离子半径的增大,正、负离子之间的作用力逐渐减小,容易为水分子所解离的缘故。
表9-4碱土金属氢氧化物的溶解度(20℃)
(2.2)酸碱性
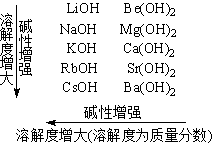
碱金属、碱土金属的氢氧化物中,除Be(OH)2为两性氢氧化物外,其他的氢氧化物都是强碱或中强碱。这两族元素氢氧化物碱性递变的次序如下:
LiOH<NaOH<KOH<RbOH<CsOH
中强碱 强碱 强碱 强碱 强碱
Be(OH)2<Mg(OH)2<Ca(OH)2<Sr(OH)2<Ba(OH)2
两性 中强碱 强碱 强碱 强碱
金属氢氧化物的酸碱性递变规律,可用上章的ROH规律加以解释。
碱金属、碱土金属氢氧化物的碱性和溶解度递变规律可以归纳如下:
(3) 重要的盐类
应该注意,碱土金属中铍的盐类很毒,钡盐也很毒。
(3.1)晶体类型与熔、沸点
碱金属的盐大多数是离子型晶体,它们的熔点、沸点较高。由于Li+离子半径很小,极化力较强,它在某些盐(如卤化物)中表现出不同程度的共价性。碱土金属离子带两个正电荷,其离子半径较相应的碱金属小,故它们的极化力较强,因此碱土金属盐的离子键特征较碱金属的差。但随着金属离子半径的增大,键的离子性也增强。例如,碱土金属氯化物的熔点从Be到Ba依次增高:
氯化物 BeCl2 MgCl2 CaCl2 SrCl2 BaCl2
熔点/℃ 405 714 782 876 962
其中,BeCl2的熔点明显地低,这是由于Be2+半径小,极化力较强,它与Cl-、Br-、I-等极化率较大的阴离子形成的化合物已过渡为共价化合物。
(3.2)溶解度
碱金属的盐类大多数都易溶于水。碱金属的碳酸盐、硫酸盐的溶解度从Li至Cs依次增大,少数碱金属盐难溶于水,例如LiF、LiCO3、Li3PO4、NaZn(UO2)3(CH3COO)9·6H2O、KClO4、K2[PtCl6]等。碱土金属的盐类中,除卤化物和硝酸盐外,多数碱土金属的盐只有较低的溶解度,例如它们的碳酸盐、磷酸盐以及草酸盐等都是难溶盐(BeC2O4除外)。铍盐中多数是易溶的,镁盐有部分溶,而钙、锶、钡的盐则多为难溶,钙盐中以CaC2O4的溶解度为最小,因此常用生成白色CaC2O4的沉淀反应来鉴定Ca2+。由于这些盐的溶解度很小,有些硫酸盐在自然界中就会沉积为矿石,主要的矿石有菱镁矿(CaCO3)、白云石(MgCO3·CaCO3)、方解石和大理石(CaCO3)、重晶石(BaSO4)和石膏(CaSO3·2H2O)等。
(3.3)热稳定性
碱金属的盐除硝酸盐及碳酸锂外一般都具有较强的稳定性,在800℃以下均不分解。
2NaNO3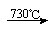 2NaNO2 + O2
2NaNO2 + O2
因此,常可以利用Na2CO3来熔解许多酸性物质。
BaSO4(重晶石) + 2NaNO3 BaCO3 + 2Na2SO4
BaCO3 + 2Na2SO4
碱土金属盐的稳定性相对较差,但在常温下还是稳定的,只有铍盐特殊。例如,BeCO3加热不到100℃就会分解。
(4) Li、Be的特殊性及对角线规则
(4.1)Li与Mg、Be与Al的相似性
锂只有两个电子层,Li+半径特别小,水合能特别大,这使锂和同族碱金属元素相比较有许多特殊性质,而和第二族Mg有相似性。例如Li比同族元素有较高的熔、沸点和硬度;Li难生成过氧化物;像Mg3N2一样,Li3N是稳定的化合物;Li和第二族一样能和碳直接生成Li2C2;Li能形成稳定的配合物,如[Li(NH3)4]I;Li2CO3、Li3PO4和LiF等皆不溶于水;LiOH溶解度极小,受热易分解,不稳定;Li的化合物有共价性,故能溶于有机溶剂中等。
铍及其化合物的性质和同族其他金属元素及其化合物也有明显的差异。铍的熔点、沸点比其他碱土金属高,硬度也是碱土金属中最大的,但都有脆性。铍有较强的形成共价键的倾向,例如BeCl2已属于共价型化合物,而其他碱土金属的氧化物基本上都是离子型的。但铍和第三族的铝有相似性。铍和铝都是两性金属,既能溶于酸,也能溶于强碱;铍和铝的标准电极电势相近。EΘ(Be2+/Be)=-1.70V,EΘ(Al3+/Al)=-1.66V,金属铍和铝都能被冷的浓硝酸钝化;铍和铝的氧化物均是熔点高、硬度大的物质;铍和铝的氢氧化物Be(OH)2和Al(OH)3都是两性氢氧化物,而且都难溶于水。铍和铝的氟化物都能与碱金属的氟化物形成配合物,如Na2[BeF4]、Na3[AlF6];它们的氯化物、溴化物、碘化物都易溶于水;铍和铝的氯化物都是共价型化合物,易升华、易聚合、易溶于有机溶剂。
(4.2)对角线规则
上述的相似性即所称的“对角线”相似性。在s区和p区元素中,除了同族元素的性质相似外,还有一些元素及其化合物的性质呈现出“对角线”相似。所谓对角线相似即ⅠA族的Li与ⅡA族的Mg、ⅡA族的Be与ⅢA族的Al、ⅢA族的B与Ⅳ族的Si这三对元素在周期表中处于对角线位置:
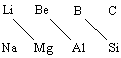
周期表中,某元素及其化合物的性质与它左上方或又下方元素及其化合物性质的相似性就称为对角线规则。
对角线规则是从有关元素及其化合物的许多性质中总结出来的经验规律;对此可以用离子极化的观点加以粗略的说明。同一周期最外层电子构型相同的金属离子,从左至右随离子电荷的增加而引起极化作用的增强;同一族电荷相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱。因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质比较相似。由此反映出物质的结构与性质之间的内在联系。
(5) 硬水及其软化
工业上根据水中Ca2+和Mg2+的含量,把天然水分为两种:溶有较多量Ca2+和Mg2+的水叫做硬水;溶有少量Ca2+和Mg2+的水叫做软水。
(5.1)暂时硬水与永久硬水
含有碳酸氢钙Ca(HCO3)2或碳酸氢镁Mg(HCO3)2的硬水经煮沸后,所含的酸式碳酸盐就分解为不溶性的碳酸盐。例如:
Ca(HCO3)2  CaCO3↓+ H2O + CO2↑
CaCO3↓+ H2O + CO2↑
2Mg(HCO3)2 Mg2(OH)2CO3↓+ H2O + 3CO2↑
Mg2(OH)2CO3↓+ H2O + 3CO2↑
这样,容易从水中除去Ca2+和Mg2+,水的硬度就变低了,故这种硬水叫做暂时硬水。
含有硫酸镁MgSO4、硫酸钙CaSO4或氯化镁MgCl2、氯化钙CaCl2等的硬水,经过煮沸,水的硬度也不会消失。这种水叫做永久硬水。
(5.2)硬水的软化
消除硬水中Ca2+、Mg2+的过程叫做硬水的软化。常用的软化方法有石灰纯碱法和离子交换树脂净化水法。
永久硬水可以用纯碱软化。纯碱与钙、镁的硫酸盐和氯化物反应,生成难溶性的盐,使永久硬水失去它的硬性。工业上往往将石灰和纯碱各一半混合用于水的软化,称为石灰纯碱法。反应方程式如下:
MgCl2 + Ca(OH)2 Mg(OH)2↓+ CaCl2
Mg(OH)2↓+ CaCl2
CaCl2 + Na2CO3 CaCO3↓+ 2NaCl
CaCO3↓+ 2NaCl
反应终了再加沉降剂(例如明矾),经澄清后得到软水。石灰纯碱法操作比较复杂,软化效果较差,但成本低,适于处理大量的且硬度较大的水。例如,发电厂、热电站等一般采用该法作为水软化的初步处理。
9.2 d区元素
过渡元素包括ⅠB到ⅦB族和第Ⅷ族共30多个元素。通常又把过渡元素分成第一过渡系(从钪到锌),第二过渡系(从钇到镉)和第三过渡系(从镧到汞,不包括镧系元素)。第一过渡系的元素及其化合物应用较广,并有一定的代表性。下面重点讨论第一过渡系。
9.2.1 通性
(1)有关原子参数与氧化数
过渡元素的一般性质列于表9-5。
过渡元素的价电子不仅包括最外层的s电子,还包括次外层全部或部分d电子(Zn、Cd、Hg除外)。这样的电子构型使得它们能形成多种氧化数的化合物。它们的最高氧化数等于最外层s电子和次外层d电子数的总和。但在第Ⅷ族、ⅠB、ⅡB族中这一规律不完全
表9-5 过渡元素的一般性质
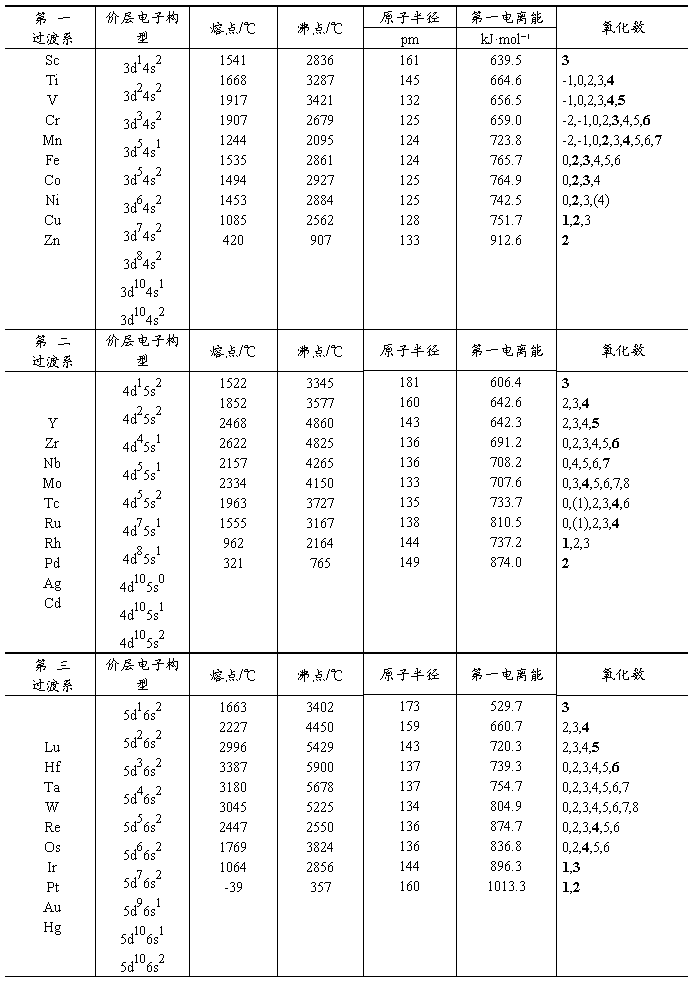
注:表中黑体数字为常见氧化数,氧化数为0的表示这种元素形成羰合物时的氧化数。
适用。另外,除ⅢB及ⅡB族中的Zn、Cd外,其他过渡元素的氧化数都是可变的。
具有较低氧化数的过渡元素,大都以“简单”离子(M+、M2+、M3+)存在。
(2)主要物理性质
过渡元素大都是高熔点、高沸点(Zn、Cd、Hg除外)、密度大、导电和导热性能良好的重金属。它们广泛地被用在冶金工业上制造合金钢,例如不锈钢(含镍和铬),弹簧钢(含钒)、锰钢等。熔点最高的单质是钨,硬度最大的是铬,单质密度最大的是锇(Os)。
(3)主要化学性质
钪Sc、钇Y、镧La是过渡元素中最活泼的金属。例如,在空气中Sc、Y、La能迅速地被氧化,与水作用放出氢。它们的活泼性接近于碱土金属。Sc、Y、La的性质之所以比较活泼,是因为它们的原子次外层d轨道中仅有一个电子,这个电子对它们的影响尚不显著,所以它们的性质较活泼并接近于碱土金属。
同一族的过渡元素除ⅢB族外,其他各族都是自上而下活泼性降低。一般认为这是由于同族元素自上而下原子半径增加不大,而核电荷数却增加较多,对电子吸引增强,所以第二、三过渡系元素的活泼性急剧下降。特别是镧以后的第三过渡系的元素,又受镧系收缩的影响,它们的原子半径与第二过渡系相应的元素的原子半径几乎相等。因此第二、三过渡系的同族元素及其化合物,在性质上很相似。例如,锆与铪在自然界中彼此共生在一起,把它们的化合物分离开比较困难。铌和钽也是这样。同一过渡系的元素在化学活泼性上,总的来说自左向右减弱,但是减弱的程度不大。
过渡元素的原子或离子都具有空的价电子轨道,这种电子构型为接受配位体的孤对电子形成配价键创造了条件。因此它们的原子或离子都有形成配合物的倾向。
(4)离子的颜色
过渡元素的大多数水合离子常带有一定的颜色。关于离子有颜色的原因是很复杂的,过渡元素的水合离子之所以具有颜色,与它们的离子具有未成对的d电子有关。过渡元素的许多离子具有未成对的d电子,没有未成对d电子的离子如Sc3+、Zn2+、Ag+、Cu+等都是无色的,而具有未成对d电子的离子则呈现出颜色,如Cu2+、Cr3+、Co2+等。
综上所述,过渡元素主要有以下几个特点:
①同一种元素有多种氧化数;
②金属活泼性;
③易于形成多种配合物;
④水合离子和酸根离子常带有颜色。
9.2.2 铬的重要化合物
铬由于它漂亮的色泽及很高的硬度,因此常被镀在其他金属表面起装饰和保护作用。铬可以形成合金,在各种类型的不锈钢中几乎都有较高比例的铬。当钢中含有铬14%左右,这便是不锈钢。
铬原子的价电子是3d54s1。铬的最高氧化数是+6,但也有+5、+4、+3、+2的。最重要的是氧化数为+6和+3的化合物。氧化数为+5、+4和+2的化合物都不稳定。
铬的元素电势图如下:
酸性溶液中EΘA/V
Cr2O72-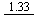 Cr3+
Cr3+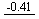 Cr2+
Cr2+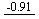 Cr
Cr

碱性溶液中EΘB/V
CrO42-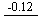 Cr(OH)3
Cr(OH)3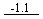 Cr(OH)2
Cr(OH)2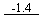 Cr
Cr
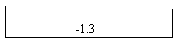
(1)铬(Ⅲ)的化合物
(1.1)氧化物和氢氧化物的溶解性与酸碱性
三氧化二铬是难溶和极难熔化的氧化物之一,熔点是2275℃,微溶于水,溶于酸。灼烧过的Cr2O3不溶于水,也不溶于酸。在高温下它可与焦硫酸钾分解放出的SO3作用,形成可溶性的硫酸铬Cr2(SO4)3:
Cr2O3 + 3K2S2O7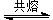 Cr2(SO4)3+3 K2SO4
Cr2(SO4)3+3 K2SO4
Cr2O3是具有特殊稳定性的绿色物质,它被用作颜料(铬绿)。近年来也有用它作有机合成的催化剂。它是制取其他铬化合物的原料之一。
氢氧化铬Cr(OH)3是用适量的碱作用于铬盐溶液(pH约为5.3)而生成的灰蓝色沉淀:
Cr3+ + 3OH- Cr(OH)3↓
Cr(OH)3↓
Cr(OH)3是两性氢氧化物。它溶于酸,生成绿色或紫色的水合配离子(由于Cr3+的水合作用随条件——温度、浓度、酸度等而改变,故其颜色也有所不同)。从溶液中结晶出的铬盐大都为紫色晶体。Cr(OH)3与强碱作用生成绿色的配离子[Cr(OH)4]-(或为Cr(OH) 63-):
Cr(OH)3 + OH- Cr(OH)4-
Cr(OH)4-
由于Cr(OH)3的酸性和碱性都较弱,因此铬(Ⅲ)盐和四羟基合铬(Ⅲ)酸盐(或亚铬酸盐)在水中容易水解。
(1.2)铬盐的制备与碱性条件下的还原性
铬钾矾KCr(SO4)2·12H2O是以SO2还原重铬酸钾K2Cr2O7溶液而制得的蓝紫色晶体:
K2Cr2O7 + H2SO4 +3SO2  2KCr(SO4)2 + H2O
2KCr(SO4)2 + H2O
它应用于鞣革工业和纺织工业。
自然界中存在的铬(Ⅲ)盐有铬铁矿Fe(CrO2) 2。把铬铁矿和碳酸钠在空气中煅烧可得铬酸盐,工业上把这种方法叫碱熔法:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
在所得的熔体中,用水可以把铬酸盐浸取出来。
从铬的元素电势图可以看出,在碱性条件下铬(Ⅲ)具有较强的还原性,易被氧化。例如在碱性介质中,Cr3+可被稀的H2O2溶液氧化:
2Cr(OH)4- + 2OH- + 3H2O2  2CrO42- + 8H2O
2CrO42- + 8H2O
(绿色) (黄色)
在酸性条件下铬(Ⅲ)具有较强的稳定性,只有用强氧化剂如过硫酸钾K2S2O8,才能使Cr3+氧化:
2Cr3++3S2O82-+7H2O Δ Cr2O72-+6SO42-+14H+
(2)铬(Ⅵ)的化合物
(2.1)氧化物和含氧酸
浓H2SO4作用于饱和的K2Cr2O7溶液,可析出铬(Ⅵ)的氧化物——三氧化铬CrO3:
K2Cr2O7+H2SO4(浓)  2CrO3↓+K2SO4+H2O
2CrO3↓+K2SO4+H2O
CrO3是暗红色针状晶体。它极易从空气中吸收水分,并且易溶于水,形成铬酸。CrO3在受热超过其熔点(196℃)时,就分解放出氧而变为Cr2O3。CrO3是较强的氧化剂,一些有机物质如酒精等与它接触时即着火,同时CrO3被还原为Cr2O3。CrO3是电镀铬的重要原料。
CrO3与水作用生成铬酸H2CrO4和重铬酸H2Cr2O7。
(2.1.1)铬酸和重铬酸的酸性与缩合性
H2Cr2O4和H2Cr2O7都是强酸,但后者酸性更强些。H2Cr2O7的第一级离解是完全的:
HCr2O7-  Cr2O72- + H+ K2q = 0.85
Cr2O72- + H+ K2q = 0.85
H2CrO4 HCrO4- + H+ K1q = 9.55
HCrO4- + H+ K1q = 9.55
HCrO4-  CrO42- + H+ K2q = 3.2×10-7
CrO42- + H+ K2q = 3.2×10-7
铬酸盐和重铬酸盐CrO42-和Cr2O72-在溶液中存在下列平衡:
2CrO42- + 2H+  2HCrO4-
2HCrO4- Cr2O72- + H2O
Cr2O72- + H2O
(黄色) (橙红色)
在碱性或中性溶液中主要以黄色的CrO42-存在;在pH<2的溶液中,主要以Cr2O72- (橙红色)形式存在。从上述存在的平衡关系就可以理解为什么在Na2CrO4溶液中加入酸就能得到Na2Cr2O7,而在Na2Cr2O7的溶液中加入碱或碳酸钠时,又可以得到Na2CrO4。例如:
2Na2CrO4 + H2SO4 Na2Cr2O7 + H2O + Na2SO4
Na2Cr2O7 + H2O + Na2SO4
Na2Cr2O7 + 2NaOH  2Na2CrO4 + H2O
2Na2CrO4 + H2O
(2.1.2)重铬酸及其盐的氧化性
在碱性介质中,铬(Ⅵ)的氧化能力很差。在酸性介质中它是较强的氧化剂,即使在冷的溶液中,Cr2O72-也能把H2S、H2SO3和HI等物质氧化,在加热的情况下它能氧化HBr和HCl:
Cr2O72- + 3H2S + 8H+ 2Cr3+ + 3S↓+ 7H2O
2Cr3+ + 3S↓+ 7H2O
Cr2O72- + 6Cl- + 14H+ Δ 2Cr3+ + 3Cl2↑+ 7H2O
实验室常用的铬酸洗液就是由浓硫酸和饱和K2Cr2O7溶液配制而成,用于浸洗或润洗一些容量器皿,除去还原性或碱性的污物,特别是有机污物。此洗液可以反复使用,直到洗液发绿才失效。
固体重铬酸铵(NH4)2Cr2O7在加热的情况下,也能发生氧化还原反应:
(NH4)2Cr2O7 Δ Cr2O3 + N2 + 4H2O
实验室常利用这一反应来制取Cr2O3。
(2.1.3)铬酸盐和重铬酸盐的溶解性
一些铬酸盐的溶解度要比重铬酸盐为小。当向铬酸盐溶液中加入Ba2+、Pb2+、Ag+时,可形成难溶于水的BaCrO4(柠檬黄色)、PbCrO4(铬黄色)、Ag2CrO4(砖红色)沉淀。
另外,从铬酸盐和重铬酸盐存在的平衡关系中,下列反应也是可以理解的:
4Ag+ + Cr2O72- + H2O 2Ag2CrO4↓+ 2H+
2Ag2CrO4↓+ 2H+
氧化数为+3和+6的铬在酸碱介质中的相互转化关系可总结如下:
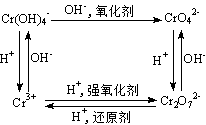
(2.2)铬(Ⅲ)和铬(Ⅵ)的鉴定
在Cr2O72-的溶液中加入H2O2,可生成蓝色的过氧化铬CrO5或写成CrO(O2)2,其结构为:
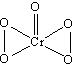
Cr2O72- + 4 H2O2 + 2H+ 2CrO5 + 5H2O
2CrO5 + 5H2O
或2CrO42- + 3H2O2 + 2H+ 2CrO5 + 4H2O
2CrO5 + 4H2O
CrO5很不稳定,很快分解为Cr3+并放出O2。它在乙醚或戊醇溶液中较稳定。这一反应,常用来鉴定CrO42-或Cr2O72-的存在。
以上是铬(Ⅵ)的鉴定,铬(Ⅲ)的鉴定是先把铬(Ⅲ)氧化到铬(Ⅵ)后再鉴定,方法如下:
Cr3+ 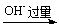 Cr(OH)4-
Cr(OH)4-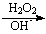 CrO42-
CrO42-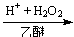 CrO5 (蓝色)
CrO5 (蓝色)
或 Cr3+ 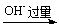 Cr(OH)4-
Cr(OH)4-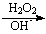 CrO42-
CrO42-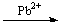 PbCrO4↓(黄色)
PbCrO4↓(黄色)
9.2.3 锰的重要化合物
锰的外形与铁相似,它的主要用途是制造合金,几乎所有的钢中都含有锰。
锰原子的价电子是3d54s2。它也许是迄今氧化态最多的元素,可以形成氧化数由-3到+7的化合物,其中以氧化数+2、+4、+7的化合物较重要。
锰的元素电势图如下:
酸性溶液中EΘA/V
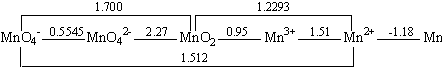
碱性溶液中EΘB/V

(1)锰(Ⅱ)的化合物
(1.1)氧化物和氢氧化物的溶解性与还原性
一氧化锰是绿色粉末,难溶于水,易溶于酸。与MnO相应的水合物Mn(OH)2是从锰(Ⅱ)盐与碱溶液作用而制得的:
Mn2+ + 2OH-  Mn(OH)2↓
Mn(OH)2↓
Mn(OH)2是白色难溶于水的物质。在空气中很快被氧化,而逐渐变成棕色的MnO2的水合物:
Mn(OH)2 Mn2O3 · xH2O
Mn2O3 · xH2O  MnO2 · yH2O
MnO2 · yH2O
(1.2)锰(Ⅱ)盐的稳定性与Mn2+的鉴定
很多锰盐是易溶于水的。从溶液中结晶出来的锰盐是带有结晶水的粉红色晶体。例如,MnCl2·4H2O、MnSO4·7H2O、Mn(NO3)2·6H2O和Mn(ClO4)2·6H2O等。
从锰的元素电势图可以看出,在碱性条件下锰(Ⅱ)具有较强的还原性,易被氧化。在酸性条件下锰(Ⅱ)具有较强的稳定性,只有用强氧化剂如PbO2、NaBiO3、(NH4)2S2O8等才能使Mn2+氧化为MnO4-。例如在HNO3溶液中,Mn2+与NaBiO3反应如下:
2Mn2+ + 5NaBiO3 + 14H+  2MnO4- + 5Bi3+ + 5Na+ + 7H2O
2MnO4- + 5Bi3+ + 5Na+ + 7H2O
这一反应常用来鉴定Mn2+的存在。
(2)锰(Ⅳ)的化合物――二氧化锰的稳定性
二氧化锰是锰(Ⅳ)最稳定的化合物。在自然界中它以软锰矿MnO2·xH2O形式存在。MnO2是制取锰的化合物及金属锰的主要原料,它是不溶于水的黑色固态物质。在空气中加热到530℃时就放出氧:
3MnO2 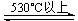 Mn3O4 + O2↑
Mn3O4 + O2↑
MnO2有较强的氧化能力。例如浓盐酸或浓H2SO4与MnO2在加热时按下式进行反应:
MnO2 + 4HCl Δ MnCl2 + 2H2O + Cl2↑
2MnO2 + 2H2SO4 Δ 2MnSO4 + 2H2O + O2↑
MnO2中锰处于中间氧化数,它既能被还原为锰(Ⅱ),也可以被氧化为锰(Ⅵ)(在碱性条件下)。例如,把MnO2和KOH或K2CO3在空气中加热共熔,便得到可溶于水的绿色熔体。把熔体溶于水后,可从其中析出暗绿色的锰酸钾K2MnO4晶体。这被称为碱熔法。生成K2MnO4的反应式为:
2MnO2 + 4KOH + O2 共熔 2K2MnO4 + H2O
反应中的氧可以用KClO3或KNO3等氧化剂来代替:
3MnO2 + 6KOH + KClO3 共熔 3K2MnO4 + KCl + 3H2O
(3)锰(Ⅵ)的化合物
锰(Ⅵ)的化合物中,比较稳定的是锰酸盐,如锰酸钾K2MnO4,它由MnO2和KOH在空气中加热而制得。锰酸及其氧化物MnO3都是极不稳定的化合物,因此尚未被分离出来。锰酸盐溶于水后,只有在碱性(pH>13.5)溶液中才是稳定的,在这种条件下,MnO42-的绿色可以较长时间保持不变。相反地,在中性或酸性溶液中,绿色的MnO42-瞬间歧化生成紫色的MnO4-和棕色的MnO2沉淀:
3MnO42- + 4H+  MnO2↓+ 2MnO4- + 2H2O
MnO2↓+ 2MnO4- + 2H2O
当以氧化剂(如氯气)作用于锰酸盐的溶液时,锰酸盐可以变为高锰酸盐:
2MnO42- +Cl2 2MnO4- + 2Cl-
2MnO4- + 2Cl-
(4)锰(Ⅶ)的化合物
锰(Ⅶ)的化合物中,高锰酸盐是最稳定的。应用最广的高锰酸盐是高锰酸钾KMnO4。高锰酸HMnO4只能存在于稀溶液中,当浓缩其溶液超过20%时,即分解生成MnO2和O2。高锰酸也是强酸之一。
(4.1)高锰酸钾的氧化性及其还原产物
高锰酸钾是暗紫色晶体,它的溶液呈现出MnO4-特有的紫色。KMnO4固体加热至200℃以上时按下式分解:
2 KMnO4 Δ K2MnO4 + MnO2 + O2↑
在实验室中有时也利用这一反应制取少量的氧。
KMnO4是最重要和常用的氧化剂之一。它不仅具有较强的氧化能力,能将还原性物质氧化,而且同一元素的较高和较低氧化数的化合物也能发生氧化还原反应,得到介乎中间氧化数的化合物。例如MnO4-与Mn2+在酸性介质中生成MnO2:
2MnO4- + 3 Mn2+ + 2H2O  5MnO2↓+ 4H+
5MnO2↓+ 4H+
它作为氧化剂而被还原的产物,因介质的酸碱性不同而不同。例如,以亚硫酸盐作还原剂,在酸性介质中,其反应如下:
2MnO4- + 6H+ + 5SO32-  2Mn2+ + 5SO42- + 3H2O
2Mn2+ + 5SO42- + 3H2O
若以H2S作还原剂,MnO4-可把H2S氧化成S,还可进一步把S氧化为SO42-:
2MnO4- + 5H2S + 6H+  2Mn2+ + 5S + 8H2O
2Mn2+ + 5S + 8H2O
6MnO4- + 5S + 8H+  6Mn2+ + 5SO42- + 4H2O
6Mn2+ + 5SO42- + 4H2O
在中性介质中:
2MnO4- + H2O + 3SO32- 2MnO2↓+ 3SO42- + 2OH-
2MnO2↓+ 3SO42- + 2OH-
在较浓碱溶液中:
2MnO4- + 2OH- + SO32- 2MnO42- + SO42- + H2O
2MnO42- + SO42- + H2O
还原产物还会因氧化剂与还原剂相对量的不同而不同。例如MnO4- 与 SO32-在酸性条件下的反应,若SO32-过量,MnO4- 的还原产物为Mn2+;若MnO4- 过量,则最终的还原产物为MnO2。
(4.2)高锰酸钾溶液的稳定性
在KMnO4溶液中,若有少量酸存在,则MnO4-按下式进行缓慢的分解:
4MnO4- + 4H+  4MnO2↓+ 3O2↑+ 2 H2O
4MnO2↓+ 3O2↑+ 2 H2O
在中性或碱性介质中也会分解,而且Mn2+的存在,以及分解产物MnO2、光照等还会促进分解。所以MnO4-长期放置也会缓慢地发生上述反应。这一反应也说明HMnO4是不稳定的酸。
在浓碱溶液中,MnO4-能被OH-还原为绿色的MnO42-,并放出O2:
4MnO4- + 4OH-  4MnO42- + O2↑+ 2 H2O
4MnO42- + O2↑+ 2 H2O
前面提到的用碱熔法仅能把MnO2氧化为MnO42-,却不能直接把MnO2氧化为MnO4-,其原因就是MnO4-在强碱中不稳定。
9.2.4 铁、钴、镍的重要化合物
铁、钴和镍原子最外层电子都是4s2,次外层3d电子分别是3d6、3d7、和3d8。它们的氧化数常见的是+2和+3。铁、钴和镍的性质比较相近,通常把这三个元素称作铁系元素。
从单质来看,铁、钴、镍都表现出磁性。活泼性中等。它们在冷的浓硝酸中都会变成钝态。处于钝态的铁、钴、镍一般不再溶于稀硝酸中。另外,铁、钴、镍都不易与碱作用,但铁能被热的浓碱所侵蚀,而钴和镍在碱性溶液中稳定性比铁高,故熔碱时最好使用镍坩埚。
(1)铁、钴、镍的氧化物和氢氧化物
(1.1)氧化物的基本性质与制备
黑色的FeO、灰绿色的CoO和绿色的NiO均是难溶于水的碱性氧化物。它们可由铁、钴和镍的相应草酸盐在隔绝空气的条件下加热制得。例如,草酸亚铁受热制取FeO的反应式为:
FeC2O4 FeO + CO↑+ CO2↑
FeO + CO↑+ CO2↑
红棕色的Fe2O3、暗褐色的Co2O3以及灰黑色的Ni2O3则是难溶于水的两性偏碱的氧化物。实验室中,常将氢氧化铁Fe(OH)3加热脱水而制得较纯的Fe2O3。小心加热Co(NO3)2和Ni(NO3)2,可制得Co2O3和Ni2O3。
铁还能形成所谓+2和+3的混合氧化物,如四氧化三铁Fe3O4,可看作是FeO和Fe2O3的混合氧化物FeO·Fe2O3。经X射线研究证明,Fe3O4是一种铁(Ⅲ)酸盐,即FeⅡ[FeⅢ2O4]。它是具有磁性的化合物。钴、镍也有类似的氧化物,如Co3O4和Ni3O4。
(1.2) Co2O3和Ni2O3的氧化性
氧化数为+3的钴和镍的氧化物,在酸性溶液中具有强氧化性,相对次序后者更强,例如Co2O3与浓HCl作用放出Cl2:
Co2O3 + 6HCl 2CoCl2 + Cl2↑+ 3H2O
2CoCl2 + Cl2↑+ 3H2O
(1.3)氢氧化物的氧化还原性与制备
白色的Fe(OH)2、粉红色的Co(OH)2(Co(OH)2初生时为蓝色,放置或加热后转变为粉红色)和苹果绿的Ni(OH)2溶解性、酸碱性与相应氧化数氧化物的相似。Fe(OH)2、Co(OH)2和Ni(OH)2都可由强碱作用于+2氧化数的铁、钴和镍盐溶液而制得。
Fe(OH)2从溶液中析出时,除非完全清除掉溶液中的氧,否则往往得不到纯的Fe(OH)2,因为Fe(OH)2强烈地吸收空气中的氧,迅速被氧化为土绿色到暗棕色的中间产物(即有部分+2氧化数的铁被氧化为+3氧化数);若有足够氧气存在时,最终全部被氧化为Fe(OH)3:
4Fe(OH)2 + O2 + 2H2O  4Fe(OH)3
4Fe(OH)3
而Co(OH)2则比较缓慢地被空气氧化为Co(OH)3。Ni(OH)2在空气中很稳定,只有在强氧化剂(如NaOCl)存在时,才能把Ni(OH)2氧化为Ni(OH)3。
红棕色的Fe(OH)3、褐棕色的Co(OH)3以及黑色的Ni(OH)3的基本性质同样与相应氧化数氧化物的相似。强碱作用于+3氧化数的铁盐溶液,析出Fe(OH)3沉淀,其组成为Fe2O3·H2O,通常把它写成Fe(OH)3或FeO(OH)。钴、镍的氢氧化物也有类似组成。Fe(OH)3在热的浓的强碱溶液中,能显著地溶解,生成铁酸盐(如NaFeO2或Na3[Fe(OH)6])。Co(OH)3与过量强碱作用能生成六羟基合钴(Ⅲ)酸盐(如K[Co(OH)6])。
氧化数为+3的氢氧化物与酸的作用,表现出不同的性质。例如Fe(OH)3与盐酸仅发生中和反应:
Fe(OH)3 + 3HCl  FeCl3 + 3H2O
FeCl3 + 3H2O
而Co(OH)3与盐酸作用,能把Cl-氧化为氯气:
2Co(OH)3 + 6HCl  2CoCl2 + Cl2↑+ 6H2O
2CoCl2 + Cl2↑+ 6H2O
Ni(OH)3的氧化性更强,也能把盐酸氧化为Cl2。
(2)铁、钴、镍的盐类
(2.1)铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的盐
(2.1.1)基本性质
铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的盐类有许多相似的地方。例如它们的硫酸盐、硝酸盐和氯化物都易溶于水。从溶液中结晶出来时,常带有相同数目的结晶水。例如:
FeSO4·7 H2O Fe(NO3)2·6 H2O FeCl2·6 H2O
CoSO4·7 H2O Co(NO3)2·6 H2O CoCl2·6 H2O
NiSO4·7 H2O Ni(NO3)2·6 H2O NiCl2·6H2O
这些盐类都带有颜色,因为它们的水合离子都带有颜色,如淡绿色的Fe(H2O)62+、粉红色的Co(H2O)62+和绿色的Ni(H2O)62+。从溶液中结晶出来时,水合离子中的水成为结晶水共同析出,所以上述铁(Ⅱ)盐都带淡绿色,钴(Ⅱ)盐带粉红色、镍(Ⅱ)盐带绿色。
铁、钴和镍的硫酸盐都能与碱金属或铵的硫酸盐形成复盐。如硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O,俗称摩尔盐,是分析化学中K2Cr2O7法或KMnO4法的还原剂之一,其中的Fe(Ⅱ)具有相对强的稳定性。硫酸亚铁的水合晶体又称绿矾,在空气中逐渐风化,同时表面氧化为黄褐色的铁(Ⅲ)的碱式硫酸盐。FeSO4可用铁屑与稀H2SO4作用制得。它用于保护木材,制蓝黑墨水,防止害虫等。NiSO4是工业上电镀镍的原料。
(2.1.2)Fe2+、Co2+、Ni2+的还原性
Fe2+、Co2+、Ni2+的还原性按Fe2+>Co2+>Ni2+的顺序减弱。如Fe(OH)2易被空气中的氧氧化成Fe(OH)3,FeSO4溶液同样易被氧化成Fe2(SO4)3,为防止FeSO4溶液变质,通常放入铁钉。
(2.1.3)氯化钴的结晶水与颜色
氯化钴有三种主要水合物,它们的相互转变温度及特征颜色如下:
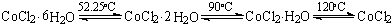
(粉红) (紫红) (蓝紫) (蓝色)
无水二氯化钴溶于冷水中呈粉红色。做干燥剂用的硅胶常浸有二氯化钴的水溶液,利用氯化钴因吸水和脱水而发生的颜色变化,来表示硅胶吸湿情况。在升高温度时,硅胶失水由粉红色变为蓝紫色或蓝色;当硅胶吸水后,逐渐变为粉红色。
(2.1.4)其他性质
NiCl2与CoCl2有相同的晶形,但NiCl2在乙醚或丙酮中的溶解度比CoCl2小得多,利用这一性质可以分离钴和镍。氧化数为+2的铁、钴和镍的碳酸盐和硫化物都是难溶于水的。刚从溶液中析出的CoS和NiS易溶于稀酸中,静置后转变为另一种变体,就不易溶于稀酸了。
(2.2)铁(Ⅲ)、钴(Ⅲ)、镍(Ⅲ)的盐
(2.2.1)稳定性
钴(Ⅲ)和镍(Ⅲ)的盐都很不稳定,故很少。这是因为它们的离子氧化性不同而造成的。
Fe3+ + e  Fe2+ Eq=0.771V
Fe2+ Eq=0.771V
Co3+ + e  Co2+ Eq=1.84V
Co2+ Eq=1.84V
Ni3+ + e  Ni2+ Eq>1.84V
Ni2+ Eq>1.84V
由它们的Eq值可以看出,氧化数为+3的离子的氧化性按Fe3+-Co3+-Ni3+的顺序增强。当Fe3+、Co3+、Ni3+分别与负离子结合时,夺取负离子的电子被还原为+2价离子的趋势也按Fe3+-Co3+-Ni3+的顺序增强,生成氧化数为+3的盐的氧化还原稳定性则按这一顺序而降低。例如它们的硫酸盐已知有Fe2(SO4)3·9H2O和Co2 (SO4)3·18H2O。Fe2 (SO4)3·9H2O是很稳定的铁盐,而Co2 (SO4)3·18H2O不仅在溶液中不稳定,在固体状态时也很不稳定,分解成钴(Ⅱ)的硫酸盐和氧。可以推想,镍(Ⅲ)的硫酸盐更不稳定,这是因为Ni3+的氧化性更强的缘故。
(2.2.2)FeCl3的氧化性与水解性
FeCl3常作氧化剂应用在有机合成和刻蚀某些金属方面。例如,工业上常应用FeCl3的酸性溶液在铁制部件上刻蚀字样,反应式为:
2Fe3+ + Fe  3Fe2+
3Fe2+
这一反应的平衡常数根据公式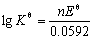 计算得:
计算得:
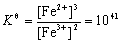
可见此反应向右进行的程度是很大的。同理在Fe2+的溶液中加入金属铁,可防止Fe2+被氧化为Fe3+。
在无线电工业上,常利用FeCl3的溶液来刻蚀铜,制造印刷线路。其反应式为:
2Fe3+ + Cu  2Fe2+ + Cu2+ Kq = 1014.7
2Fe2+ + Cu2+ Kq = 1014.7
铜板上需要去掉的部分,在FeCl3溶液的作用下,变为Cu2+而溶解掉。
由于Fe3+比Fe2+的电荷多,半径小,因而在水溶液中Fe3+比Fe2+容易发生离解,它们的第一级离解常数分别如下:
[Fe(H2O)6]3+ [Fe(OH)(H2O)5]2+ + H+ Kq= 10-3.05
[Fe(OH)(H2O)5]2+ + H+ Kq= 10-3.05
[Fe(H2O)6]2+ [Fe(OH)(H2O)5]+ + H+ Kq= 10-9.5
[Fe(OH)(H2O)5]+ + H+ Kq= 10-9.5
Fe3+还可以发生下列离解反应:
[Fe(OH)(H2O)5]2+  [Fe(OH)2(H2O)4]+ + H+ Kq= 10-3.26
[Fe(OH)2(H2O)4]+ + H+ Kq= 10-3.26
在较浓的Fe3+溶液(1mol·L-1)中,离解所形成的碱式离子可缩聚为二聚离子(双核配离子)
2[Fe(H2O)6]3+ [(H2O)4Fe(OH)2Fe(H2O)4]4+ + 2H+ + 2H2O Kq= 10-2.91
[(H2O)4Fe(OH)2Fe(H2O)4]4+ + 2H+ + 2H2O Kq= 10-2.91
在Fe3+的稀溶液(10-4mol·L-1左右)中,其离解产物主要是[Fe(OH)(H2O)5]2+和[Fe(OH)2(H2O)4]+。通常把Fe3+的离解产物写成Fe(OH)3只是一种近似的写法。
由于Fe3+水解程度大,[Fe(H2O)6]3+仅能存在于酸性较强的溶液中,稀释溶液或增大溶液的pH,会有胶状物沉淀出来,此胶状物的组成是FeO(OH),通常也写作Fe(OH)3,而使溶液呈黄色或棕红色。FeCl3的净水作用,就是由于Fe3+离解产生FeO(OH)后,与水中悬浮的泥土等杂质一起聚沉下来,使混浊的水变清。
在其他方面,FeCl3是共价键占优势的化合物,它的蒸气含有双聚分子Fe2Cl6,其结构为:
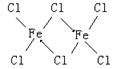
氧化数高于+3的铁系元素的盐类,已经制得的有高铁酸钾K2FeO4和高钴酸钾K3CoO4。它们在酸性溶液中都是很强的氧化剂。
(3)铁、钴和镍的配合物
(3.1)与卤素离子形成的配合物以及Fe3+的掩蔽
Fe2+、Co2+和Ni2+在水溶液中与卤素离子形成的配合物都不太稳定。例如:
Co(H2O)62+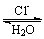 CoCl42-
CoCl42-
Fe3+和Co3+却能与F-形成稳定的配合物,如K3[FeF6]和K3[CoF6]。它们都属外轨型的配合物。由于FeF63-比较稳定(稳定常数约为1014),在分析化学上常在含有Fe3+的混合溶液中,加入NaF使Fe3+形成FeF63-,把Fe3+掩蔽起来,从而消除Fe3+的干扰。
(3.2)与NH3形成的配合物以及Co2+和Co3+的稳定性
Fe2+、Co2+和Ni2+与氨形成配合物的稳定性按Fe2+-Co2+-Ni2+的顺序增强。但Fe2+难以在水溶液中形成稳定的氨合物。在无水状态下FeCl2可与NH3形成[Fe(NH3)6]Cl2,遇水则按下式分解:
[Fe(NH3)6]Cl2 + 6H2O  Fe(OH)2↓ + 4NH3·H2O + 2NH4Cl
Fe(OH)2↓ + 4NH3·H2O + 2NH4Cl
对Co2+,Ni2+来说,这种分解倾向较小。在过量氨存在的溶液中,Co2+能与NH3形成较稳定的[Co(NH3)6]2+ (稳定常数为104.39),但易被O2氧化为[Co(NH3)6]3+。Ni2+可形成[Ni(NH3)4]2+和[Ni(NH3)6]2+(前者稳定常数为107.47,后者稳定常数为108.01),反应如下:
CoCl2 + 6NH3 [Co(NH3)6]2+(土黄色) + 2Cl-
[Co(NH3)6]2+(土黄色) + 2Cl-
NiCl2 + 6NH3(过量) [Ni(NH3)6]2+(蓝色) + 2Cl-
[Ni(NH3)6]2+(蓝色) + 2Cl-
Co3+的配合物都是配位数为6的。Co3+在水溶液中不能稳定存在,难以与配位体直接形成配合物,通常把Co(Ⅱ)盐溶在有配合剂的溶液中,借氧化剂把Co(Ⅱ)氧化,从而制出
Co(Ⅲ)的配合物。例如:
4Co2+ + 24NH3 + O2 + 2H2O 4[Co(NH3)6]3+ + 4OH-
4[Co(NH3)6]3+ + 4OH-
红棕色
又如:
[Co(NH3)6]2+ + H2O2 + 2H+  [Co(NH3)6]3+ + 2H2O
[Co(NH3)6]3+ + 2H2O
土黄色 红棕色
4CoCl2 + 4NH4Cl + 20NH3 + O2 4[Co(NH3)6]Cl3 + 2H2O
4[Co(NH3)6]Cl3 + 2H2O
Co3+形成配合物后,在溶液中则是稳定的。Ni(Ⅲ)的配合物比较少见,且是不稳定的。
对Fe3+来说,由于其水合离子发生强烈的水解,所以在水溶液中加入氨时,不是形成氨合物,而是形成Fe(OH)3沉淀。
(3.3)与NCS-形成的配合物以及Fe3+、Co2+的鉴定
Fe2+、Cu2+和Ni2+与NCS-形成的配合物有配位数4和6两类。但它们在水溶液中都不太稳定。在水溶液中不太稳定的蓝色配离子[Co(NCS)4]2-能较稳定地存在于乙醚、戊醇或丙酮中。在鉴定Co2+时常利用这一特性。Fe3+与NCS-形成组成为[Fe(NCS)n]3-n(n=1,2,3,4,5,6)的红色配合物。从结合1个NCS-的[Fe(NCS)(H2O)5]2+到结合6个NCS-的[Fe(NCS)6]3-都呈红色。这一反应非常灵敏,它是鉴定Fe3+是否存在的重要反应之一。
上述Co3+和Fe3+的鉴定反应分别为:
Co2+ + 4NCS-(过量)  Co(NCS)42-
Co(NCS)42-
蓝色
Fe3+ + 6NCS- Fe(NCS)63-
Fe(NCS)63-
血红色
(3.4)与CN-形成的配合物以及Fe3+、Fe2+、Ni2+以及S2-、SO32-的鉴定
CN-与Fe3+、Fe2+、Co2+、Ni2+都能形成配位数为6或4的配合物。这些配合物都是内轨型配合物,在溶液中都很稳定。
黄色晶体K4[Fe(CN)6]·3H2O,工业名称叫黄血盐。Fe3+不能与KCN直接生成K3[Fe(CN)6]。它是由氯气氧化K4[Fe(CN)6]的溶液而制得:
6K4[Fe(CN)6]+ Cl2 2KCl + 2K3[Fe(CN)6]
2KCl + 2K3[Fe(CN)6]
K3[Fe(CN)6]是褐红色晶体,工业名称叫赤血盐。[Fe(CN)6]3-的氧化性不如Fe3+强,其Eq值如下:
[Fe(CN)6]3- + e  [Fe(CN)6]4- Eq=0.36V
[Fe(CN)6]4- Eq=0.36V
Fe3+ + e  Fe2+ Eq=0.77V
Fe2+ Eq=0.77V
[Fe(CN)6]3-和[Fe(CN)6]4-在溶液中十分稳定,因此在含有[Fe(CN)6]3-和[Fe(CN)6]4-的溶液中几乎检查不出离解的Fe3+和Fe2+。但[Fe(CN)6]4-遇到Fe3+立即产生蓝色沉淀,这种沉淀俗称普鲁士蓝,其反应式为:
4 Fe3+ + 3[Fe(CN)6]4-  Fe4[Fe(CN)6]3↓
Fe4[Fe(CN)6]3↓
这一反应也是检查溶液中是否存在Fe3+的灵敏反应。
[Fe(CN)6]3-与Fe2+在溶液中也产生蓝色沉淀,这种沉淀俗称滕氏蓝,其反应式为:
3 Fe2+ + 2[Fe(CN)6]3- Fe3[Fe(CN)6]2↓
Fe3[Fe(CN)6]2↓
这一反应也是检查溶液中是否存在Fe2+的灵敏反应。
近年来已经查明,普鲁士蓝和滕氏蓝的结构都是Fe4Ⅲ[FeⅡ(CN)6]3。
Fe3+与[Fe(CN)6]3-在溶液中不生成沉淀,但溶液变成暗棕色。Fe2+与[Fe(CN)6]4-作用则生成白色的Fe2[Fe(CN)6]沉淀。由于Fe2+易被空气氧化,所以最后也形成普鲁士蓝。
在铁的氰合物中,还有许多配合物只有五个CN-离子,另外再结合一个别的离子(如NO2-、SO32-)或中性分子(NO、CO、NH3、H2O)。其中比较重要的是Na2[Fe(CN)5NOS]。它与S2-(但不与HS-)作用生成Na2[Fe(CN)5NOS]而显特殊的红紫色。它与ZnSO4及K4[Fe(CN)6]的混合液,遇到SO32-则生成红色沉淀。因此它被用来检查溶液中是否有S2-、SO32-的存在。
Ni2+的平面正方形配合物,除了[Ni(CN)4]2-外还有二丁二肟合镍(Ⅱ),后者为鲜红色沉淀,可用于定性鉴定Ni2+。
9.3 ds区元素
ds区元素(ds Block Elements)包括铜族元素的铜(Copper)、银(Silver)、金(Gold)和锌族元素的锌(Zinc)、镉(Cadmium)、汞(Mercury)。这两族元素原子的价电子层构型分别为(n-1)d10ns1和(n-1)d10ns2。
9.3.1 通性
铜族和锌族元素的次外层都是18电子结构,所以当它们分别形成与族数相同的氧化数的化合物时,相应的离子都是18电子构型,所以这两族的离子都有强的极化力,这就使它们的二元化合物一般都部分地或完全地带有共价性。
这两族元素与其他过渡元素类似,易形成配合物,但由于ⅡB族元素的离子M2+d轨道已填满,电子不能发生d-d跃迁,因此它们的配合物一般无色。
9.3.2 铜族元素
(1)单质及其化学活泼性
作为单质来说,在所有的金属中,银的导电性最好。铜次之,因而在电器中广泛采用铜作为导电材料,要求高的场合,如触点、电极等可采用银。另外,铜、银之间以及铂、锌、锡、钯等其他金属之间很容易形成合金。如铜合金中的黄铜(含锌)、青铜(含锡)、白铜(含镍)等。
铜、银、金的化学活泼性较差,室温下看不出它们能与氧或水作用,但是,若反应能产生难溶物质或配离子,则就能与O2发生反应。例如在含有CO2的潮湿空气中,铜的表面会逐渐蒙上绿色的铜锈(俗称铜绿)——碱式碳酸铜Cu2(OH)2CO3:
2Cu + O2 + H2O + CO2 Cu2(OH)2CO3
Cu2(OH)2CO3
再如在有H2S的环境中:
4Ag + O2 + 2H2S  2AgS(黑色) + 2H2O
2AgS(黑色) + 2H2O
(2)铜族元素的化合物
铜族元素+1氧化数的离子都是无色的,而高氧化态的离子由于次外层未充满而都是有颜色的(Cu2+蓝色、Au3+红黄色)。
(2.1)溶解性与酸碱性
Cu+为18电子构型,具有较强的极化力,因此几乎所有Cu(Ⅰ)的化合物都难溶于水,而Cu(Ⅱ)的化合物则易溶于水的较多。
水合铜离子[Cu(H2O)6]2+呈蓝色。在Cu2+的溶液中加入适量的碱,析出浅蓝色氢氧化铜Cu(OH)2沉淀。加热Cu(OH)2悬浮液到接近沸腾时分解出CuO:
Cu2+ + 2OH- Cu(OH)2↓
Cu(OH)2↓ CuO↓+ H2O
CuO↓+ H2O
这一反应常用来制取CuO。
Cu(OH)2能溶于过量浓碱溶液中,生成四羟基合铜(Ⅱ)离子[Cu(OH)4]2-:
Cu(OH)2 + 2OH- Cu(OH)42-
Cu(OH)42-
银的许多化合物都是难溶于水的。卤化银的溶解度按AgCl-AgBr-AgI顺序减小。Ag+同样有较强的极化作用,极化率从Cl-到I-依次增大,从离子极化观点来看,相互的极化作用依次增强,逐步变为共价键占优势的AgI,从而使它们在水中的溶解度逐步减小。Ag+为d10构型,它的化合物一般呈白色或无色,但AgBr呈淡黄色,AgI呈黄色,这与卤素负离子和Ag+之间发生的电荷迁移有关。易溶于水的Ag(Ⅰ)化合物有:高氯酸银AgClO4、氟化银AgF,氟硼酸银AgBF4和硝酸银AgNO3等。其他Ag(Ⅰ)的一般化合物(不包括配盐)几乎都是难溶于水的。
(2.2)稳定性与光敏性
一般说来,在固态时,Cu(Ⅰ)的化合物比Cu(Ⅱ)的化合物热稳定性高。例如,Cu2O受热到1800℃时分解,而CuO在1100℃时分解为Cu2O和O2;无水CuCl2强热时分解为CuCl。在水溶液中Cu(Ⅰ)容易被氧化为Cu(Ⅱ),即水溶液中Cu(Ⅱ)的化合物是稳定的。
银的化合物相对来说更不稳定。Ag(Ⅰ)的许多化合物加热到不太高的温度时就会发生分解,例如:
2Ag2O 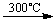 4Ag + O2↑
4Ag + O2↑
2AgCN 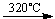 2Ag + (CN)2↑
2Ag + (CN)2↑
2 AgNO3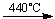 2 Ag + NO2↑+ O2↑
2 Ag + NO2↑+ O2↑
许多Ag(Ⅰ)化合物对光是敏感的。例如AgCl、AgBr、AgI见光都按下式分解:
AgX  Ag + 1/2X2
Ag + 1/2X2
X代表Cl、Br、I。照相工业上常用AgBr制造照相底片或印相纸等。
(2.3)其他较为典型的性质与鉴定
(2.3.1)Cu2O与氧的作用
若有O2存在,适当加热Cu2O能生成黑色的CuO。人们利用Cu2O的这一性质来除去氮气中微量的氧:
2Cu2O + O2 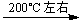 4CuO
4CuO
暗红色粉末状的Cu2O可以用氢气还原CuO得到:
2CuO + H2 Cu2O + H2O↑
Cu2O + H2O↑
而CuO只要加热Cu(OH)2或碱式碳酸铜Cu2(OH)2CO3就能获得:
Cu2(OH)2CO3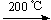 2CuO + CO2 ↑ + H2O↑
2CuO + CO2 ↑ + H2O↑
(2.3.2)无水CuSO4的吸水性
无水CuSO4易吸水,吸水后呈蓝色,常被用来鉴定液态有机物中的微量水。
(2.3.3)AgNO3的氧化性
AgNO3为一种强氧化剂,可被有机物还原为黑色的Ag,也可被Zn、Cu等金属还原为Ag:
2 AgNO3+Cu ==2Ag↓+Cu(NO3)2
此外,AgNO3可使蛋白质凝固成黑色的蛋白银,故对皮肤有腐蚀作用。10%的稀AgNO3溶液在医药上可作为杀菌剂。
(2.3.4)Cu2+的鉴定
在近中性溶液中,Cu2+与[Fe(CN)6]4-反应,生成Cu2[Fe(CN)6]红棕色沉淀:
2Cu2+ + [Fe(CN)6]4- Cu2[Fe(CN)6]↓
Cu2[Fe(CN)6]↓
这一反应常用来鉴定微量Cu2+的存在。
,(2)铜(Ⅰ)和铜(Ⅱ)之间的相互转化
从铜的电势图看出:Eq (Cu+/Cu)>Eq (Cu2+/Cu+)。
Cu2+ 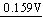 Cu+
Cu+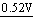 Cu
Cu
所以Cu+在溶液中能自动歧化为Cu2+和Cu:
2Cu+ = Cu2+ + Cu Kq = 106.12
由它的平衡常数值得知,室温下Cu+在水溶液中歧化反应的程度较大,故Cu+在水溶液中不稳定。当Cu+形成配合物后,它能较稳定地存在于溶液中。例如[CuCl2]-就不容易歧化为Cu2+和Cu。其相应的电势如下:
Cu2+ 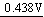 CuCl2-
CuCl2-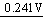 Cu
Cu
Eq( CuCl2-/Cu)<Eq(Cu2+/CuCl2-),所以[CuCl2]-在溶液中是较稳定的。例如:
Cu2+ + Cu + 2Cl- Δ 2CuCl↓白色
若Cl-过量: CuCl(s) + Cl-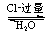 [CuCl2]-(泥黄色)
[CuCl2]-(泥黄色)
即: Cu2+ + Cu + 4Cl-(浓) Δ 2 [CuCl2]-
常利用CuSO4或CuCl2的溶液与浓HCl和Cu屑混合,在加热的情况下,来制取[CuCl2]-的溶液:
CuSO4 + 4HCl + Cu  2H[CuCl2] + H2SO4
2H[CuCl2] + H2SO4
将制得的溶液,倒入大量水中稀释时,会有白色氯化亚铜CuCl沉淀析出:
[CuCl2]- CuCl(s) + Cl-
CuCl(s) + Cl-
工业上或实验室中常用这种办法来制造氯化亚铜。
从下面的电势图看出,CuCl也不容易歧化为Cu2+和Cu。
Cu2+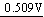 CuCl
CuCl 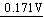 Cu
Cu
CuCl在水中可被空气中的氧所氧化,逐渐变为Cu(Ⅱ)的盐。干燥状态的CuCl则比较稳定。
因此,若要使溶液中的Cu(Ⅱ)转变为Cu(Ⅰ)并稳定存在,不仅需要还原剂,同时要使Cu+形成难解离的物质,降低溶液中Cu+的浓度。
(3)铜族元素的配合物
(3.1)Cu(Ⅰ)的配合物
Cu+它与下述离子或分子都能形成稳定的配合物,其稳定性接下列顺序增强:
Cl-<Br-<I-<SCN-<NH3<S2O32-<CS(NH2)2<CN-
例如上述提到CuCl在过量的Cl-溶液中形成的泥黄色的[CuCl2]-。当向[CuCl2]-溶液中加水稀释时又会产生CuCl白色沉淀。
Cu(Ⅰ)的配合物常用它的难溶盐与具有相同负离子的其他易溶盐(或酸),在溶液中借加合反应而形成。例如,CuCN溶于NaCN溶液中生成易溶的Na[Cu(CN)2],其反应式为:
CuCN(s) + CN- [Cu(CN)2]-
[Cu(CN)2]-
这类反应能否进行,取决于难溶盐的溶度积和配合物的稳定常数的大小,还与易溶盐的浓度有关。由CuCN生成[Cu(CN)2]-的反应,其平衡常数表示式为:

可见反应向右进行的程度较大。在Cu(Ⅰ)的配合物中,Cu(Ⅰ)的配位数常见的是2,当配位体的浓度增大时,也可形成配位数为3或4的配合物,如[Cu(CN)3]2-(β3=1028.59)和[Cu(CN)4]3-(β4=1030.30)。
(3.2)Cu(Ⅱ)的配合物
在Cu2+的配合物中,[CuCl4]2-稳定性较差(β4=10-4.6),在很浓的Cl-溶液才有黄色的[CuCl4]2-存在。当加水稀释时,[CuCl4]2-容易离解为[Cu(H2O)6]2+和Cl-,溶液的颜色由黄变绿(是[CuCl4]2-和[Cu(H2O)6]2+的混合色),最后变为蓝色的[Cu(H2O)6]2+。
在Cu2+的简单配合物中,深蓝色的[Cu(NH3)4]2+较稳定,它是平面正方形的配离子,常以[Cu(NH3)4]2+的颜色来鉴定Cu2+的存在。
当在非氧化性酸中,有适当的配位剂时,Cu有时能从此溶液中置换出氢气。例如Cu能在溶有硫脲CS(NH2)2的盐酸中置换出氢气:
2Cu + 2HCl + 4CS(NH2)2 2[Cu(CS(NH2)2)2]+ + H2↑+ 2Cl-
2[Cu(CS(NH2)2)2]+ + H2↑+ 2Cl-
这是由于硫脲能与Cu+生成二硫脲合铜(Ⅰ)离子[Cu(CS(NH2)2)2]+,使Cu增强了失去电子的能力。在空气存在的情况下,Cu、Ag、Au都能溶于氰化钾或氰化钠的溶液中:
4M + O2 +2H2O + 8CN- 4[M(CN)2]- + 4OH-
4[M(CN)2]- + 4OH-
M代表Cu、Ag、Au。这种现象也是由于它们的离子能与CN-形成配合物,使它们单质的还原性增强,以致空气中的氧能把它们氧化。上述反应常用于从矿石中提取Ag和Au。
在合成氨工厂中不能用铜作阀门或管道,这是因为有如下反应:
2Cu + 8NH3 + 2H2O + O2 2[Cu(NH3)4]2+ + 4OH-
2[Cu(NH3)4]2+ + 4OH-
这里铜所以被腐蚀,也基于以上道理,因为Cu2+与NH3能形成配合物,使铜单质的还原性增强,以致能把铜氧化。
(3.3)Ag(Ⅰ)的配合物
水合银离子一般认为是[Ag(H2O)4]+,它在水中几乎不水解,AgNO3的水溶液呈中性反应。向Ag+溶液中加入NaOH溶液,则析出Ag2O沉淀,因为AgOH极不稳定。
2Ag+ + 2OH- Ag2O↓+ H2O
Ag2O↓+ H2O
从电对Ag+/Ag的Eq=0.799V来看,Ag+的氧化性不算弱,但在Ag+溶液中加入I-时,Ag+却不能把I-氧化为I2,而是发生下列反应:
Ag+ + I- AgI↓
AgI↓
这是由于Ag+与I-生成AgI沉淀后,降低了溶液中Ag+的浓度,使Ag+/Ag的电极电势大大降低,以致Ag+氧化I-的反应不能发生。同样地,在Ag+溶液中通入H2S,也不会发生氧化还原反应,而是析出Ag2S沉淀。
AgI溶在过量的KI溶液中,可生成AgI2-配离子:
AgI(s) + I- AgI2-
AgI2-
当加水稀释AgI2-溶液时,AgI又重新析出。从反应的平衡常数表示式Kq=[AgI2-]/[I-]来看,当溶液稀释时,[I-]和[AgI2-]同时减少,且比值不变,似乎平衡不会向左移动,即不应有AgI析出。但在AgI的溶液中还存在着下列平衡:
AgI  Ag+ + I-
Ag+ + I-
总的反应为:
AgI2- AgI + I-
AgI + I-  Ag+ + 2I-
Ag+ + 2I-
其平衡常数表示式为:
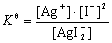
由此可以看出,当溶液稀释时,分子和分母中离子浓度的比值Q减小,即Q<Kq,所以会使平衡向生成I-和Ag+的方向移动。当稀释到一定程度,离解出来的Ag+和I-浓度乘积如果大于AgI的浓度积,就会有AgI沉淀析出。
在水溶液中,Ag+能与多种配位体形成配合物,其配位数一般是2。由于Ag+的许多化合物都是难溶于水的,在Ag+溶液中加入配位剂时,常首先生成难溶化合物。当配位剂过量时,此难溶化合物将形成配离子而溶解。例如,在Ag+的溶液中加入氨水,首先生成难溶于水的Ag2O沉淀:
2Ag+ + 2NH3 + H2O Ag2O↓+ 2NH4+
Ag2O↓+ 2NH4+
溶液中氨水浓度增加时,Ag2O即溶解并生成[Ag(NH3)2]+:
Ag2O(s)↓+ 4NH3 + H2O  2[Ag(NH3)2]+ + 2OH-
2[Ag(NH3)2]+ + 2OH-
含有[Ag(NH3)2]+的溶液能把醛和某些糖类氧化,本身被还原为Ag。例如:
2[Ag(NH3)2]+ + HCHO + 3OH- HCOO- + 2Ag↓+ 4NH3 + 2H2O
HCOO- + 2Ag↓+ 4NH3 + 2H2O
工业上利用这类反应来制镜子或在暖水瓶的夹层上镀银。
再如Ag+与S2O32-作用先产生Ag2S2O3,产物迅速分解,颜色由白色经黄色、棕色,最后成黑色的Ag2S。但若S2O32-过量,则反应最终产生配离子:
2Ag+ +S2O32- = [Ag(S2O3)2]3-
[Ag(S2O3)2]3-也是常见的银的一种配合物,照相底片上未曝光的溴化银在定影液(S2O32-)中形成[Ag(S2O3)2]3-而溶解:
AgBr + 2S2O32- [Ag(S2O3)2]3- + Br-
[Ag(S2O3)2]3- + Br-
Ag(Ⅰ)的许多难溶于水的化合物可以转化为配离子而溶解,常利用这一特性,把Ag+从混合离子溶液中分离出来。例如在含有Ag+和Ba2+的溶液中,若加入过量的K2CrO4溶液时,会有Ag2CrO4和BaCrO4沉淀析出,再加入足量的氨水,Ag2CrO4转化为[Ag(NH3)2]+而溶解:
Ag2CrO4(s) + 4NH3 2[Ag(NH3)2]+ + CrO42-
2[Ag(NH3)2]+ + CrO42-
BaCrO4则不溶于氨水,这样可使混合的Ba2+和Ag+分离。
难溶于水Ag2S的溶解度太小,难以借配位反应使它溶解,通常借助于氧化还原反应使它溶解。例如,用HNO3来氧化Ag2S,发生如下反应:
3 Ag2S(s) + 8 H+ + 2NO3- 6Ag+ + 2NO↑ + 3S↓ + 4H2O
6Ag+ + 2NO↑ + 3S↓ + 4H2O
从而使Ag2S溶解。CuS同样也可借此方法溶解。
9.3.3 锌族元素
锌(Zn)、镉(Cd)、汞(Hg)通常称它们为锌族元素。它们是与p区元素相邻的d区元素,具有与d区元素相似的性质,如易于形成配合物等。在某些性质上它们又与第4、5、6周期的p区金属元素有些相似,如熔点都较低,水合离子都无色等。
Zn、Cd、Hg的原子的价层电子为(n-1)d10ns2型。锌和镉的化合物与汞的化合物相比有许多不同之处,例如,汞除了形成氧化数为+2的化合物外,还有氧化数为+1(Hg22+离子)的化合物,而锌和镉在化合物中通常氧化数为+2。
(1)单质
锌在表面上容易在空气种生成一层致密的碱式碳酸盐ZnCO3·Zn(OH)2而使锌有抗御腐蚀的性质,所以常用锌来镀薄铁板。镉既耐大气腐蚀,又对碱和海水有较好的抗腐蚀性,有良好的延展性,也易于焊接,且能长久保持金属光泽,因此,广泛应用于飞机和船舶零件的防腐镀层。汞是室温下唯一的液态金属,具有挥发性和毒害作用,应特别小心。
锌、镉、汞之间或与其他金属可形成合金。例如汞能溶解金属形成汞齐,如汞和钠的合金(钠汞齐)与水接触时,其中的汞仍保持其惰性,而钠则与水反应放出氢气。不过同纯的金属相比,反应进行的比较平稳。根据此性质,钠汞齐在有机合成中常用作还原剂。
无论在物理性质或化学性质方面,锌、镉都比较相近,而汞较特殊。锌是比较活泼的金属,镉的化学活泼性不如锌,汞的化学性质不活泼。但值得一提的是汞和硫粉很容易形成硫化汞,据此性质,可以在洒落汞的地方撒上硫粉,使汞转化成硫化汞,以消除汞蒸气的毒性。
(2)锌族元素的化合物
(2.1)氧化物与氢氧化物的酸碱性与稳定性
锌、镉形成氧化数为2的化合物,而汞有氧化数为+2和+1的化合物。在氧化数为+1的汞的化合物中,汞以Hg22+ (—Hg—Hg—)形式存在。Hg(Ⅰ)的化合物叫亚汞化合物。绝大多数亚汞的无机化合物都是难溶于水的。Hg(Ⅱ)的化合物中难溶于水的也较多,易溶于水的汞化合物都是有毒的。在汞的化合物中,有许多是以共价键结合的。
ZnO和Zn(OH)2都是两性物质,Cd(OH)2为两性偏碱性。向Zn2+、Cd2+溶液中加入强碱时,分别生成白色的Zn(OH)2和Cd(OH)2沉淀,当碱过量时,Zn(OH)2溶解生成Zn(OH)42-,而Cd(OH)2则难溶解:
Zn2+ + 2OH-  Zn(OH)2↓
Zn(OH)2↓ [Zn(OH)4]2-
[Zn(OH)4]2-
Cd2+ + 2OH-  Cd(OH)2↓
Cd(OH)2↓
向Hg2+、Hg22+的溶液中加入强碱时,分别生成黄色的HgO和棕褐色的Hg2O沉淀,因为Hg(OH)2和Hg2(OH)2都不稳定,生成时立即脱水为氧化物:
Hg2++2OH- HgO↓+H2O
HgO↓+H2O
Hg22++2OH- HgO↓+Hg↓+H2O
HgO↓+Hg↓+H2O
HgO和Hg2O都能溶于热浓硫酸中,但难溶于碱溶液中。
(2.2)HgCl2的制备、结构及其与氨水的作用
HgCl2曾由HgSO4与NaCl固体混合物加热制得:
HgSO4 + 2NaCl Na2SO4 + HgCl2 (g)
Na2SO4 + HgCl2 (g)
此时制出的是HgCl2气体,冷却后变为HgCl2固体。由于HgCl2能升华,故称升汞。HgCl2也可用Hg与Cl2直接作用而制得:
Hg + Cl2 HgCl2
HgCl2
HgCl2有剧毒,是以共价键结合的分子,Hg以sp杂化轨道与Cl结合,空间构型为直线形:
Hg(Ⅱ)的卤化物(HgF2除外)以及Hg(CN) 2和Hg(SCN) 2都是共价型分子,为直线形构型,这点与HgCl2一样。
HgCl2在水溶液中主要以分子形式存在。若HgCl2溶液中加入氨水,生成氨基氯化汞(NH2HgCl)白色沉淀:
HgCl2 + 2NH3 NH2HgCl↓+ NH4Cl
NH2HgCl↓+ NH4Cl
只有在含有过量的NH4Cl的氨水中HgCl2才能与NH3形成配合物:
HgCl2 + 2NH3 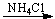 [Hg(NH3)2Cl2]
[Hg(NH3)2Cl2]
(2.3)亚汞盐的歧化与奈斯勒试剂及NH4+的鉴定
许多难溶于水的亚汞盐见光或受热容易歧化成Hg(Ⅱ)的化合物和单质汞(Hg2Cl2例外)。例如,在Hg22+溶液中加入I-时,首先析出难溶的灰绿色的Hg2I2:
Hg22++2 I- Hg2I2↓
Hg2I2↓
Hg2I2见光容易歧化为金红色的HgI2和黑色的单质汞:
Hg2 I2(s) HgI2+Hg
HgI2+Hg
HgI2可溶于过量的KI溶液中,形成[HgI4]2-:
HgI2+2I- [HgI4]2-
[HgI4]2-
HgI42-常用配制奈斯勒(Nessler)试剂,用这种试剂在碱性溶液中来鉴定NH4+。
(2.4)汞的硝酸盐的水解性与Hg2+的氧化性及Hg2+的鉴定
硝酸汞Hg(NO3)2和硝酸亚汞Hg2(NO3)2易溶于水。Hg(NO3)2可用HgO或Hg与HNO3作用制取:
HgO + 2HNO3 Hg(NO3)2 + H2O
Hg(NO3)2 + H2O
Hg + 4HNO3(浓) Hg(NO3)2 + 2NO2 + 2H2O
Hg(NO3)2 + 2NO2 + 2H2O
Hg(NO3)2与Hg作用可制取Hg2(NO3)2:
Hg(NO3)2 + Hg Hg2(NO3)2
Hg2(NO3)2
Hg(NO3)2和Hg2(NO3)2是离子型化合物。
在Hg(NO3)2、Hg2(NO3)2的酸性溶液中,分别有无色的Hg(H2O)62+和Hg2(H2O)x2+存在。它们在水中按下式发生水解反应:
[Hg(H2O)6]2+ [Hg(OH)(H2O)5]+ + H+ Kq=10-3.7
[Hg(OH)(H2O)5]+ + H+ Kq=10-3.7
[Hg2(H2O)x]2+ [Hg2(OH)(H2O)x-1]+ + H+ Kq=10-5.0
[Hg2(OH)(H2O)x-1]+ + H+ Kq=10-5.0
增大溶液的酸性,可以抑制它们的水解。
在Hg2+的溶液中加入SnCl2,首先有白色的Hg2Cl2生成。再加入过量的SnCl2溶液时Hg2Cl2可被Sn2+还原为Hg,此反应常用来鉴定溶液中Hg2+的存在。
(2.5)硫化物及Cd2+的鉴定
在Zn2+、Cd2+的溶液中分别通入H2S时,都会有硫化物从溶液中沉淀出来:
Zn2+ + H2S  ZnS↓+ 2H+
ZnS↓+ 2H+
Cd2+ + H2S  CdS↓+ 2H+
CdS↓+ 2H+
由于ZnS的溶度积较大,如溶液的H+浓度超过0.3mol·L-1时,ZnS就能溶解。CdS则难溶于稀酸中。从溶液中析出的CdS呈亮黄色,常根据这一反应来鉴定溶液中Cd2+的存在。
CdS溶于浓盐酸的反应如下:
CdS + 2H+ + 4Cl- [CdCl4]2- + H2S
[CdCl4]2- + H2S
实际上CdS在6mol·L-1的盐酸中就能被溶解。
在ZnSO4的溶液中加入BaS时生成ZnS和BaSO4的混合沉淀物,此沉淀叫锌钡白(俗称立德粉):
Zn2+ + SO42- + Ba2+ + S2- ZnS·BaSO4↓
ZnS·BaSO4↓
锌钡白是一种较好的白色颜料,没有毒性,在空气中比较稳定。
HgS是溶度积最小的硫化物,在锌族配合物中讨论。
(3)Hg(Ⅰ)和Hg(Ⅱ)的相互转化
由电势图可看出:Hg22+在溶液中不容易歧化为Hg2+和Hg。
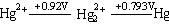
相反,Hg能把Hg2+还原为Hg22+:
Hg2+ + Hg  Hg22+ Kq=142
Hg22+ Kq=142
前面提到的Hg2(NO3)2的制取,就是根据这一反应而进行的,这相当于Hg22+的逆歧化反应。
相反的,若要使Hg22+转化为Hg(Ⅱ)并使之稳定存在,就得使Hg2+形成难解离的物质,降低Hg2+的浓度。例如Hg2Cl2与NH3的反应:
Hg2Cl2 + 2NH3 NH2Hg2Cl + NH4Cl
NH2Hg2Cl + NH4Cl
NH2Hg2Cl NH2HgCl + NH4Cl + Hg
NH2HgCl + NH4Cl + Hg
即:Hg2Cl2 + 2NH3 NH2HgCl↓ + Hg↓ + NH4Cl
NH2HgCl↓ + Hg↓ + NH4Cl
Hg2Cl2又称甘汞,也是一种直线型分子,无毒,见光易分解。
再如:Hg22++S2- == HgS↓+ Hg↓
Hg22++CO32- == HgO↓+ Hg↓+CO2↑
(4)锌族元素的配合物
(4.1)Zn(Ⅱ)、Cd(Ⅱ)的配合物
在浓的ZnCl2水溶液中,会形成如下配合物:
ZnCl2·H2O == H[ZnCl2(OH)]
这种配合物具有显著的酸性,能溶解金属氧化物,例如:
FeO+2H[ZnCl2(OH)] == Fe[ZnCl2(OH)]2+H2O
焊接金属时,常用ZnCl2作为焊药,它可清除金属表面的锈层,使焊接不至于形成假焊。
锌一般是形成配位数为4的配合物,例如:
Zn2+ + 4NH3(过量) [Zn(NH3)4]2+
[Zn(NH3)4]2+
除此以外,Zn(OH)2在过量OH-条件下的溶解、CdS在浓盐酸中的溶解也都是形成了相应的配合物。
(4.2)Hg(Ⅱ)的配合物
Hg2+能形成多种配合物,其配位数为4的占绝对多数,都是反磁性的。这种配合物常借加合反应生成。例如,难溶于水的白色Hg(SCN)2能溶于浓的KSCN溶液中,生成可溶性的四硫氰合汞(Ⅱ)酸钾K2[Hg(SCN)4]:
Hg(SCN)2 (s) + 2SCN- [Hg(SCN)4]2-
[Hg(SCN)4]2-
这属于前面提到过的配位溶解。
在溶液中Hg2+与Cl-存在着如下平衡:
Hg2+ 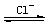 [HgCl]+
[HgCl]+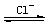 [HgCl2]
[HgCl2] [ HgCl3]-
[ HgCl3]-  [HgCl4]2-
[HgCl4]2-
随着配位体浓度的不同而形成一系列中间型的配合物。实验证明,在存在过量Cl-的情况下,主要是形成HgCl42-,在Cl-浓度较小的溶液中,HgCl2、HgCl3-、HgCl42-可能都存在。另外可看到,HgCl2可看作是配合分子,它在溶液中并不完全离解为Hg2+和Cl-,而是以分子形式存在的HgCl2占绝对优势。
HgS难溶于水,但能溶于过量的浓的Na2S溶液中生成二硫合汞(Ⅱ)离子[HgS2]2-:
HgS(s) + S2- [HgS2]2-
[HgS2]2-
在实验室中通常用王水溶解HgS:
3HgS(s) +12Cl- + 8H+ + 2NO3- 3[HgCl4]2- + 3S↓+2NO↑+ 4H2O
3[HgCl4]2- + 3S↓+2NO↑+ 4H2O
这一反应,除了HNO3能把HgS中的S2-氧化为S外,生成配离子[HgCl4]2-也是促使HgS溶解的因素之一。可见,HgS溶解是借氧化还原反应和配位反应共同作用的结果。
9.4钠、镁、钙、锌、铁等金属元素在生物界的作用
饮食中钠的主要来源为食盐和酱油。钠参与体液的酸碱平衡,即与Cl-或HCO3-离子结合,调节pH,维持细胞外液一定的渗透压,使之与细胞内液的渗透压平衡,并和钾离子一样对骨骼肌有兴奋作用。当肾脏发生病变时,肾功能减弱,每天排出的钠量减少,使钠在体内存留。于是吸水增多,血液中的钠离子和水由于渗透压的改变,渗入到组织间隙中而形成水肿,并使血压升高,甚至引起心力衰竭。因此,肾类病人在浮肿期间要严格忌盐。
镁和钙是动植物必需的营养元素。人体中70%的镁存在于骨骼中,其余的30%在其他软组织及体液中。镁除了是构成骨骼、牙齿的原料,在人体内还可以与钠、钾、钙共同维持心脏、神经、肌肉等的正常功能。镁是叶绿素的组成部分,而且在糖类的代谢作用中起着重要的作用。研究证明在植物的结实过程中需要较多的镁。镁的存在对钙的吸收有密切关系,缺镁时显著地影响钙的代谢作用。镁缺乏的症状是精神抑郁,肌肉软弱,易发生眩晕,幼儿还可以发生惊厥。含镁丰富的食品有小米、燕麦、大麦、小麦、豆类、肉类和动物的肝脏等。
钙是构成植物细胞壁和动物骨骼的重要成分,人体内钙的99%存在于骨骼和牙齿中,其余主要分布于体液内,参与某些重要的酶反应,对维持心脏正常收缩,抑制神经肌肉兴奋性,促进凝血和保持细胞壁完整性有重要作用。缺少钙时,将引起动植物发育和生长不良。人体对钙的吸收率低,而氨基酸与钙可形成可溶性钙盐,因此高蛋白膳食有利于钙的吸收。维生素D和乳糖都能促进钙的吸收。
人体缺钙的主要症状是生长缓慢,骨骼疏松,常出现不正常的姿态与步调,易于内出血,尿量大增和寿命较短。儿童补钙的途径主要有吃钙片和鱼肝油,吃钙质饼干等。尤为重要的是多晒太阳,以促进维生素D的合成,改善钙的吸收利用。
人体所需的钙,以奶及奶制品最好,不但含量丰富,而且吸收率高。此外,蛋黄、豆类、花生、蔬菜含钙也较高,小虾米皮含钙特别丰富,谷物中也含有钙。
锌在人体中含量达2~3g,主要存在于骨骼和皮肤(包括头发)中。锌与多种酶、核酸及蛋白质的合成有着密切的关系。它能影响细胞的分裂、生长和再生。锌还对味质和食欲有直接影响,缺锌可降低味觉的敏感性和使味觉、嗅觉异常,进而引起食欲减退,直接影响了少年儿童的生长发育。近年已把食欲下降列为婴幼儿缺锌的早期表现。临床上也证明了缺锌是小儿异食癖的病因之一。
人体缺锌的临床表现有生长停滞,虽到了成熟阶段,却身材矮小,性发育不良,味觉和食欲减退和创伤愈合不良等。
含锌较多的是动物蛋白,如鱼、肉(尤其是瘦肉)、肝、肾和水产蛤、蚌、牡蛎等。一般来说,动物性食物中的锌不但含量高,且活性大,较易吸收。对婴幼儿来说,人奶中的锌比牛奶中的锌易吸收,因此虽然牛奶含锌量高于人奶,而锌的利用却不如人奶好。
铁在人体内含量约3~5g,其中70%在血液循环内。铁与蛋白质结合成血红素——为红细胞主要成分,如若缺乏,血红素就无法形成,造成贫血。血红素可携带氧气与营养素在体内循环,供给各细胞之需要,然后将各细胞产生之二氧化碳与废物带至各排泄器官,排出体外。铁为体内细胞所含之重要物质。铁为部分酶素的成分,亦可活化酶素的消化功能。植物体内的铁是形成叶绿素的必要条件,因此铁是生物体必需的元素之一。
膳食中铁的良好来源为动物肝脏、蛋黄、豆类和某些蔬菜,以及在红糖、葡萄、桃、梅等食物中。一般说来,动物性食物中的铁比植物性食物中的铁易吸收些。
习 题
9-1 与同族元素相比,锂、铍有哪些特殊性?
9-2 现有五种白色固体粉末,它们可能分别是:MgCO3、BaCO3、无水Na2CO3、无水CaCl2及无水Na2SO4。试设法加以鉴别,并写出反应式。
9-3 在强酸性和强碱性介质中,铬(Ⅲ)和铬(Ⅵ)各以何种离子存在?呈何颜色?
9-4 在K2Cr2O7的饱和溶液中加入浓H2SO4,并加热到200℃时,发现溶液的颜色变为蓝绿色,经检查反应开始时溶液中并无任何还原剂存在,试说明上述变化的原因。
9-5把煅烧过的Cr2O3变为Cr(Ⅲ)和Cr(Ⅵ)的化合物,采用什么办法?写出其反应方程式。
9-6 在1.0L0.1mol·L-1Cr3+溶液中,Cr(OH)3完全沉淀时,问溶液的pH值是多少?要使沉淀出的Cr(OH)3刚好在1.0LNaOH溶液中完全溶解并生成[Cr(OH)4]-,问溶液的OH-离子浓度是多少?并求[Cr(OH)4]-的稳定常数β4。
已知: Cr(OH)3(s) + OH- Cr(OH) 4- Kq=10-0.4。
Cr(OH) 4- Kq=10-0.4。
9-7 在MnCl2溶液中加入适量的HNO3,再加入NaBiO3,溶液中出现紫红色后又消失,说明原因,写出有关反应方程式。
9-8根据价键理论,画出下列配合物形成时中心离子的价层电子分布,估计哪种配合物较稳定。
[Mn(C2O4)3]3- [Mn(CN)6]3-
μ/B·M 4.9 2.8
9-9 试验高锰酸盐在不同介质中的还原产物应先加还原剂还是先加介质?为什么?
9-10 在Fe2+、Co2+和Ni2+的溶液中加NaOH,在无CO2的空气中放置后,各得到何种产物?
9-11 用盐酸处理Fe(OH)3、Co(OH)3、Ni(OH)3各发生什么反应?写出反应方程式。这反映了它们什么性质上的差异?
9-12 在0.1mol·L-1的Fe3+溶液中加入足够的铜屑,室温下反应达到平衡,求Fe3+、Fe2+和Cu2+的浓度。
9-13 在0.1mol·L-1Fe3+溶液中,若仅有水解产物[Fe(OH)(H2O)5]2+形成,求此溶液的pH值?(已知Kq1=10-3.05)
9-14 溶液中含有Fe3+、Co2+和Ni2+,如何把它们分别鉴定?
9-15 写出下列有关反应式,并说明反应现象。
①ZnCl2溶液中加入NaOH溶液后,再加过量的NaOH溶液;
②CuSO4溶液加氨水后,再加过量氨水;
③HgCl2溶液中加适量的SnCl2溶液后,再加过量的SnCl2溶液;
④HgCl2溶液中加适量的KI后,再加过量的KI溶液。
9-16 在含有大量NaF的1mol·L-1CuSO4和1mol·L-1 Fe2(SO4)3的混合溶液中,加入1mol·L-1KI溶液。问有什么现象发生?写出有关反应式。
9-17 完成下列反应方程式:
(1) Cu2+ + Cu + Cl-
(2) [Ag(NH3)2]+ + HCHO
(3) Ag2S + HNO3(浓)
(4) Hg(NO3)2 + NaOH
(5) Hg22+ + H2S
(6) Hg2+ + I-(过量)
(7) Cd2+ + HCO3-
(8) HgS +HCl+ HNO3
9-18 将H2S通入ZnCl2溶液中,仅析出少量的ZnS沉淀,如果在此溶液中加入NaAc,则使ZnS沉淀完全。试说明原因。
9-19 在一混合溶液中有Ag+、Cu2+、Zn2+、Hg2+四种离子,如何把它们分离开来并鉴定它们的存在?
9-20 在Hg2Cl2和HgCl2溶液中,分别加入氨水,各生成什么产物?写出反应式。
9-21 在Cu2+、Ag+、Ca2+、Hg22+、Hg2+的溶液中,分别加入适量的NaOH溶液,问各有什么物质生成?写出有关的离子反应方程式。
9-22 由粗锌制出的Zn(NO3)2中,可能含有Cd2+、Fe3+和Pb2+等离子,试用什么方法证明这三种杂质离子的存在。
9-23 已知反应Zn(OH)2+2OH- Zn(OH)42-的平衡常数Kq=100.68,结合有关数据,计算Eq (Zn(OH) 42-/Zn)的值。
Zn(OH)42-的平衡常数Kq=100.68,结合有关数据,计算Eq (Zn(OH) 42-/Zn)的值。
9-24 根据下列电对的Eq值,结合有关电对的Eq值,计算[AuCl2]-和[AuCl4]-的稳定常数。
[AuCl2]-+e  Au+2Cl- Eq=1.61V
Au+2Cl- Eq=1.61V
[AuCl4]-+ 2e  [AuCl2]-+ 2Cl- Eq=0.93V
[AuCl2]-+ 2Cl- Eq=0.93V
9-25 计算反应Cu2++Cu+4Br- 2[CuBr2]-的平衡常数。
2[CuBr2]-的平衡常数。
9-26 已知下列反应在室温下的平衡常数:
Cu(OH)2(s)+2OH- [Cu(OH)4]2- Kq=10-2.78
[Cu(OH)4]2- Kq=10-2.78
结合有关数据,求[Cu(OH)4]2-的稳定常数β4。在1.0LNaOH溶液中,若使0.10molCu(OH)2溶解,问NaOH的浓度至少应为多少?
9-27 在Ag+溶液中,先加入少量的Cr2O72-,再加入适量的Cl-,最后加入足够量的S2O32-,估计每一步会有什么现象出现?写出有关的离子反应方程式。
9-28 某一化合物A溶于水得一浅蓝色溶液。在A溶液加入NaOH得蓝色沉淀B。B能溶于HCl溶液,也能溶于氨水。A溶液中通入H2S,有黑色沉淀C生成。C难溶于HCl溶液而易溶于热浓HNO3中。在A溶液中加入Ba(NO3)2溶液,无沉淀产生,而加入AgNO3溶液时有白色沉淀D生成。D溶于氨水。试判断A、B、C、D为何物?
9-29 有一无色溶液,①加入氨水时有白色沉淀生成;②若加入稀碱则有黄色沉淀生成;③若滴加KI溶液,先析出桔红色沉淀,当KI过量时,桔红色沉淀消失;④若在此无色溶液中加入数滴汞并振荡,汞逐渐消失,此时再加氨水得灰黑色沉淀。问此无色溶液中含有哪种化合物?写出有关反应式。
