实验四 乙酸乙酯制备
一、实验目的:
1、 掌握用醇和羧酸制备酯的方法。
2、 练习分液漏斗的使用及蒸馏操作
二、试剂:
乙醇 、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3 g (用于干燥乙酸乙酯)
三、反应原理:
 主反应
主反应
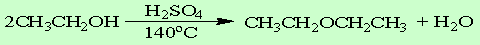 副反应
副反应
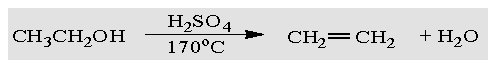
四、仪器与反应装置图:
仪器 三口圆底烧瓶、温度计、滴液漏斗、分液漏斗、锥形瓶、直形冷凝管、蒸馏头、接受弯头、加热系统。
装置图
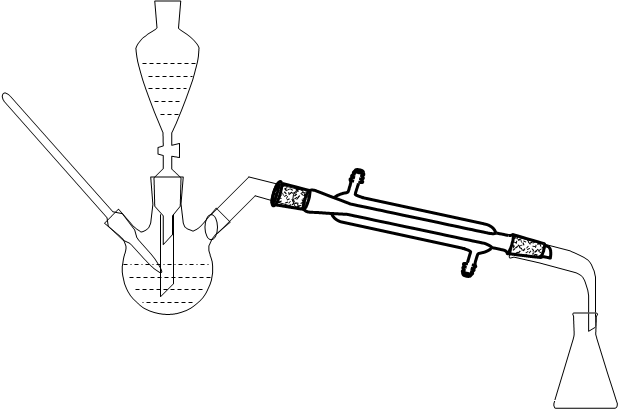
五、操作步骤:
1、粗乙酸乙酯的制备
①在干燥的100 mL三颈烧瓶中加入8 mL 95%的乙醇,在冷水冷却下,边摇边慢慢加入8 mL浓硫酸,加入沸石;在滴液漏斗中加入8 mL 95%的乙醇和8 mL乙酸,摇匀。按上述装置图组装仪器。滴液漏斗的末端和温度计的水银球必须浸到液面以下距瓶底0.5~1 cm处。
②加热,当温度计读数上升到110℃时,从滴液漏斗中滴加乙醇和乙酸混合液(速度为每分钟30滴为宜),并维持反应温度在120℃左右。滴加完毕,继续加热数分钟,直到反应液温度升到130℃,不再有馏出液为止。
2、洗涤
③向粗产物中慢慢加入饱和碳酸钠溶液,直到有机相的pH值呈中性为止。分去水相,有机相用 7 mL 饱和食盐水洗涤后,再饱和氯化钙洗涤两次,每次7mL 。弃去水层,酯层用无水硫酸钠干燥。

④将干燥后的乙酸乙酯滤入 25mL 蒸馏瓶中,蒸馏,收集 73-78 ℃馏分,称重,计算产率 。
纯粹乙酸乙酯的沸点为 77.06 ℃,具有果香味。
六、注意事项:
1、酯化反应所用仪器必须无水,包括量取乙醇和冰醋酸的量筒也要干燥。
2、加热之前一定将反应混合物混合均匀,否则容易炭化。
3、分液漏斗的正确使用和维护。。
4、用10%碳酸钠水溶液洗涤有机相时有二氧化碳产生,注意及时给分液漏斗放气,以免气体冲开分液漏斗的塞子而损失产品。
5、正确进行蒸馏操作,温度计的位置影响流出温度,温度计水银球的上沿与蒸馏头下沿一平。
6、有机相干燥要彻底,不要把干燥剂转移到蒸馏烧瓶中。
7、反应和蒸馏时不要忘记加沸石。
8、用CaCl2溶液洗之前,一定要先用饱和NaCl溶液洗,否则会产生沉淀,给分液带来困难。
七、思考题:
1、酯化反应有什么特点,本实验如何创造条件使酯化反应尽量向生成物方向进行?
2、本实验有哪些可能的副反应?
3、如果采用醋酸过量是否可以,为什么?
4、在纯化过程中,Na2CO3溶液、NaCl溶液、CaCl2溶液、Na2SO4粉末分别除去什么杂质?
说明:
(1)实验报告书写格式按“制备实验”项下。“二、主要试剂的物理常数用量及规格参见下表格式。
表 主要试剂的物理常数[1]用量及规格
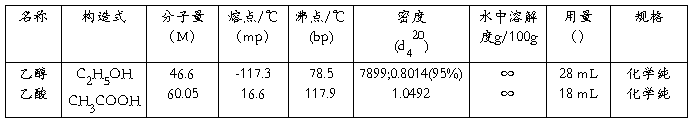
[1] 刘风楼.有机化学.[M].中国农业出版社.北京.1999,330
思考题和测试题
思考题1:浓硫酸的作用是什么?
思考题2:加入浓硫酸的量是多少?
思考题3:为什么要加入沸石,加入多少?
思考题4:为什么要使用过量的醇,能否使用过量的酸?
思考题5:为什么温度计水银球必须浸入液面以下:
思考题6:为什么调节滴加的速率(每分钟30滴左右)?
思考题7:为什么维持反应液温度120℃左右?
思考题8:实验中,饱和Na2CO3溶液的作用是什么?
思考题9:实验中,怎样检验酯层不显酸性?
思考题10:酯层用饱和Na2CO3溶液洗涤过后,为什么紧跟着用饱和NaCl溶液洗涤,而不用CaCl2溶液直接洗涤?
思考题11:为什么使用CaCl2溶液洗涤酯层?
思考题12:使用分液漏斗,怎么区别有机层和水层?
思考题13:本实验乙酸乙酯是否可以使用无水CaCl2干燥?
思考题14:本实验乙酸乙酯为什么必须彻底干燥?
思考题答案
思考题1答:在酯化反应中,浓硫酸其催化和吸水作用。
思考题2答:硫酸的用量为醇用量的3%时即能起催化作用,当硫酸用量较多时,由于它能够其脱水作用而增加酯的产率。但硫酸用量过多时,由于高温时氧化作用的结果对反应反而不利。
思考题3答:加入沸石的目的是防止爆沸,加入1-2粒即可。
思考题4答:使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。
思考题5答:反应过程中,我们控制的是反应液的温度,所以温度计水银球必须浸入液面以下。
思考题6答:若滴加速率太快则乙醇和乙酸可能来不及反应就随着酯和水一起蒸馏出,从而影响酯的产率。
思考题7答:温度太高,容易发生副反应,影响产物的纯度和产率。
思考题8答:使用饱和Na2CO3溶液中和反应液中残余的乙酸。
思考题9答:先将蓝色石蕊试纸湿润,再滴上几滴酯。
思考题10答:当酯层用饱和Na2CO3溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的CaCO3沉淀,使进一步分离变得困难,故在这步操作之间必须水洗一下。由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
思考题11答:酯层中含有少量未反应的乙醇,由于乙醇和CaCl2作用生成CaCl2·4H2O结晶化物,所以使用乙醇除去少量未反应的乙醇。
思考题12答:乙酯的密度d204=0.9003,所以有机层在上层。如果不知道密度,可以向分液漏斗中加入少量水,比较上层和下层体积的变化。
思考题13答:不可以,因为乙醇和CaCl2作用生成CaCl2·4H2O结晶化物。
思考题14答:乙酸乙酯与水和醇分别生成二元共沸物,若三者共存则生成三元共沸物。因此,酯层中的乙醇和水除不净时,回形成低沸点共沸物,而影响酯的产率。
测试题1、 酯化反应有什么特点? 实验中如何创造条件使酯化反应尽量向生成物的方向进行?
测试题2、 本实验若采用醋酸过量的做法是否合适?为什么?
测试题3、 蒸出的粗乙酸乙脂中主要有哪些杂质?如何除去?
测试题4、实验中使用浓硫酸的作用?
测试题5、能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?
测试题6、为什么用饱和碳酸钠溶液洗涤时要小量分批加入,并不断摇动接受器?
测试题7、实验中用饱和食盐水洗涤,是否可用水代替?
测试题答案:
测试题1答:酯化反应为可逆反应,反应进行慢且需要酸催化。为提高产率,本实验中采用增加醇的用量、不断将产物酯和水蒸出、加大浓硫酸用量的措施,使平衡向右移动。
测试题2答:不合适,因为使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。
测试题3答:主要杂质有乙醚、乙醇、乙酸和水等。由于乙醚沸点低,在多次洗涤中,极易挥发掉;使用饱和的Na2CO3溶液洗涤除去乙酸;紧跟着用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,然后用饱和CaCl2溶液直接洗涤除去少量的乙醇。
测试题4答:反应中,浓硫酸除了起催化剂作用外,还吸收反应生成的水,有利于酯的生成。
测试题5答:不可以,使用浓氢氧化钠溶液可以使乙酸乙酯发生水解,降低产率。
测试题6答:因为乙酸乙酯粗产品中含有乙酸,乙酸与饱和碳酸钠溶液反应生成二氧化碳,如果一次加入,反应剧烈,所以必须要小量分批加入,并不断摇动接受器,使乙酸与碳酸钠温和的反应。
测试题7答:不可以,由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
第二篇:乙酸乙酯的制备2-思考题附答案
实验四 乙酸乙酯的制备
一.实验目的 1.学习和掌握乙酸乙酯的制备原理和方法
2.掌握边滴加边蒸馏的合成反应操作
二.反应式
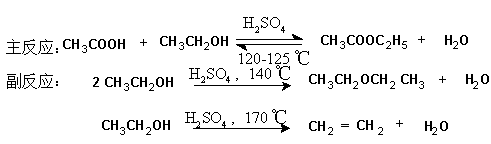
三.实验试剂 见书

四.实验步骤
五.实验注意事项 1.取反应药品的量筒一定要干燥
2.小火加热,控制好温度115-125 ℃ (太低,反应慢;太高,副反应严重)
3.滴加速度和蒸馏速度大致相等,若太快,乙醇和乙酸来不及反应就被蒸出
4.洗涤时,一定要清楚有机层和水层以及各步洗涤的目的
5.粗产物中的水和醇一定要除净
(6.用无水K2CO3 干燥时,所用锥形瓶要干燥无水)
讲解部分:
1. 取反应药品的量筒一定要干燥 ;反应是可逆反应,若有水则平衡不利于产物
2. 反应仪器装置的安装要点(第一次合成实验则讲);冷凝水的进出口,且冷凝水不可开得太大。
3. 分液漏斗处理:活塞防漏处理,距反应液面高度,分液、洗涤操作!
4. 为了提高产率①乙醇过量50% ②将生成的产物乙酸乙酯和水蒸出
问:为什么不用分水器除去水,提高转化率(若已做过正丁醚的制备实验)?
5. 浓硫酸用量为乙醇3% 左右,作为催化剂;硫酸过多,则对乙醇有氧化作用
6. 注意控制温度,小火加热,烧瓶底部与石棉网间隔最好为1cm (原因?)
7. 要熟练的控制分液漏斗的滴加速度,每分钟约10-12滴
8. PH 试纸检验时,先用水润湿,再用玻棒蘸上一点有机层液体;切不可将试纸伸到有机层中,以免污染
9. 在分液漏斗中用NaCO3 溶液洗涤时,要注意放气,并先敞开口,振荡,待没什么气体后,再盖上盖,倒转振荡,放气
10. 用饱和NaCl / H2O 洗涤的目的?为什么用饱和NaCl / H2O 代替水?
11. 用无水KCO3 干燥的目的?(第一次合成实验则讲),注意用量及时间;干燥完毕后,采用倾斜法将粗产物倒入蒸馏瓶,注意不要将KCO3 倒进去。
12. 水浴蒸馏的目的是为控制温度。注意:提前烧水,水不可太多。
(第一次合成实验则讲:
①领两次仪器,换领;注意反应仪器与蒸馏仪器领回后不要水洗,保持干燥
②取药品,量筒要干燥;如果取多了,不要倒回原试剂瓶,可以分给其他同学,也不可倒掉重取;对于液体药品,一般都用量筒量取,小于10ml则用10ml量筒量取。
③蒸馏操作、装置,特别是装温度计的手法和温度计的水银球的位置,空气冷凝管和水冷凝管的选择 ;接引管,小小不要摔坏;蒸馏速度每秒1-2滴。
④要事先准备两个干燥的锥形瓶,一个用来干燥粗产物,一个用来收集最终产物;最后收集产物的锥形瓶一定要干燥无水,事先称重 ;
⑤写实验报告,包括产率的计算; )
思考题和测试题
思考题1:浓硫酸的作用是什么?
思考题2:加入浓硫酸的量是多少?
思考题3:为什么要加入沸石,加入多少?
思考题4:为什么要使用过量的醇,能否使用过量的酸?
思考题5:为什么温度计水银球必须浸入液面以下:
思考题6:为什么调节滴加的速率(每分钟30滴左右)?
思考题7:为什么维持反应液温度120℃左右?
思考题8:实验中,饱和Na2CO3溶液的作用是什么?
思考题9:实验中,怎样检验酯层不显酸性?
思考题10:酯层用饱和Na2CO3溶液洗涤过后,为什么紧跟着用饱和NaCl溶液洗涤,而不用CaCl2溶液直接洗涤?
思考题11:为什么使用CaCl2溶液洗涤酯层?
思考题12:使用分液漏斗,怎么区别有机层和水层?
思考题13:本实验乙酸乙酯是否可以使用无水CaCl2干燥?
思考题14:本实验乙酸乙酯为什么必须彻底干燥?
思考题答案
思考题1答:在酯化反应中,浓硫酸其催化和吸水作用。
思考题2答:硫酸的用量为醇用量的3%时即能起催化作用,当硫酸用量较多时,由于它能够其脱水作用而增加酯的产率。但硫酸用量过多时,由于高温时氧化作用的结果对反应反而不利。
思考题3答:加入沸石的目的是防止爆沸,加入1-2粒即可。
思考题4答:使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。
思考题5答:反应过程中,我们控制的是反应液的温度,所以温度计水银球必须浸入液面以下。
思考题6答:若滴加速率太快则乙醇和乙酸可能来不及反应就随着酯和水一起蒸馏出,从而影响酯的产率。
思考题7答:温度太高,容易发生副反应,影响产物的纯度和产率。
思考题8答:使用饱和Na2CO3溶液中和反应液中残余的乙酸。
思考题9答:先将蓝色石蕊试纸湿润,再滴上几滴酯。
思考题10答:当酯层用饱和Na2CO3溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的CaCO3沉淀,使进一步分离变得困难,故在这步操作之间必须水洗一下。由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
思考题11答:酯层中含有少量未反应的乙醇,由于乙醇和CaCl2作用生成CaCl2·4H2O结晶化物,所以使用乙醇除去少量未反应的乙醇。
思考题12答:乙酯的密度d204=0.9003,所以有机层在上层。如果不知道密度,可以向分液漏斗中加入少量水,比较上层和下层体积的变化。
思考题13答:不可以,因为乙醇和CaCl2作用生成CaCl2·4H2O结晶化物。
思考题14答:乙酸乙酯与水和醇分别生成二元共沸物,若三者共存则生成三元共沸物。因此,酯层中的乙醇和水除不净时,回形成低沸点共沸物,而影响酯的产率。
测试题1、 酯化反应有什么特点? 实验中如何创造条件使酯化反应尽量向生成物的方向进行?
测试题2、 本实验若采用醋酸过量的做法是否合适?为什么?
测试题3、 蒸出的粗乙酸乙脂中主要有哪些杂质?如何除去?
测试题4、实验中使用浓硫酸的作用?
测试题5、能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?
测试题6、为什么用饱和碳酸钠溶液洗涤时要小量分批加入,并不断摇动接受器?
测试题7、实验中用饱和食盐水洗涤,是否可用水代替?
测试题答案:
测试题1答:酯化反应为可逆反应,反应进行慢且需要酸催化。为提高产率,本实验中采用增加醇的用量、不断将产物酯和水蒸出、加大浓硫酸用量的措施,使平衡向右移动。
测试题2答:不合适,因为使平衡向生成物一方移动,使用过量的酸不好,因为酸不能与酯共沸。
测试题3答:主要杂质有乙醚、乙醇、乙酸和水等。由于乙醚沸点低,在多次洗涤中,极易挥发掉;使用饱和的Na2CO3溶液洗涤除去乙酸;紧跟着用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,然后用饱和CaCl2溶液直接洗涤除去少量的乙醇。
测试题4答:反应中,浓硫酸除了起催化剂作用外,还吸收反应生成的水,有利于酯的生成。
测试题5答:不可以,使用浓氢氧化钠溶液可以使乙酸乙酯发生水解,降低产率。
测试题6答:因为乙酸乙酯粗产品中含有乙酸,乙酸与饱和碳酸钠溶液反应生成二氧化碳,如果一次加入,反应剧烈,所以必须要小量分批加入,并不断摇动接受器,使乙酸与碳酸钠温和的反应。
测试题7答:不可以,由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
