食醋中总酸量的测定
梁建林(41007118)
(2010级化学3班1号实验小组 电话:187xxxxxxxx)
一、实验目标
1.初步学会用传感器技术测定食醋中的总酸量;
2.会组织中学生用传感器技术测定食醋中的总酸量教学过程。
二、实验原理
1.待测的食醋中醋酸及其他有机酸可换算为醋酸总量,都可以被标准的强碱NaOH溶液标定:
NaOH+CH3COOH=CH3COONa+H2O
C待测V待测=C标准V标准
2.当溶液中的电解质含量恒定时,电导率亦恒定,当生成难电离物质时,电导率下降,pH传感器就是把电信号转化为化学信息来测定其中的总酸度的。
三、仪器与药品
pH传感器、数据采集器、自动计数器、50mL酸式滴定管、电磁搅拌器、铁架台、250mL烧杯、量筒
有色食醋原液、0.1mol/L NaOH溶液、蒸馏水
四、实验操作过程
1.准备阶段:pH传感器的标定
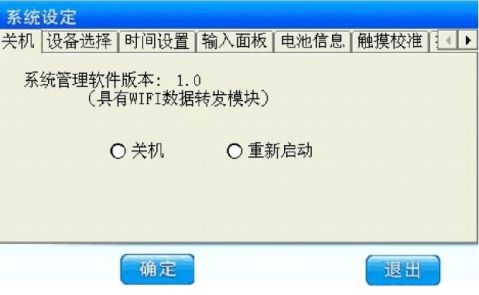
(1)在采集器3号传感器接口上连接好pH传感器,然后按下采集器电源开关,打开数据采集器,进入如下界面:

点击右下角“系统设置”,进入如下界面:
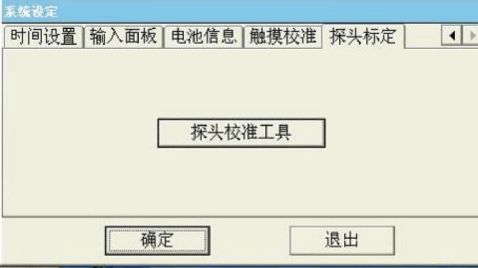
选择系统设定里的“探头标定”选项,并点击“探头校准工具”按钮:
点击“建立连接”按钮(点击后变灰色,显示连接成功,即可开始标定)。
拔开电极上部的橡胶塞,使小孔露出。否则在进行校正时,会产生负压, (2)
导致溶液不能正常进行离子交换,会使测量数据不准确。
(3)将电极取出,先用蒸馏水冲洗,然后用滤纸把电极上残留的保护液吸干。将电极放进pH=4.00(邻苯二甲酸氢钾)的缓冲液中,点击采集器上pH=4下的“开始标定”按钮,5-10秒后,当显示的数值在22000-23000间,且变化幅度不大时,点击“结束标定”,取出电极。
(4)将电极取出,先用蒸馏水冲洗,然后用滤纸把电极上残留的保护液吸干。将电极放进pH=9.18(邻苯二甲酸氢钾)的缓冲液中,点击采集器上pH=4下的“开始标定”按钮,5-10秒后,当显示的数值在27000-28000间,且变化幅度不大时,点击“结束标定”,取出电极。最后点击一次“写标定值”。
(5)验证标定:标定完成,进入传感器测量界面,将探头放入pH=6.86(混合磷酸盐)的溶液中,检测标定是否成功。观察读数稳定后读数在6.70-7.00之间即可认为标定比较准确,否则应重新标定。
2.软件操作
(1)标定后,进入如下图界面:
点击“通用”,进入通用实验界面:

点击左上角“打开模版”依如下路径选择实验:
打开模版—SDMEM—实验模版—化学实验—酸碱中和滴定—酸碱中和滴定(xmlp文件)
进入滴定实验界面,如下图:
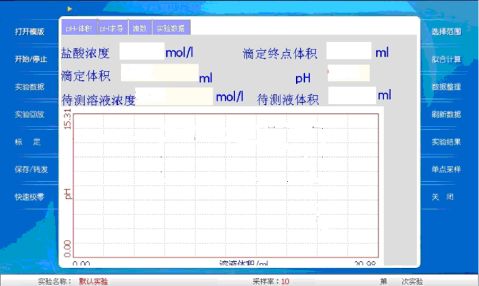
光电门传感器红色线(或有红色标记的)一端连接液滴计数器,黑色线(无标记的)接一光电门(该光电门应放在空处,不被任何物体挡光),调节光电门传感器为计数模式(第1个和第3个灯同时亮)。然后长按光电门传感器上按钮,3个灯同时亮时放开清零数据(开始实验前必备操作)(注意清零时不要更改模式)。
在盐酸一栏中输入烧杯中溶液浓度,在待测液体积一栏中输入烧杯中溶液体积。(该实验模版原用于已知浓度的盐酸滴定未知浓度氢氧化钠的实验,在未修改模版条件下,故如此填写已知量,计算仍以H+与OH-物质的量相等为原理)
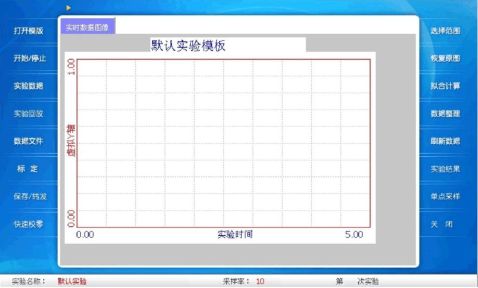
3.往酸式滴定管中注入有色食醋溶液。再往烧杯中注入标定过的40mL NaOH溶液,把烧杯放于磁力搅拌器上。如图:

4.点击“开始/停止”按钮,开始实验。打开磁力搅拌器(最好在实验开始前调好位置或打开,不要让磁子在转动时碰到传感器电极),然后转动滴定管旋钮,让滴定管中食醋以不连续状态滴入烧杯中。当pH传感器的数据刚开始变化,立即终止滴入食醋,并记录已消耗的食醋的体积。再次滴入食醋,注意跟踪pH的变化,当数值接近滴定终点时滴入的食醋尽可能地慢。当波峰曲线出现平台时,停止滴加食醋溶液。
5.当整个实验结束后,点击“开始/停止” 按钮,停止实验。点击“刷新数据”,进入实验数据界面可看到整个实验过程中所有实验数据,最后点击“保存/转发”按钮,保存实验数据到采集器SD卡根目录下。通过计算机端“单机运行平台”软件可在电脑端打开此数据,求导值的最低点横座标即为滴定终点的体积,输入该滴定终点体积(之前已输入烧杯中溶液体积和浓度),点击软件上“重新计算”按钮,可计算出待测溶液浓度。
五、实验注意事项
1.传感器简介
传感器是一系列根据一定的物理化学原理制成的物理化学量的感应器具,它能把外界环境中的某个物理化学量的变化以电信号的方式输出,再经数据模拟装置转化成数据或图表的形式在数据采集器上显示并储存起来。中学化学教学中进行科学探究常用到的传感器有温度传感器、pH传感器、溶解氧传感器、电导率传感器、光传感器、压力传感器、色度传感器等。
传感器技术的特点:便携,实时,准确,综合,直观。
2.实验背景
食醋的质量高低取决于其中所含醋酸量的多少。市场上销售的食醋中,既有
无色的(白醋、兑制醋),又有有色的(香醋、陈醋、熏醋),它们的标牌上所标出的醋酸总含量各不相同,有的大于9g/100mL,有的大于6g/100mL,还有的标着大于等于4.5 g/100mL、4.2 g/100mL、3.5 g/100mL等等。
(1)食醋中的有效成分是醋酸,此外还含有少量的乳酸等有机酸,醋酸是弱酸,用pH试纸或酸度计测定食醋中的总酸量,总是要比实际浓度低,何因?
(2)如果用中和滴定的方法来测定食醋中的总酸量,那么如何选择指示剂?
(3)用中和滴定来测定白醋和兑制醋很好,但是测定米醋、果醋、熏醋等有色食醋的含酸量时,因其颜色比较深,能遮盖住指示剂的颜色,这样就无法看见指示剂的颜色变化,能否用蒸馏水冲稀食醋以减轻颜色的干扰,或者能否用活性炭对这类食醋作脱色处理以后滴定?加入活性炭对溶液的酸度是否有影响?
(4)克服上述不足,可以用一种称作pH传感器测定的方法来实现,该方法不怕待测物中的颜色干扰,测定既快又不用加指示剂。
3.实验的关键
滴定速度的控制:在接近终点时,要注意放慢速度,以便观察到终点。 酸碱的浓度差别不要太大,否则,实验将较难控制,结果误差较大。
4.传感器正常连接时,对应的传感器接口指示灯常亮,当点击开始实验时,传感器接口指示灯为闪烁状态,通过此指示灯可判断传感器是否正常工作。
5.转动滴定管旋钮,让滴定管中溶液以不连续状态滴入烧杯中时,注意“滴定体积”一栏中有无体积变化,同时在“pH”一栏会开始显示pH值。如溶液已开始滴入烧杯,而“滴定体积”一栏无数据,则说明液滴通过计数器时未引起变化,请调节装置,让液滴通过计数器挡光孔,并更换溶液清除数据重新开始实验。如果“pH”一栏数据不变或为非数字时,说明传感器标定不正确,请重新标定,再开始实验。
6.该实验模版原用于已知浓度的盐酸滴定未知浓度氢氧化钠的实验,在未修改模版条件下,故如此填写已知量,计算仍以H+与OH-物质的量相等为原理。
7.若采集器触屏不起任何作用时,采集器可能已进入死机状态,可长按电源开关键或者用手写笔按下侧面孔的reset键(会丢失未保存数据)。
8.实验安全须知
注意食醋和强碱对皮肤的腐蚀与刺激,实验时应佩戴护目镜和防护手套。
六、数据处理
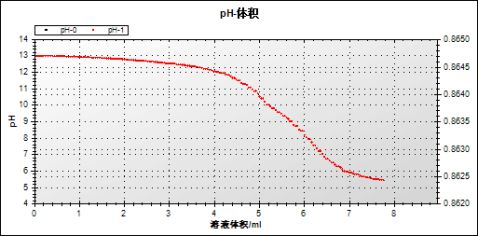
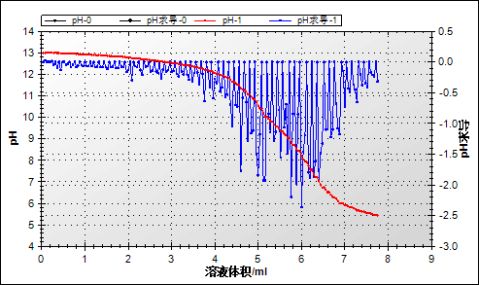
1.
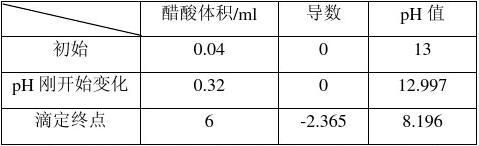
多少?
答:由表知:pH初始值为13,终值为8.196
ΔpH=12.997-8.196=4.801
2.pH刚要开始改变的时候滴入的食醋的量是多少?把它与NaOH溶液完全被中和的时候消耗的食醋量作比较。
答:由表知:(1)pH刚要开始改变的时候滴入的食醋的量是0.32ml
(2)NaOH溶液完全被中和的时候消耗的食醋量为6ml,是pH刚要开 始改变的时候滴入的食醋量的18.75倍。
3.求算待测食醋中的醋酸含量:用每100mL食醋中含醋酸的质量来表示。 答:0.1mol/l×40ml÷6ml=0.67mol/l=4.02g/(100ml)
七、参考文献
[1]郑长龙主编.化学实验课程与教学论[M].北京高等教育出版社.2009.
[2]肖常磊.钱扬义主编.中学化学实验教学论[M].北京化学工业出版社.2008.
[3]钱扬义编著.手持技术在立刻试验中的应用研究[M].北京高等教育出版社.2003.
第二篇:食醋中总酸量的测定
食醋中总酸量的测定
实验人 *俊杰 合作者 *欣蓓 日期 20##-12-28
相对分子质量CH3COOH:60 NaOH:40 为纪念高中最后一次进入化学实验室特制
【实验目的】
1.进一步理解中和滴定法的原理
2. 进一步熟练酸碱中和滴定的操作
【实验原理】
醋酸为一弱酸,可用标准碱溶液直接滴定,反应:CH3COOH+NaOH=CH3COONa+H2O
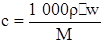 由于食醋也含有少量其他弱酸,如乳酸、琥珀酸等。因此在本实验中用NaOH滴定食醋,测出的是总酸量,测定结果常用ρ(HAc)表示,单位为g/100mL
由于食醋也含有少量其他弱酸,如乳酸、琥珀酸等。因此在本实验中用NaOH滴定食醋,测出的是总酸量,测定结果常用ρ(HAc)表示,单位为g/100mL
计算原理为: (c为溶质的物质的量浓度,单位mol·L-1,ρ为溶液密度,单位g·cm-3,w为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1)。
 c(NaOH)·V(NaOH)=c(CH3COOH)·V(CH3COOH)
c(NaOH)·V(NaOH)=c(CH3COOH)·V(CH3COOH)
计算结果:
【实验用品】
实验仪器:电子天平、量筒、试剂瓶、 mL容量瓶、胶头滴管、玻璃棒 mL、碱式滴定管、 mL酸式滴定管、 mL锥形瓶、 mL烧杯、滴定夹管、铁架台、洗瓶、白纸
实验药品:氢氧化钠固体、食醋样品、酚酞指示剂、蒸馏水
【实验方案设计】
一配制氢氧化钠标准液:
1用电子天平秤取 g NaOH ,倒入烧杯,在烧杯中溶解搅拌并少量稀释NaOH,(并加热煮沸2-3分钟)
2将溶液静置冷却至室温,将烧杯中溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也都加入容量瓶,轻轻震荡容量瓶。
3向容量瓶加入蒸馏水至页面接近刻度线下1-2cm处,改用胶头滴管加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀
4将配好的溶液倒入洁净干燥的试剂瓶中,贴上标签,保存待用。
二稀释食醋样液
量取 ml食醋样液,置于容量瓶中,加水稀释液面接近刻度线下1-2cm处,改用胶头滴管加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。并将配好的溶液倒入洁净干燥的试剂瓶中,贴上标签,保存待用。
三强碱滴定弱酸
1、查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活;
2、洗涤:用水洗净后,各用少量待装液润洗滴定管2-3次;
3、装液:用倾倒法将白醋、氢氧化钠溶液注入酸、碱滴定管中,使液面高于刻度2-3cm
4、赶气泡: 酸式滴定管:快速放液; 碱式滴定管:橡皮管向上翘起
5、调液:调节滴定管中液面高度,并记下读数,记做。
6、取液:
(1)从酸式滴定管中放出 ml白醋溶液于锥形瓶中
(2)滴入2滴酚酞试液,将锥形瓶置于碱式滴定管下方,并在瓶底衬一张白纸。
7、滴定:右手__控制碱式滴定管玻璃珠__,左手__拿住锥形瓶瓶颈,边滴入氢氧化钠,边不断顺时针方向摇动,眼睛要始终注视锥形瓶溶液的颜色变化。
8、记录:当看到加一滴氢氧化钠时,锥形瓶中溶液由无色突变红色时,停止滴定,并且保持呈微红色30s不褪色即为终点,准确记下NaOH读数,并准确求得滴定用去的氢氧化钠体积。
9、计算:整理数据进行计算。
【数据记录】样品名称 总酸量

【得出结论】
食醋样品为 合格/不合格 产品。符合/不符合产品描述。
【反思与体会】
1. 分析造成实验值偏低的原因?你认为实验成功的关键因素是什么?
通常为便于计算,一般将食醋稀释10倍。使用米醋要用活性炭脱色,脱色时,在稀释后的试样中加入少量的活性炭,振荡约4~5分钟后过滤。如果试样颜色仍然较深,需重复上述操作2~3次,使用陈醋时经过三次脱色后,颜色仍然很深,可以棕红色作为滴定终点判定颜色。为消除CO2对实验的影响,所使用的配制NaOH溶液和稀释食醋的蒸馏水应经加热煮沸2~3分钟,以尽可能去除溶解的CO2。稀释食醋所用蒸馏水要先煮沸驱赶CO2,是因为碳酸会消耗一定量NaOH溶液,产生误差。食醋标签上所注总酸量均为不少于一定质量,故只讨论低于标签所注的原因。不一致可能的原因有:食醋稀释时体积控制不当,实际稀释倍数大于理论稀释倍数;试样量取体积偏小;滴定终点颜色不足30秒后退去;滴定结束后在碱式滴定管的尖嘴处有气泡等。
食醋中总酸量的测定
实验人 *俊杰 合作者 *欣蓓 日期 20##-12-28
相对分子质量CH3COOH:60 NaOH:40 为纪念高中最后一次进入化学实验室特制
【实验目的】
1.进一步理解中和滴定法的原理
2. 进一步熟练酸碱中和滴定的操作
【实验原理】
醋酸为一弱酸,可用标准碱溶液直接滴定,反应:CH3COOH+NaOH=CH3COONa+H2O
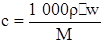 由于食醋也含有少量其他弱酸,如乳酸、琥珀酸等。因此在本实验中用NaOH滴定食醋,测出的是总酸量,测定结果常用ρ(CH3COOH)表示,单位为g/100mL
由于食醋也含有少量其他弱酸,如乳酸、琥珀酸等。因此在本实验中用NaOH滴定食醋,测出的是总酸量,测定结果常用ρ(CH3COOH)表示,单位为g/100mL
计算原理为: (c为溶质的物质的量浓度,单位mol·L-1,ρ为溶液密度,单位g·cm-3,w为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1)。
 c(NaOH)·V(NaOH)=c(CH3COOH)·V(CH3COOH)
c(NaOH)·V(NaOH)=c(CH3COOH)·V(CH3COOH)
计算结果:c(样醋)=1000×1g/cm³×9%÷60g/mol=1.5mol/L ∵1mol/L NaOH和醋的浓度较大
∴要稀释十倍减少误差 ∴要配制0.1mol/L NaOH 共需要0.1L×0.1mol/L=0.01molNaOH
∵c(浓醋)·V(浓醋)=c(稀醋)·V(稀醋) 即0.01mol×40g/mol=0.4g NaOH,10mL 原醋样液
老师建议:配制0.01molNaOH溶液的时候可以统一用20gNaOH 配制500mLNaOH溶液后再稀释十倍 来减少系统误差
【实验用品】
实验仪器:电子天平、量筒、试剂瓶、 100 mL容量瓶、胶头滴管、玻璃棒、 50 mL碱式滴定管、 25 mL酸式滴定管、 150 mL锥形瓶、 50 mL烧杯、滴定夹管、铁架台、洗瓶、白纸
实验药品:氢氧化钠固体、食醋样品、酚酞指示剂、蒸馏水
【实验方案设计】
一配制氢氧化钠标准液:
1用电子天平秤取 0.4 g NaOH ,倒入烧杯,在烧杯中溶解搅拌并稀释NaOH,(并加热煮沸2-3分钟)
2将溶液静置冷却至室温,将烧杯中溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也都加入容量瓶,轻轻震荡容量瓶。
3向容量瓶加入蒸馏水至液面接近刻度线下1-2cm处,改用胶头滴管加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀
4将配好的溶液倒入洁净干燥的试剂瓶中,贴上标签,保存待用。
二稀释食醋样液
量取 10。0 ml食醋样液,置于容量瓶中,加水稀释页面接近刻度线下1-2cm处,改用胶头滴管加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。并将配好的溶液倒入洁净干燥的试剂瓶中,贴上标签,保存待用。
三强碱滴定弱酸
1、查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活;
2、洗涤:用水洗净后,各用少量待装液润洗滴定管2-3次;
3、装液:用倾倒法将白醋、氢氧化钠溶液注入酸、碱滴定管中,使液面高于刻度2-3cm
4、赶气泡: 酸式滴定管:快速放液; 碱式滴定管:橡皮管向上翘起
5、调液:调节滴定管中液面高度,并记下读数,记做。
6、取液:
(1)从酸式滴定管中放出 10.00 ml白醋溶液于锥形瓶中
(2)滴入2滴酚酞试液,将锥形瓶置于碱式滴定管下方,并在瓶底衬一张白纸。
7、滴定:右手__控制碱式滴定管玻璃珠__,左手__拿住锥形瓶瓶颈,边滴入氢氧化钠,边不断顺时针方向摇动,眼睛要始终注视锥形瓶溶液的颜色变化。
8、记录:当看到加一滴氢氧化钠时,锥形瓶中溶液由无色突变红色时,停止滴定,并保持呈微红色30s不褪色即为终点,准确记下NaOH读数,并准确求得滴定用去的氢氧化钠体积。
9、计算:整理数据进行计算。
【数据记录】样品名称 致美斋糯米白醋王 总酸量 不低于9.0g/100mL

【得出结论】
食醋样品为 合格 产品。符合 产品描述。
【反思与体会】
1分析造成实验值偏低的原因?你认为实验成功的关键因素是什么?
通常为便于计算,一般将食醋稀释10倍。使用米醋要用活性炭脱色,脱色时,在稀释后的试样中加入少量的活性炭,振荡约4~5分钟后过滤。如果试样颜色仍然较深,需重复上述操作2~3次,使用陈醋时经过三次脱色后,颜色仍然很深,可以棕红色作为滴定终点判定颜色。为消除CO2对实验的影响,所使用的配制NaOH溶液和稀释食醋的蒸馏水应经加热煮沸2~3分钟,以尽可能去除溶解的CO2。稀释食醋所用蒸馏水要先煮沸驱赶CO2,是因为碳酸会消耗一定量NaOH溶液,产生误差。食醋标签上所注总酸量均为不少于一定质量,故只讨论低于标签所注的原因。不一致可能的原因有:食醋稀释时体积控制不当,实际稀释倍数大于理论稀释倍数;试样量取体积偏小;滴定终点颜色不足30秒后退去;滴定结束后在碱式滴定管的尖嘴处有气泡等。
