“XXXX片”立项报告
XXX药业集团股份有限公司
20XX.XX
XXX公司 XXX中心 “XXX片”立项报告
目 录
一. 项目概况 01
1.1 立项背景 01
1.2 项目来源 01
1.3 项目简介 01
1.4 项目合作方式 01
二. 产品技术特点 01
2.1 处方组成及分析 01
2.2工艺和质量分析 02
2.2.1 工艺路线分析 02
2.2.2 质量研究及所需设备分析 02
2.3 适应症分析 03
2.4 有效性和安全性分析 06
三. 项目市场相关状况 08
3.1 XXX市场
08 08 3.1.1XXX征发病率 3.1.2 整体市场容量 09
3.1.3 分类市场具体情况 09
3.2 竞争品种分析(主要竞争品种概括见表3) 11
3.3与主要竞争对手的比较分析 13
四. 经济效益分析 13
4.1 投资费用估算 13
4.2 销售预测 13
4.3 经济效益分析 14
五. 风险分析 15
5.1 政策风险 15
5.2 技术风险 15
5.3市场风险 15
六. 项目优、劣势分析 16
七. 建议 16
XXX公司 XXX中心 “XXX片”立项报告
“XXXX片”立项报告
一. 项目概况
1.1 立项背景
为推动公司妇科平台的建设,完善妇科产品线,公司急待开发出疗效确切、安全有效,质量可控的妇科新药。“XXX片”为XXX公司研制的化学药品X类新药,目前已经启动临床试验,经联系对方同意转让,特此推荐立项。
1.2 项目来源
本项目来源于XXX公司。该公司是国内资深药物技术企业,拥有完善的独立研发设施和团队,XXXX年至今该公司持续进行了近XX年的药物技术研发工作,共申请药物技术发明专利XX项等。
1.3 项目简介
【产品名称】XXX片。
【剂 型】片剂。
【规 格】成分XXX:500mg /成分XXX:25mg /成分XXX:15mg。
【适 应 症】XXX综合征。
【用量用法】一次2片,1天3次,5-7天为一个疗程。
【研究进展】XXX年XX月XX日批准临床,目前临床研究已经启动(已召开临床启
动会,确定了参加医院、临床研究方案等。由于未确定具体药品生产企
业,故未进入临床研究)。
【注册分类】化学药品XXX类。
1.4 项目合作方式
一次性转让临床批件,对方报价XXX万(包括制剂和原料)。
二. 产品技术特点
2.1 处方组成及分析
处方组成为:成分一500g,成分二25g,成分三15g及辅料。
该处方中对成分一为苯胺类解热镇痛药,本品特点是镇痛作用缓和而持久,对胃肠道刺激小,不引起出血,比XXXX更为安全。成分二为XXX剂。该药XXX年在美国上市,已列入美国药典,能消除XXX症状。XXXX年,FDA允许OTCXXX药物用于XXX治疗。成分三为H1受体拮抗剂,能特异性地和组胺H1受体结合,而竞争性地阻断组胺的作用, 3
XXX公司 XXX中心 “XXX片”立项报告
常用于XXX等方面的治疗,在本复方制剂中,本品的作用为阻断H1受体,缓解患者的XXX综合症症状。本品于XXXX年被FDA批准作为非处方成分应用。此外,该药能拮抗H1受体而使机体疼痛阈值上升,有独立的镇痛作用。 2.2工艺和质量分析
2.2.1工艺路线分析
◆ 制剂工艺步骤
将XXX加入到热水中,搅拌,放置过夜使充分溶胀,加水至全量配制成粘合剂。将XXX、XXX过100目筛,XXXX过80目筛,上述处方其余辅料均过100目筛备用。按处方量精密称定,以等量递增的方法混合均匀,加入黏合剂制软材,制粒,60℃通风干燥,整粒,加入适量硬脂酸镁,混合均匀。测定颗粒含量,计算片重,压片,包衣即得。
◆ 原料药基本合成路线及介绍

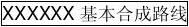
XXXXXX XXXXXX XXXXX
设备要求:无特殊要求
缩合 中和 缩合 XX XX
XXXXXXXXXX XXXXX
设备要求:高温低压(XXX-XXX℃/ 7mmHg)。
注:反应中所涉及的有机溶剂均回收,循环使用或集中处理。反应中所产生的废碱液用酸中和,经处理达到排放标准后排放。
2.2.2质量研究及所需设备分析
本品质量标准所含项目如下:
【检查】 溶出度(HPLC法):取供试品溶液和对照品溶液照含量测定项下的方法测定。分别计算出每片中XXXX、XXX和XXXX的溶出量,限度均为标示量的XXX%,应符合规定。
含量均匀度(HPLC法):依法测定XXXXX含量,应符合规定。
其它:应符合片剂项下有关的各项规定。
4
XXX公司 XXX中心 “XXX片”立项报告
【含量测定】(HPLC法):分别测定XXXXX、XXX、XXXXX的含量,本品含对XXXXX应为标示量的90.0%~110.0%,XXXX应为标示量的90.0%~110.0%,XXXXX应为标示量的90.0%~110.0%
【类别】XXXX药。
【贮藏】密闭保存。
注:公司现有仪器设备能满足以上质量分析方法,不需要另行添加设备。
2.3 适应症分析
本品拥有XXX和XXXX两个适应症,相对于单一XXX适应症产品,具有显著的竞争优势。
2.3.1 适应症一
① 西医阐述
症状、原因、主要治疗药物等
② 中医辨证
中医理论、治疗原则、辩证施治等
2.3.2适应症二
① 西医阐述
症状、原因、主要治疗药物等
② 中医辨证
中医理论、治疗原则、辩证施治等
2.4 有效性和安全性评价
2.4.1 主要药效学试验
XXXX片为XXX与XXX及XXX组成的复方片剂,在美国作为OTC药物使用。该药三种组份联合应用既能有效缓解XXX,又能消除XXXX所引起的各种临床症状,相对于暨有的治疗XXX的药物具有独特的优势。 成分一:又名XXX、XXX,为XXX类XXXX药,XXX类XX药,有较弱的抑制XXX生物合成的作用,OTC产品的组分。临床研究显示:服用XXX的患者对其耐受性良好,治疗量的XXX不良反应少,偶见皮疹、荨麻疹等过敏反应及呕吐、腹痛、厌食等副作用。 成分二:为XXX剂,能降低XXX对盐和水的再摄取,增加XXX流量,其作用比较平缓。该药XXXX年在美国上市,已进入美国药典,能消除XXXX等各种症状,XXXX用于治疗该类症状已有XXXX年左右历史,被指定为OTC产品的组分,用于缓解XXXX。 5
XXX公司 XXX中心 “XXX片”立项报告
成分三:为第一代选择性XX受体拮抗剂,具有多种抗过敏机制:降低血管通透性,治疗皮肤瘙痒症及黏膜水肿;抑制A-V节点传导,治疗面部潮红;抑制平滑肌收缩,治疗支气管哮喘;抑制呼吸道迷走传入神经,治疗呼吸道水肿、鼻塞;抑制血管舒张,治疗血压过低;抑制交感神经冲动,治疗心动过速;联合使用XX受体拮抗剂治疗面部潮红、呼吸道水肿及头痛等。近年来研究表明:连续应用抗组胺药物可降低过敏鼻黏膜炎性物质的产生,并可降低下呼吸道的炎性物质水平。通过小鼠XX法、XX法、XXXX法证明XXXX在选择性拮抗H1受体后产生XX效应,且随剂量增加而加强。
2.4.2药代动力学 成分一:口服吸收迅速、完全,在体液中分布均匀。约有XX%与血浆蛋白结合,小量时(血药浓度<XXμg/ml)与蛋白结合不明显;大量或中毒量则结合率较高,可达XX%。本品口服约XX%在肝脏代谢,约XX%XXXX与XXXX结合,其余XXX%与XXX结合,所有的代谢产物均经肾脏排泄,口服本品后血药浓度XX~XX小时达峰值,血浆分布容积为XXL/kg,作用时间维持XX~XX小时,药物在XX小时内经肾脏完全排泄。 成分二: 通过给健康大鼠XXX口服观察,XX小时内XX%的药物经肾和粪便代谢,只有XX%的药物在实验结束时以原型排除,肾脏是代谢的主要途径,性别或药物剂量不影响药物的代谢。给健康雄性大鼠静脉注射XXXmg/kg或XXXmg/kgXXX后观察,肾脏代谢产物有XXX种放射标记的化合物,主要为XXX。XXX的血清代谢物除XXX外,其余的与肾代谢物相同。XXX的血浆清除半衰期不随药物剂量的变化而改变,不存在剂量依赖性代谢。这些资料显示:XXX的代谢物主要是XXX。健康雄性F-344大鼠口服XXXmg/kg给药时,其血浆清除半衰期为X-XX小时。
2.4.3毒理学资料 成分一:于19世纪开始作为药物使用,因此在大规模开始临床应用前并未做较多系统的毒理学实验研究,后期的实验及临床应用显示,XXX可引起XXX肝脏坏死,大鼠在毒性剂量下可因呼吸衰竭而引起死亡。关于XXX可以引起临床患者的肝脏坏死的报道始见于XXX年,而后陆续出现了XXXX而致紫绀,严重过量者可因急性中毒导致肝坏死,因此该药品服用时不应超过说明书所指定的服用剂量。少数病人长期服用治疗剂量可引起慢性肝、肾损伤,因此肝肾功能不全患者应慎用,药物长期应用还可能导致患者对药物产生依赖性。 成分二:小鼠口服XXX的LD50为XXX mg/kg,作为非处方药XX剂,文献检索未见关于XXX长期毒性、致癌、致突变及人类生殖毒性方面的报道。
6
XXX公司 XXX中心 “XXX片”立项报告
成分三:为第一代XX受体拮抗剂,国外多个国家已使用多年,且于XXX年被美国FDA批准作为非处方(OTC)成分使用。
XXXX口服耐受性好,无严重不良反应;XXX可通过血脑屏障,常可导致头晕、嗜睡等不良反应,车辆驾驶员及从事高空作业等危险工作的人员不宜服用。文献中对XXX只雌雄各半的XXX大鼠进行了每日饮食中分别加入X、XX、XXX或XXXXppmXXX近XX年的长期毒性研究。在该长期毒性研究中,只有XX和XX大鼠的肝脏的组织学改变与服用XXX有关,但未导致临床生化及血清指标检测异常。通过X2年的喂食F344大鼠XXX长期毒性研究证实:XX无明显长期毒性及致癌性。
文献检索未见关于XX长期毒性、致癌、致突变及人类生殖毒性方面的报道。
2.4.4 临床试验
本项目临床研究已经启动,拟在XXX医院、XXX医院、XXX医院、XXX医院、XX医院、XXX医院进行两个适应症的随机、双盲、安慰剂平行对照、多中心临床试验。
三. 项目相关市场状况
3.1 XX及XXX综合征市场
3.1.1XX及XX综合征发病率
据统计,适应症一在XXX中的发病率为XXX%,适应症二发病率为XXX%左右,全国总患者人群约XXX亿多人。
数的调查分析,我国适应症一者占XX%,轻度占XX%,中度占XX%,重度占XX%。其中原发性适应症一占XX%,严重影响工作的患者占XX%。全国XX个省、直辖市XX个市(区)的流行病学调查结果表明,我国常见病患病率顺序依次为XXX疾病XX%、XXX疾病XX%和XXX疾病XX%??。
据报道国外XXX疾病发生率XXX%,英国医学权威机构调查指出:全球XX%有不同程度的XXX。XX大学XX专家XX博士在XXX会议上发言提到:“XXXXXX。
3.1.2整体市场容量
XXX场每年容量为XX亿元,其中XXXX这一板块占据了绝大多数的市场份额。调研资料显示,有疼痛相关症状且服用XXXX产品的人群占XX%,而不服用XXXX产品的人群为XX%。
XXX患者多数以自疗为主,OTC产品占有XXX药物2/3的市场,医院与零售市场的比例为X:X。
7
XXX公司 XXX中心 “XXX片”立项报告
3.1.3 分类市场具体情况
◆ OTC市场特点
① OTC市场由中药、西药、保健品三分天下
常用治疗XX的西药多为XXX类,副作用大,在OTC市场销售处于劣势。中药具有药性温和、副作用小、标本兼治的特点,在OTC市场的销售中居于领先地位;保健品以口感好,形象清新及营销手段的灵活性迎合了消费者的心理,在XXX市场具有较强的竞争力。
② XXXX类用药市场开发程度不高
XX行业研究院《XXXX年中国XXX类产品市场研究报告》数据显示:XXX的患病人数约占患病总人数的XX%,XXX症患者人数所占比例约为XX%,但是XXX类市场规模所占比例只有XXX%,远低于XXX症用药市场所占比重(XX%)。说明XXX类用药市场开发程度不高。
③ 各品类主要品种
1)治疗XXX常用西药(见表1、表2)
表1 治疗XXX常用西药类别及名称

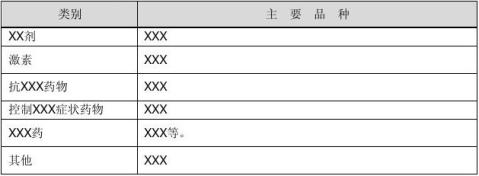
表2 治疗XXX综合征常用西药类别及名称
2)XXX保健品
8
XXX公司 XXX中心 “XXX片”立项报告
有XXX贴、XXX一贴灵、XXX保健枕等。 3)XXXX常用中成药
在中药领域,XXX、XXX等产品是目前市场上较为广泛使用的XXX产品。在终端,XXX和XXXX是店员推荐最为频繁的品种,它们都是走中档价格,在市场上处于领先地位。其中,XXXX为XXX制药出品,其产品国内市场的覆盖率为XXX %,综合市场占有率达到XXX %,占有的市场份额较为可观。可用于XXXX的中成药还有:XXX等。
治疗XXX表现较好的中药是“XXXX”,其主治XXXX症,特别对XXXX等有明显疗效。据了解,“XXX”目前市场占有率XX%,XXX年实现销售额XXXX万元。
◆ 医院用药特征
患者大多会选择去医院,西医轻者XXX,剧烈者XX。但XXX剂治疗XXX在临床上没有任何治疗疾病上的意义,只能达到缓解目的,况且此类药物长期服用会诱发XXXXX。对XXX,使用这类药物往往掩盖了器质性病变。
中成药治疗XXX,关键是根据患者病情进行准确分型,然后对症下药 ,才能收到良好的效果。有的病人症状不典型,应在医生指导下服药,而现有中成药尚难满足临床不同证型患者之需求,医院市场开发程度不高
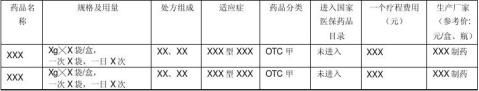
3.2 竞争品种分析(主要竞争品种概括见表3)
SFDA南方所各类XXX中成药零售与医院市场分布表明:
XXX类零售市场占XXX%,而医院市场占XXX%,虽从研究报告中得知以上数据虽然以XXX类用药统计而得,但从下面的竞争品种来看,XXX用药也全部是OTC品种。不难看出,近几年XXX类药物市场的开发主要在非处方药物市场,通过大量广告、终端促销等手段,竞争十分激烈。
OTC市场西药几乎一片空白,主要竞争集中在中药。国内目前尚无女性XXX专用的西药,西医院临床使用的化学药物为通用的XXX类XX药,XX功效明确,但没有其他药理作用,消化道副作用明显,本品在医院用药市场同样面临很大的机会。
表3 市场上治疗XXX主要中药品种
9
XXX公司 XXX中心 “XXX片”立项报告
3.3 与主要竞争对手的比较分析
通过对上述主要竞争品种的分析,“XXXX片”的主要竞争对手为OTC市场上的中成药,即XXX、XX等产品。与这些品种比较,“XX片”优势明显(见表4)。
表4 “XXX片”与中药治疗XX的比较分析

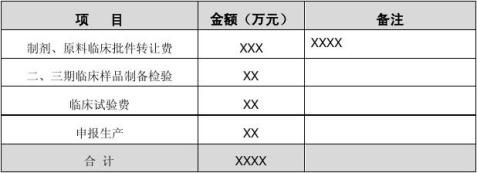
四、经济效益分析 4.1 投资费用估算
本项目为一次性转让临床批件,对方报价XXX万。再加上临床研究及报生产费用,总费用约为XXXX万(见表5):
表5 投资费用估算
4.2 销售预测 4.2.1 单位成本预算 ① 处方中原材料成本
根据对方提供的数据,XXX和XXX的合成成本为XX元/kg和XX元/kg;每片原料药成本为XXX元 /片,每盒原料药成本为XXX元 /XX片。
② 单位成本测算及市场零售价预计
10
XXX公司 XXX中心 “XXX片”立项报告
表6 单位成本测算(单位:元)
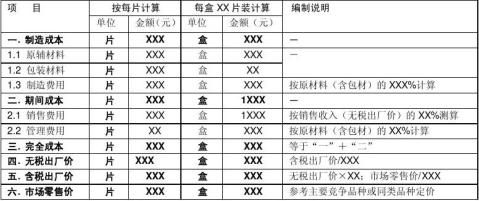
注:由于目前国内无同类西药上市,市场零售价XXXX是项目转让方提供的参考价。
4.3 经济效益分析
按现有XXX%的销售费用率计,该产品销售XXX万和XX万时,其利润贡献见下表(单位:万元):
表7 自营销售利润测算

五、风险分析 5.1 政策风险
参照《药品注册管理办法》,该项目转临床批件不存在政策上的风险。
11
XXX公司 XXX中心 “XXX片”立项报告
5.2 技术风险
根据目前对方提供的资料,本品在工艺、质量上不存在太大的问题。对方已初步联系好可接收原料药转让的厂家,公司没有原料合成车间和设备,需要与转让方进一步协商原料药的落户问题及后续操作。
另外,鉴于目前国内项目技术研发状况和水平,对方也可能未提供真实资料和数据,存在隐瞒本项目存在缺陷等问题,建议进行实地考察,最大程度规避风险。
5.3 市场风险
许多XXXX的中成药功能主治中都有XX或XX字样,但以治疗XX为主的品种,在国家药监局注册的除上述品种外,还有XX、XX、XXX以及其改剂型品种,均为药典所收载的老品种或卫生部药品标准中成药。
治疗XX为主的中成药开发的不多,除几个老品种改剂型外,XXX年以来药监局批准生产的XX类以上新药仅有2个XX和XXX,批准临床研究的有XXX.
以上品种均为中药,对本品不会造成很大的竞争,关键在于我们与转让方签订转让合同之后加快临床和申报生产的进度,抓紧时间尽快上市,抢先占领市场。
六、项目优劣势分析
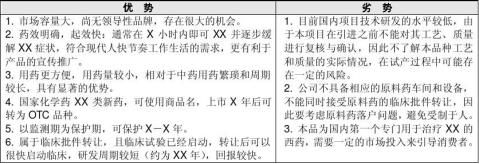
七. 建议
本品为西药复方制剂,符合公司项目引进方向,而且与目前市售品种相比优势明显,推荐公司立项引进。
XXXXX
20XX年XX月 12
