医疗器械临床评价报告
(资料-7)
XXXXXXXXXXX
临床评价报告
一、 概述
我公司(XXXXXXXX)研制开发的XXXXXXXXXXX供临床XXXXXXX用。
根据《医疗器械分类目录》的规定,XXXXXXXXXXX为 第二类注射穿刺器械,类别代号为:6815。目前国内已有多个同类产品注册上市,广泛应用多年,其临床上的安全性、有效性早已得到确认。
二、 产品设计
本产品XXXXXXXX。
三、 工作原理
XXXXXXXXXXX的工作原理是按无菌操作要求,撕开注射器单包装,去掉注射器保护套,抽取、溶解或配制药液用。
四、 市场概况
现在市场销售的同类产品主要有XXXXXXXXXXX等。这些产品在使用过程未发生过任何意外事故的报道;其中本公司的XXXXXXXXXXX产品与国内厂家工作原理基本相同。XXXXXXXXXXX为列入《免于进行临床试验的医疗器械目录》产品,现将申报产品与《目录》所述内容进行对比以判定申报产品是否为列入《目录》产品。
申报产品与《目录》产品的对比表
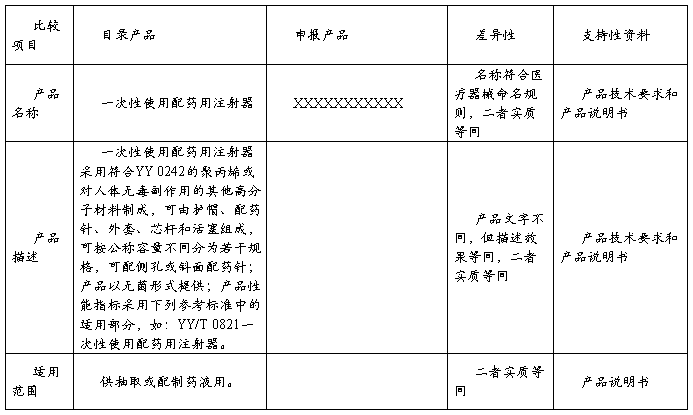
注:支持性资料是指申报产品与《目录》产品的差异性对申报产品的安全有效性不产生影响的理由和依据,可以附件的形式提供。
五、 对比产品选择
现以与同类已上市产品进行对比评价,说明我公司产品在临床使用的安全性、有效性。
选择与我司产品类似,且同样按二类医疗器械产品注册的上海金塔医用器材有限公司XXXXXXXXXXX。
六、 主要对比情况说明
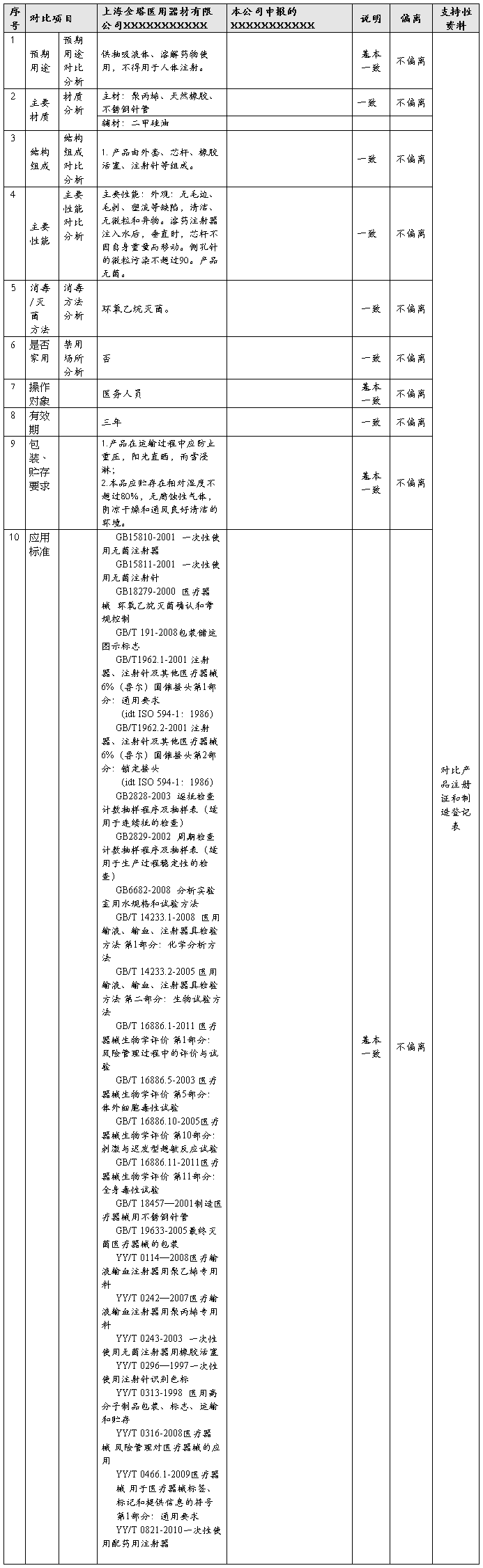
七、 与上海金塔医用器材有限公司产品对比结果
通过上述对本公司产出的XXXXXXXXXXX和上海金塔医用器材有限公司生产的产品作对比分析,两款产品在工作原理、产品材质、结构组成、主要技术性能指标、消毒/灭菌方法、预期用途、是否家庭使用等方面均相似或一致,此两款产品为实质性等同产品。
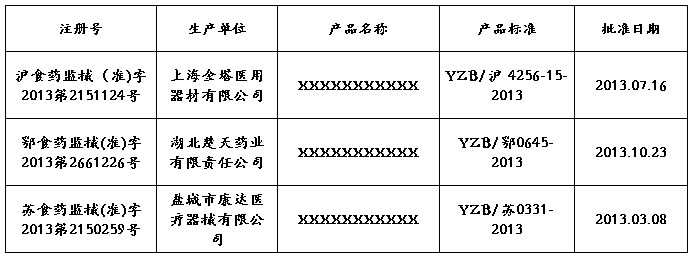
八、 中国政府已批准同类产品在境内上市的查询文件
经从国家食品药品监督管理局官方网站http://www.sfda.gov.cn/数据查询,共有该类产品信息:国产XXXXXXXXXXX6条,现随机摘录其中产品结构、性能原理与本公司基本一致的、已注册的部分产品如下:
九、 国内外同类产品临床文献资料。
在刘彦荣、 张丽华、 李贤、 谷聚爱¹的研究中显示, 用注射器抽吸药液是护士临床工作最基本、最常用的技术操作之一, 也是包括医师在内的医护人员必须掌握的基本功。目前, 静脉输液有成倍增长的趋势, 护士配制药液时,如何选用合适的加药注射器, 将药液安全、及时、准确地注入患者体内成为护理工作者研究的焦点。三指法及五指轮换法抽吸药液不仅简单易行、省时节力, 而且具有很强的实用性及操作性。三指法与教科书法比较具有操作稳定性好、药液不易撒漏、吸药快、污染率低, 护生易于掌握等优点, 特别适合5ml以下药液的抽吸。护士在临床工作中, 可有目的地选择抽吸药液方法及注射器。抽吸5ml以下药液时, 可选用三指法;抽吸6 ~ 20ml药液时, 可选用五指轮换法;抽吸安瓿药液时, 选用斜口型注射器;抽吸密封瓶药液时, 选用侧口型注射器。尽最大可能减少药液流洒, 减少药液残余量, 避免微粒污染, 防止药液浪费, 减轻患者经济负担。
在朱爱萍²的研究也提到通过监测配药护士不同的手卫生状况对配药注射器细菌污染情况的影响,为加强配药护士手卫生管理提供科学依据。方法采用对照实验研究方法,选取某院配药护士手卫生及不同时段的配药注射器作为研究对象,随机分为实验组与对照组,对实验组护士进行手卫生干预,观察两组配药注射器细菌污染情况。结果两组护士手卫生样本不合格率、配药注射器污染率、使用中的配药注射器检出细菌起始时间等各项观察指标比较,差异均具有统计学意义(P<0.01)。结论通过进行手卫生干预,可明显控制配药护士的手对配药注射器的污染。配药注射器使用时限以不超过3h为宜。
十、 评价结论
XXXXXXXXXXX,作为第Ⅱ类医疗器械产品,并且已经列入《免于进行临床试验的医疗器械目录》,其工作(作用)机理明确、设计定型、工艺成熟、临床应用广泛,且未见严重不良事件记录和/或产品缺陷。我公司XXXXXXXXXXX产品安全性、有效性的性能指标已在医疗器械产品技术要求中得以建立,并且本公司的XXXXXXXXXXX与上海金塔医用器材有限公司已上市的同类产品作对比分析,两款产品在工作原理、产品材质、结构组成、主要技术性能指标、消毒/灭菌方法、预期用途、是否家庭使用等方面均相似或一致,此两款产品为实质性等同产品。因此,其有效性、安全性、可操作性均达到预期目的,符合临床使用的要求。
因此,该申报产品的生产与使用技术成熟,其功能原理、临床预期使用效果在相关的临床应用领域已经得到充分肯定。
综上所述,XXXXXXXXXXX能够满足预期的用途,并可保证其临床使用的安全性和有效性。
附件:XXXXXXXXX注册证和制造登记表
【参考文献】
第二篇:内部控制评价报告模板
××股份有限公司20××年度内部控制评价报告
××股份有限公司全体股东:根据《企业内部控制基本规范》等法律法规的要求,我们对本公司(下称“公司”)内部控制的有效性进行了自我评价。
一、董事会声明
公司董事会及全体董事保证本报告内容不存在任何虚假记载、误导性陈述或重大遗漏,并对报告内容的真实性、准确性和完整性承担个别及连带责任。
建立健全并有效实施内部控制是公司董事会的责任;监事会对董事会建立与实施内部控制进行监督;经理层负责组织领导公司内部控制的日常运行。
公司内部控制的目标是:〔一般包括合理保证经营合法合规、资产安全、财务报告及相关信息真实完整,提高经营效率和效果,促进实现发展战略〕。由于内部控制存在固有局限性,故仅能对达到上述目标提供合理保证。
二、内部控制评价工作的总体情况
公司董事会授权内部审计机构〔或其他专门机构〕负责内部控制评价的具体组织实施工作,对纳入评价范围的高风险领域和单位进行评价〔描述评价工作的组织领导体制,一般包括评价工作组织结构图、主要负责人及汇报途径等〕。
公司〔是/否〕聘请了专业机构〔中介机构名称〕实施内部控制评价,并编制内部控制评价报告;公司〔是/否〕聘请会计事务所〔会计师事务所名称〕对公司内部控制有效性进行独立审计。
三、内部控制评价的依据
本评价报告旨在根据中华人民共和国财政部等五部委联合发布的《企业内部控制基本规范》(下称“基本规范”)及《企业内部控制评价指引》(下称“评价指引”)的要求,结合企业内部控制制度和评价办法,在内部控制日常监督和专项监督的基础上,对公司截至20××年12月31日内部控制的设计与运行的有效性进行评价。
四、内部控制评价的范围
内部控制评价的范围涵盖了公司及其所属单位的各种业务和事项,重点关注下列高风险领域:〔列示公司根据风险评估结果确定的前“十大”主要风险〕纳入评价范围的单位包括:〔描述公司及其所属单位的明确范围〕纳入评价范围的业务和事项包括(根据实际情况充实调整):(一)组织架构(二)发展战略(三)人力资源(四)社会责任(五)企业文化
(六)资金活动(七)采购业务(八)资产管理(九)销售业务(十)研究与开发(十一)
工程项目(十二)担保业务(十三)业务外包(十四)财务报告(十五)全面预算(十六)合同管理(十七)内部信息传递(十八)信息系统上述业务和事项的内部控制涵盖了公司经营管理的主要方面,不存在重大遗漏。
(如存在重大遗漏)公司本年度未能对以下构成内部控制重要方面的单位或业务(事项)进行内部控制评价:〔逐条说明未纳入评价范围的重要单位或业务(事项),包括单位、或业务(事项)描述、未纳入的原因、对内部控制 评价报告真实完整性产生的重大影响等〕
五、内部控制评价的程序和方法
内部控制评价工作严格遵循基本规范、评价指引及公司内部控制评价办法规定的程序执行〔描述公司开展内部控制检查评价工作的基本流程〕。
评价过程中,我们采用了(个别访谈、调查问题、专题讨论、穿行测试、实地查验、抽样和比较分析)等适当方法,广泛收集公司内部控制设计和运行是否有效的证据,如实填写评价工作底稿,分析、识别内部控制缺陷〔说明评价方法的适当性及证据的充分性〕。
六、内部控制缺陷及其认定
公司董事会根据基本规范、评价指引对重大缺陷、重要缺陷和一般缺陷的认定要求,结合公司规模、行业特征、风险水平等因素,研究确定了适用本公司的内部控制缺陷具体认定标准,并与以前年度保持了一致〔描述公司内部控制缺陷的定性及定量标准〕,或作出了调整〔描述具体调整标准及原因〕。
根据上述认定标准,结合日常监督和专项监督情况,我们发现报告期内存在〔数量〕个缺陷,其中重大缺陷〔数量〕个,重要缺陷〔数量〕个。重大缺陷分别为:〔对重大缺陷进行描述,并说明其对实现相关控制目标的影响程度〕。
七、内部控制缺陷的整改情况
针对报告期内发现的内部控制缺陷(含上一期间未完成整改的内部控制缺陷),公司采取了相应的整改措施〔描述整改措施的具体内容和实际效果〕。对于整改完成的重大缺陷,公司有足够的测试样本显示,与重大缺陷〔描述该重大缺陷〕相关的内部控制设计且运行有效(运行有效的结论需提供90天内有效运行的证据)。
经过整改,公司在报告期末仍存在〔数量〕个缺陷,其中重大缺陷〔数量〕个,重要缺陷〔数量〕个。重大缺陷分别为:〔对重大缺陷进行描述〕。
针对报告期末未完成整改的重大缺陷,公司拟进一步采取相应措施加以整改〔描述整改措施的具体内容及预期达到的效果〕。
八、内部控制有效性的结论
公司已经根据基本规范、评价指引及其他相关法律法规的要求,对公司截至20××年12月31日的内部控制设计与运行的有效性进行了自我评价。
(存在重大缺陷的情形)报告期内,公司在内部控制设计与运行方面存在尚未完成整改的重大缺陷〔描述该缺陷的性质及其对实现相关控制目标的影响程度〕。由于存在上述缺陷,可能会给公司未来生产经营带来相关风险〔描述该风险〕。
(不存在重大缺陷的情形)报告期内,公司对纳入评价范围的业务与事项均已建立了内部控制,并得以有效执行,达到了公司内部控制的目标,不存在重大缺陷。
自内部控制评价报告基准日至内部控制评价报告发出日之间〔是/否〕发生对评价结论产生实质性影响的内部控制的重大变化。〔如存在,描述该事项对评价结论的影响及董事会拟采取的应对措施〕。
我们注意到,内部控制应当与公司经营规模、业务范围、竞争状况和风险水平等相适应,并随着情况的变化及时加以调整。〔简要描述下一年度内部控制工作计划〕未来期间,公司将继续完善内部控制制度,规范内部控制制度执行,强化内部控制监督检查,促进公司健康、可持续发展。
董事长:(签名)××股份有限公司20××年××月××日
