PCR扩增及DNA琼脂糖凝胶电泳
刘琳 1131428 环境科学
一、实验目的
1.学习并掌握PCR扩增的基本原理与实验技术。
2.对扩增后的DNA进行琼脂糖凝胶电泳试验,并分析相应结果。
二、实验原理
1. PCR扩增
多聚酶链反应(PCR)技术的原理类似于DNA的天然复制过程。在微量离心管中加入适量缓冲液,加入微量模板DNA、四种脱氧核苷酸(dNTP)、耐热Taq聚合酶及两个合成DNA的引物,而后加热使模板DNA在高温下(94℃)变性,双链解链,这是所谓变性阶段。降低溶液温度,使合成引物在低温(55℃)与模板DNA互补退火形成部分双链,这是所谓退火阶段。溶液反应温度升至中温(72℃),在Tap酶作用下,用四种dNTP为原料,引物为复制起点,模板DNA的一条双链在解链和退火之后延伸为两条双链,这是延伸阶段。如此反复,在同一反应体系中可重复高温变性、低温退火和DNA合成这一循环,使产物DNA重复合成,并在重复过程中,前一循环的产物DNA可作为后一循环的模板DNA而参与DNA的合成,使产物DNA的量按指数方式扩增。经过30~40个循环,DNA扩增即可完成。
2. DNA琼脂糖凝胶电泳实验
DNA分子在高于其等电点的溶液中带负电,在电场中向阳极移动。在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即分子本身的大小和构型是主要的影响因素。DNA分子的迁移速度与其相对分子量成反比。不同构型的DNA分子的迁移速度不同。该电泳方法以琼脂凝胶作为支持物,利用DNA分子在泳动时的电荷效应和分子筛效应,达到分离混合物的目的。
三、实验材料
仪器:PCR扩增仪、0.2ul薄壁管、1.5ml离心管、移液枪、枪头、微波炉、电泳仪、水平电泳槽、制胶版、紫外透射仪。
试剂: TapDNA聚合酶、dNTP、buffer、两种引物、16S全长DNA样本、无菌ddH2O、模板DNA 、TBE、琼脂糖、EB、显色剂。
四、 实验步骤
1. PCR扩增
本次试验选择细菌16S rDNA V3区片段进行扩增。
1.1 根据计算,首先取1.5ml离心管按照2.5ul 10×Buffer 、1 ul dNTP、0.5 ul 341GC、0.5 ul 534、0.125 ul Taq、19.375u ddH2O的比例配置足量的PCR反应体系。
1.2 分别向9个薄壁管中分别加入24 ul的反应体系,并分别添加8种不同的模版,并于第9个薄壁管中加入无菌ddH2O作为阴性对照。
1.3 将薄壁管放入PCR扩增仪中,按照预定程序进行PCR扩增。其中循环过程需要达到30~40次。程序如下:
预变性: 94℃ 3min
循环: 94℃ 变性30s
55℃ 退火30s
72℃ 延伸30s
末次延伸:72℃ 5min
1.4 PCR扩增完成后,将样品取出并保存于15℃环境中。
2. DNA琼脂糖凝胶电泳实验
2.1称取0.2g琼脂糖粉末,放到一锥形瓶中,加入适量的0.5×TBE电泳缓冲液。然后置微波炉加热至完全溶化,溶液透明。摇匀,待冷却至60℃左右,在胶液内加入适量的EB。
2.2 取有机玻璃制胶板槽,在一端插好梳子,在槽内缓慢倒入已冷至60℃左右的胶液,使之形成均匀水平的胶面。
2.3 待胶凝固后,小心拔起梳子,使加样孔端置阴极段放进电泳槽内。
2.4 在槽内加入0.5×TBE电泳缓冲液,至液面覆盖过胶面。取1μl缓冲液和5μl待测DNA样品混合后,用移液枪滴加至凝胶的加样孔中。
2.5 接通电泳仪和电泳槽,并接通电源,调节稳压输出,电压最高不超过5V/cm,开始电泳。点样端放阴极端。根据经验调节电压使分带清晰。
2.6 观察溴酚兰的带(蓝色)的移动。当其移动至距胶板前沿约1cm处,可停止电泳。
2.7 在紫外透视仪的样品台上重新铺上一张保鲜膜,赶去气泡平铺,然后把凝胶放在上面。关上样品室外门,打开紫外灯,通过观察孔进行观察。
五、实验结果与讨论
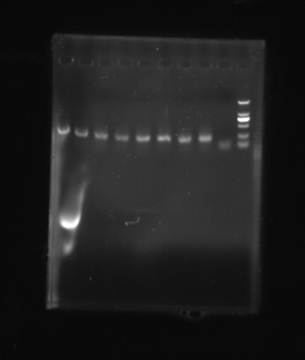 如图所示:从左至右,分别是模版1-8号,第9列为阴性对照。
如图所示:从左至右,分别是模版1-8号,第9列为阴性对照。

 前8列均有明显的条带出现,而阴性对照无显示,说明扩增整体效果很好。图中有上下两条线,上面一条线所覆盖的条带基本可以代表扩增的产生的片段位置,参照图可以看出扩增片段在200bp左右。在第9个阴性对照的第二条线处可以看到较为模糊的条带,并非是出现假阴性,而是由于二聚物而产生的条带。通过该条带与最右侧的marker对比可知该片段出现在100bp左右,并非由于实验操作等问题而产生的污染。
前8列均有明显的条带出现,而阴性对照无显示,说明扩增整体效果很好。图中有上下两条线,上面一条线所覆盖的条带基本可以代表扩增的产生的片段位置,参照图可以看出扩增片段在200bp左右。在第9个阴性对照的第二条线处可以看到较为模糊的条带,并非是出现假阴性,而是由于二聚物而产生的条带。通过该条带与最右侧的marker对比可知该片段出现在100bp左右,并非由于实验操作等问题而产生的污染。
实验的照片显示实验结果有拖尾现象,但是并不影响后续实验。在实验过程中由于有些试剂加到了管壁上面,并没有完全加入,可能会出现一些误差。另外在第1列条带中出现了其他的亮带,可能是由于在前期的扩增实验中滴加试剂时由于量过少而进行的摇匀和融合等操作产生了非特异性扩增,也有可能是因为胶板制作过程中梳子的位置不合适或者胶板制作时边缘处不够均匀导致产生污染。但总体而言,实验结果较为满意。
六、实验注意事项
1.由于PCR技术非常敏感,可使一个DNA分子得以扩增,装有PCR试剂的离心管打开之前,应先在微量离心机上作瞬间离心使液体沉积于管底。PCR扩增反应的条件,要控制好温度、时间和循环次数。
2.最好在加完所有其它反应成分后才加模板DNA。
3.配琼脂糖时应使其完全溶化后方可制胶。
4.EB具有致癌作用,配制及使用时应带一次性手套。并在专门的实验室内使用。
七、实验收获
1.通过本次实验学习并掌握了PCR反应的基本原理、实验过程及技术。
2.通过本次实验掌握了电泳实验分离DNA的原理和方法。
八、思考题
1、如果你的研究中要扩增大肠杆菌某个酶的基因,你如何进行相关实验?
通过PCR扩增出想要的片段,然后通过凝胶电泳实验进行回收,并与合适的载体连接,转化进感受态细胞。经过培养提取质粒,进行酶切或PCR验证,测序最终验证,保存菌种
2.一对引物序列为5‘-GACTCCAGTCGAATCTACCA-3’和5‘-AACCGTGGCGACACCGCTAA请计算它们的Tm值及选择合适的退火温度,如果按你算的退火温度做PCR时没有得到相应的产物,你怎么解决?
5‘-GACTCCAGTCGAATCTACCA-3’
Tm值=4(G+C)+2(A+T)-(5~10℃)
=4(3+7)+2(6+4)-(5~10℃)
=60℃-(5~10℃)
=50~55℃
5‘-AACCGTGGCGACACCGCTAA’
Tm值=4(G+C)+2(A+T) -(5~10℃)
=4(5+7)+2(6+2) -(5~10℃)
=64℃-(5~10℃)=54~59℃
因此退火温度可以选择在55℃
可以通过分析几个逐步提高退火温度的反应以提高特异性。开始低于估算的Tm5℃,以2℃为增量,逐步提高退火温度。较高的退火温度会减少引物二聚体和非特异性产物的形成。为获得最佳结果,两个引物应具有近似的Tm值。引物对的Tm差异如果超过5℃,就会令引物在循环中使用较低的退火温度而表现出明显的错误起始。如果两个引物Tm不同,将退火温度设定为比最低的Tm低5℃ 或者为了提高特异性,可以在根据较高Tm设计的退火温度先进行5个循环,然后在根据较低Tm设计的退火温度进行剩余的循环。这使得在较为严紧的条件下可以获得目的模板的部分拷贝。
第二篇:基因扩增(PCR)实验室
基因扩增(PCR)实验室
辽阳鑫宇实验室设备安装工程有限公司技术部
前 言
基因扩增检验实验室一文,是根据国家有关法律、法规和技术规范,进行选编、择录和收集有关资料、文章而编写的。选编和择录有关技术规范等,如有错误是编著人理解有误,编者表示歉意。
本文的平面图由黄海江、效果图赵玉、录入周悦同志完成。 柏松枫、何兴福、张璐、张伟卓、赵馨、赵俨、熊洁萌等编写。陈洪柱参与校对。
总经理郎宪明(高级工程师)编导。
本文为内部参阅资料,仅供参考。
20xx年2月
- 2 -
基因扩增(PCR)实验室
基因扩增检验方法(简称PCR)灵敏度高、特异性强、精确快捷、适用范围广等特点。在生物学、医学科学研究、转基因产品、临床检测、疾病与动物疫病预防和控制、公安侦查等相关专业和学科广为应用。但是,PCR检验实验室应用时需保证实验安全、设置合理的实验室、规范的操作程序和严格的管理制度。
近几年,对PCR实验室建设越来越得到重视,因为对检测结果的可靠性、准确性和安全性起到至关重要作用,PCR实验室设计核心问题是如何避免污染。实验室的平面布局、空调通风系统运行、气流控制等都是围绕防止污染这个核心进行设计和建设。
1. PCR实验室组合形式
PCR实验室可以是分散形式,也可以是组合形式,现在主要是以组合形式为主。
1.1 分散形式PCR实验室
各功能区间分散,又有一定的间距,不会造成区间干扰,因此没有特定要求。由于工作流程的不便利,在新组建的PCR实验室时往往不被采用。
1.2 组合形式PCR实验室
在较大空间实验用房相邻布置依次划分各功能区域,形成一个组合形式完成基因扩增分析的PCR实验室,各区间在物理空间上完全相 - 3 -
互独立,各区间无论是在空间还是在使用中,始终处于完全的分隔状态。但是,各实验区间集中布置,容易造成相互干扰,因此对总体布局以及屏障系统具有一定要求。对实验室的空调通风系统、气流流向、大气压力、人物流程等方面,在实验室设计和装修上需进行合理考虑。 2. PCR实验室的区域设计
2.1 PCR实验室分区
PCR实验室可分两个工作区域:核酸扩增前区和核酸扩增后区。核酸扩增前区包括试剂准备区和样品处理区,设在不同房间或区域;核酸扩增后区包括扩增区和产物分析区,设在不同房间或区域。
2.1.1 PCR实验室根据使用仪器的功能合理设置各个区域,如采用聚合酶联反应:则设置试剂储存和准备区、标本制备区、扩增区、扩增产物分析区四个单独的工作区域。样品需要粉碎处理的,还需增设样品粉碎区;若使用实时荧光PCR法:基因扩增区、基因产物分析区可以合并;采用标本处理、核酸提取及扩增检测为一体的全自动化PCR分析仪,则标本制备区、扩增区、扩增产物分析区可合并为一个区域,因此PCR实验室原则上设置五个区或四个区或三个区或二个单独的工作区。
2.1.2 核酸扩增前区和核酸扩增后区可设在一个房间内,但必须在满足下列要求的前提下:
2.1.2.1 核酸扩增前区实验室内设置两个不同位置的实验区,试剂配置在超净工作台中操作,样品处理在生物安全柜内操作。
2.1.2.2 在核酸扩增后区使用全封闭的扩增和检测系统时,如 - 4 -
实时荧光PCR仪等。
2.1.2.3 每个实验人员使用各自的试剂、耗材、移液器和盛放污染物的盛器。
2.1.2.4 在实验前后对操作区域和共享器具进行清洁及消毒。
2.1.2.5 各区域的试剂、器具、仪器和设备为该区专用,不得交叉使用。
2.2 PCR实验室各区域功能:
2.2.1 试剂储存和准备区:扩增试剂的制备、试剂的分装和扩增反应混合液的制备以及离心管、吸头等消耗品的储存和准备。
2.2.2 标本制备区:样品登记、处理和分装;核酸(RNA/DNA)提取、保存和使用;PCR扩增的第一轮加样。对于涉及样本的操作应符合生物安全二级实验室防护标准或更高。
2.2.3 基因扩增区:cDNA合成和DNA扩增。如果在此区进行套式PCR的第二轮加样,应在PCR防护罩内进行。
2.2.4 扩增产物分析区:扩增产物的电泳、杂交、成像、序列测定、变性高效液相分析、结果分析、登记及报告。
2.3 工作区域设备和仪器的配置。
2.3.1 试剂储存和准备区
2-8℃和-20℃以下的冰箱、普通离心机、超净工作台、混匀器、微量加样器(覆盖0.2-1000μL),消耗品(一次性手套、耐高压处理的离心管和加样吸头)、专用工作服工作鞋(套)、专用办公用品和废弃物容器、可移动紫外线灯。
- 5 -
2.3.2 标本制备区
2-8℃冰箱、-20℃(或-80℃)冰箱,生物安全柜、高速制冷离心机(台式)、混匀器、恒温水浴箱或加热模块、制冰器或制冷模块、微量加样器、消耗品(一次性手套、耐高压处理的离心管和加样吸头)、专用工作服工作鞋(套)、上下水设备、专用办公用品和废弃物容器、紫外线杀菌灯。如需处理大分子的DNA 应具有超声波水浴仪。
2.3.3 扩增区
核酸扩增仪、微量加样器、消耗品(一次性手套、耐高压处理的离心管和加样吸头)、专用工作服工作鞋(套)、专用办公用品和废弃物容器、紫外线杀菌灯。
2.3.4 扩增产物分析区
视检验方法不同而定,基本配置如下:电泳仪、电泳槽、摄影/像设备、变性高效液相分析仪、测序仪、紫外透射仪、普通冰箱、离心机、恒温水浴、微波炉、上下水设备、紫外线灯、微量加样器、消耗品(一次性手套、耐高压处理的离心管和加样吸头)、专用工作服工作鞋(套)、专用办公用品和废弃物容器。
各区域设备和仪器的配备,应根据使用的扩增检测技术或试剂特点,对设备和仪器进行必要的增减。
2.4 PCR实验室单向流流向制度
2.4.1 实验室的空气单向流流向应该为:试剂储存和准备区→样品制备区→扩增区→扩增产物分析区,不得逆向流动。扩增前区保 - 6 -
持微(弱)正压状态,扩增后区保持微(弱)负压状态。
2.4.2 实验用品单向流工作流向应该为:试剂储存和准备区→样品制备区→扩增区→扩增产物分析区,不得逆向进行。实验用品包括实验材料(试剂、样品和扩增产物)、实验器材(容器、板架、实验服装、帽子、口罩、手套、鞋套)、办公用品(记录纸、笔)、以及清洁工具等。物品的传送是通过互锁式传递窗传递。
2.4.3 实验人员单向工作流流向应该为:进入各工作区域严格按照试剂储存和准备区→样品制备区→扩增区→扩增产物分析区单一方向进行,不得逆向走动。原则上实验人员应在扩增后区工作后当天不得再返回扩增前区工作。在标本制备区由于加样的操作中可能会发生气溶胶污染,所以应避免或减少在本区内不必要的走动。
2.4.4 实验室的单向清洁流流向应当为:试剂储存和准备区→样品制备区→扩增区→扩增产物分析区的方向进行。不同的实验区域应当有各自的清洁用具,以防止交叉污染。
2.5 PCR实验室工作基本原则和实验室各区域工作注意事项
2.5.1 严格的实验室分区制度;各区域必须有明确的标记,只用于特定的操作,不得从事其他工作;不同区域的设备物品(仪器、设备、材料、清洁工具),不得交叉使用。
2.5.2 不同工作区域使用不同工作服(例如不同颜色),工作人员离开工作区域时,不得将工作服带出。
2.5.3 实验前移入所需试剂、耗材、样品以及盛放污染物的容器。
- 7 -
2.5.4 试剂储存和准备区:储存试剂和用于标本制备的消耗品等材料须直接运送至本区,不能经过扩增检测区。试剂盒中的阳性对照品及质控品不能保存在本区,应当保存在标本制备区。
2.5.5 标本制备区:由于在样品混合、核酸纯化过程中可能会发生气溶胶所致污染,可通过在本区内设正压条件,避免从邻近区域进入本区的气溶胶污染。为避免标本间的交叉污染,加入待测核酸后,必须盖好含反应混合液的反应管。对具有潜在传染危险性的材料,必须在生物安全柜内操做,并有明确的标本处理和灭活程序。
2.5.6 扩增区:为避免气溶胶所致的污染,应当尽量避免或减少本区内的人员不必要的走动。必须注意所有经过检测的反应管不得在本区内打开。
2.5.7 扩增产物分析区:核酸扩增后产物的分析方法较多,如膜上或微孔板或芯片上探针杂交方法(放射性核素标记或非放射性核素标记)直接或酶切后琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳
southern转移、核酸测序方法、质谱分析等。本区是最主要的扩增产物污染来源,因此,必须注意避免通过本区物品及工作服将扩增物带出。在使用PCR-ELISA方法检测扩增产物时,必须使用洗板机洗板,废液必须收集在1moL /L HCL中,不能在实验室内倾倒,应当远离PCR实验室的地方弃掉。用过的吸头也必须放在1moL/L HCL中侵泡后再放到废弃物容器或垃圾袋中按程序处理。
2.5.8 工作结束过后,须对工作区进行清洁处理:对工作区域的实验台面进行清洁消毒(如使用次氯酸钠),实验台面采用紫外线 - 8 -
照射更为方便、效果更佳。由于紫外线照射的距离和能量对于去污的效果非常关键,可使用移动紫外线灯(254nm波长),在工作完成后调至实验台面上60-90cm范围内照射。由于扩增产物仅几百和几十碱基对(bp),对紫外线损伤不敏感,因此紫外线照射扩增片段必须延长照射时间,最好是照射过夜。
由于本区有可能会用到某些可致基因突变和有毒物质,如溴化乙锭、丙烯酰胺、甲醛或放射性核素等,故应当注意实验人员的安全防护。
3. PCR实验室建设与装修
3.1根据使用采用仪器的不同确定五个或四个或三个或二个区域,各区域必须设置缓冲间,缓冲间宜设正压,使室内空气不流向室外,室外空气不流向室内,以减少室内外空气交换。也可设专用走廊,但缓冲间比专用走廊更为重要。
3.2 PCR实验室空气流向,可按照试剂储备和准备区→标本制备区→扩增区→扩增产物分析区方向进行空气压力递减方式控制气流流向,防止扩增产物顺空气气流逆向进入扩增前的区域。也可通过负压排风装置、排风扇或其它可行的方式进行。
3.3压差与净化级别
3.3.1 试剂贮存和准备区、样品处理区应设微正压,以防止外界核酸气溶胶的进入,造成污染,可以通过空气进风风量的大于排风量达到正压效果。
3.3.2 核酸扩增区、产物分析区应设微负压,防止含核酸的气 - 9 -
溶胶扩散出去而污染试剂与样品,造成假阳性结果,可以通过控制排风风量大于进风风量达到负压效果。
3.3.3 PCR实验室并没有严格的净化要求,若需要一般采用净化级别8或9级(即万级或十万级)。
3.4 PCR实验室空调通风系统及压力控制
为避免各个实验区域间交叉感染的可能性,宜采用全送全排的气流组织形式。同时要严格控制送排风的比例,以保证各实验区的压力要求。
3.4.1 试剂储存和准备区:因为该区主要进行的操作为储存试剂的制备、试剂的分装和主反应混合液的制备,对于气流压力的控制,本区没有严格要求,但宜采用微正压。
3.4.2 标本制备区:该区域主要进行的操作为标本的保存、核酸(RNA、DNA)提取、储存即加入至扩增反应管和测定RNA和DNA的合成体。本区的压力梯度要求与相对相邻近区域为正压,是为避免从邻近区进入本区气溶胶污染。
3.4.3 扩增区:扩增反应混合物配制和扩增反应,该区域主要进行的操作为DNA和CDNA扩增。此外,已制备的DNA模板和合成的CDNA(来自标本制备区)的加入和主反应混合液(来自试剂储存和制备区)制备成反应混合液等也可在本区内进行。在巢式PCR测试中,通常在第一轮扩增后必须打开反应管,因为巢式扩增有较高的危险性,第二次加样必须在本区内进行。因此,本区压力梯度要求为相对邻近区域为负压,以避免气溶胶从本区泻出。
- 10 -
3.4.4 扩增产物分析区:该区域主要进行的操作为扩增片段的测定(根据所使用的分析仪器的不同此区域与扩增区可以合并为一个区),本区是主要扩增产物污染来源,因此对本区域的压力梯度要求相对于邻近区域应为负压,以避免扩增产物从本区域扩散至其他区域。
4. PCR实验室污染的预防与控制
PCR实验室设计的核心问题是如何避免实验室污染。常见的污染有以下几种:天然基因组DNA的污染、试剂的污染以及标本间(样品)的污染。由于一旦发生污染,实验就必须停止,直至查到污染源为止,而且实验结果必须作废,需重新进行实验,不仅浪费人力、物力,而且也延长了实验结果的报告时间。实验室一旦发生污染,寻查污染源是一件很繁琐的事情,因此要避免污染,首先是预防污染的发生,而不是发生了再研究如何排除。
避免污染的发生,应注意:
4.1工作区域的严格划分
4.1.1 各个区域的合理设置
4.1.2 各个试验区域须有明显的标记(如醒目的门牌或不同的地面颜色),以避免各个不同的实验区域设备、物品、试剂等发生混淆。
4.2 合理的系统设置
4.2.1 合理的空调通风系统设置,应尽量采用全送全排的空调系统(扩增区和产物分析区更为重要)。
- 11 -
4.2.2 严格的气流压力控制,保证不同的实验区域内不同的压力梯度。
4.2.3 严格保证合理的气流流程工艺,保证核酸扩增后区的气流不逆向流入核酸扩增前区。
4.3 严格的实验室配套设施
完备的实验室配套实施是保证实验工作的必备条件,应根据各个区域功能配备相应的设备和仪器,如生物安全柜、超净工作台、离心机等。
避免PCR实验室的污染除了实验室在设计上应注意工作区域的严格划分、合理的系统设置、完备的配套设施外,规范的操作和严格的管理也同样重要。
5. 装饰材料
5.1 吊顶与隔墙:采用彩钢夹心板等材料要符合国家关于实验室的消防规范。应结构牢固、气密性好;所有阴角应采用弧形线条过渡,墙体内壁光洁不吸附、易清洁消毒、耐腐蚀。功能相近的实验室隔墙设置比例适宜的透视窗,透视窗以双面玻璃为好,这样能保持与墙体齐平,隔墙距走廊隔墙不低于1.5米为宜,吊顶棚高以2.4~2.6m为宜。
5.2 地面:实验室建议采用PVC卷材或环氧树脂整体地面,地面与墙交界处应圆弧过渡上墙120mm-150mm(需用水冲刷房间),使用进口橡胶卷材(片)更佳。地面材料与其他围护结构交界处应安全平齐过渡,无缝隙和裂纹,地面铺设前采用自流平处理,地面平整性 - 12 -
好、易清洁、耐腐蚀。
5.3 门:彩钢板门框为冷轧槽钢,外加铝型材,配专用密封条,优质闭门器,设可视窗,门单向锁定。缓冲间的门与主实验室的门有互锁功能。
5.4传递窗:各实验室区间设不锈钢互锁功能传递窗并具有消毒功能,试剂和标本通过传递窗传递,保证试剂和标本在传递过程中不受污染(人物分流)。
5.5 给排水系统:给排水管宜设在缓冲区。给水管路最好采用薄壁不锈钢钢管,管上安装逆止阀。
缓冲区设洗手盆,手动水龙头;标本制备区、扩增产物分析区设洗手盆,水龙头(感应、脚踏、手动)和洗眼器。如果设置地漏,地漏采用不锈钢密闭地漏。
5.6照明:灯具要选用净化灯具,便于清洗不积尘。
6 安全与自动系统
6.1 疏散出口(专用走廊)设置专用疏散指示灯(标识)及应急照明。
6.2 送排风系统采用变频控制,并联动互锁,即工作时先启动排风机后启动送风机。停机时相反,并设事故自动报警装置。
6.3自动系统发生故障时由手动控制装置控制,自动控制系统设备及主件采用进口产品为宜。
6.4 网络与通信:各区域实验室、缓冲室设网络终端,在专用走廊设电话分机。
- 13 -
6.5 强电系统:实验室用电负荷为一级负荷,采用双路电源供电,设自动切换装置,配电箱单独设置。根据实验室各区域功能合理配置三相和单相电源,穿管暗线埋设,大型仪器接地线布局到位。实验室照度满足规范要求(最低照度为200lx),装有紫外线灯,照射无死角。
7. PCR实验室建设与装修注意事项
7.1在设计的过程中应注意事项:规范的安装流程和全面的服务流程;严格按照规范科学设计的安装流程。安装前需要确定以下安装条件,如:电源电压、电源进线位置、电话网络线位置、进水水压、最小安装空间、地面平整度、通风孔、给水管和下水管的位置等,理想状态的尺寸。
7.2 PCR实验室可以按二级生物安全实验室建设标准执行,国家标准是底线不能违背,行业标准高于国家标准,应按行业标准执行。
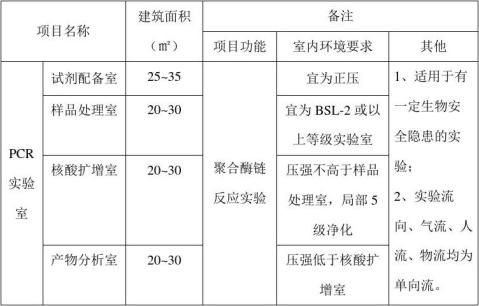
7.3 实验室各区域功能不同,为满足设备、仪器、用品等的摆放需求,各区域须有充分的空间。建筑面积(m2)分配,以聚合酶联反应法为例:试剂储存和准备区25~35、样品处理区20~30、核酸扩增区20~30、扩增产物分析区20~30为宜。各区域的缓冲间也须留有足够的使用面积,以便于洗手盆、更衣柜、卫生用具等的摆放、存储和出入门的设置与开启。如果平面布局允许宜设专用走廊,专用走廊宽度不得低于1.2m,设置进出口。
7.4 实验室样品处理区的面积应大于其他区域,以便于生物安全柜的摆放,如采用实时荧光法,扩增区和扩增产物分析区合并一个 - 14 -
区域,房间尺寸可适当缩小,因全封闭荧光分析仪尺寸不大。
7.5 缓冲间、试剂储存和准备区、样品处理区设置正压间;扩增区、扩增产物分析区设置负压间。
7.6 PCR实验室各区域间没有洁净度的要求,但是为了保护和延长生物安全柜的使用寿命和实验环境,经济条件允许情况下,各区域均可采用空调通风净化系统,洁净度宜为8~9级。
7.7 PCR实验室扩增区、扩增产物分析区的气流不能逆流向扩增前的区域,以免污染造成假阳性结果。扩增区、扩增产物分析区排风不得排向技术夹层,应排向室外。
7.8 凡是有压差要求的房间,在显著位置须设有压差显示装置,并预留测试孔,测试孔要密封。
7.9 洗手盆不宜过大,试验台面两端棱角须圆弧处理,实验台底层离地面距离在150mm以上或考虑加装移动轮便于移动。
7.10 基因扩增实验室应选用B2级生物安全柜,不宜选用A1/2级生物安全柜,因A1/2级生物安全柜循环风易造成标本交叉污染。
7.11 实验室微正压是指相对于大气压的最小压差不得低于
10Pa,因在多风季节大气的最小正压差往往能达到5Pa或5Pa以上。
7.12 技术夹层宽度应不低于600mm,800mm为宜。
7.13 各房间进出的门,依据室内压差,设置门的开启方向。 8. 基因扩增实验室(PCR)参考文件即文件择录
9. 平面布局见图1/2
10. 工程案例
- 15 -
8. 基因扩增实验室(PCR实验室)设计参考文件
文件1、关于批准发布《疾病预防控制中心建设标准》建标127—2009 号。
文件择录第13页:附表一 疾病预防控制中心特殊用途实验室用房建筑面积指标。
文件择录第37页:如 组合形式PCR实验室(基因扩增实验室),根据特定专业要求,应设五个(或四个/三个)相互隔离的工作区域,即试剂贮存和准备区、样品粉碎区(根据需要设置)、样品制备区、扩增反应混合物配制和扩增区以及产物分析区;当采用荧光PCR时,扩增区和产物分析区可合并为一个区域。为了减少不同工作区之间的
- 16 -
空气交换量,各个工作区的出入口应设置缓冲间,并且建筑条件许可时,可设置专用走廊,形成定向的人流、物流与实验流程。同时对室内环境也有特定要求,需设置通风系统,形成定向的气流保护区,避免各个实验区之间的相互干扰。
文件2、医疗机构临床基因扩增检验实验室管理办法—卫办医政发【2010】194号:附件—医疗机构临床基因扩增检验实验室工作导则。
文件择录:一、临床基因扩增实验室的设计
临床基因扩增检验实验室区域设计原则。原则上临床基因扩增检验实验室应当设置以下区域:试剂储存和准备区、标本制备区、扩增区、扩增产物分析区。这4个区域在物理空间上还是在使用中,应当始终处于完全的分隔状态,不能有空气直接相通。根据使用仪器的功能,区域可适当合并。例如使用实时荧光PCR仪,扩增区和扩增产物分析区可合并;采用样本处理、核酸提取及扩增检测为一体的自动化分析仪,则标本制备区、扩增区、扩增产物分析区可合并。
临床基因扩增检验实验室的空气流向。
临床基因扩增检验实验室的空气流向可按照试剂储存和准备区→标本制备区→扩增区→扩增产物分析区进行,防止扩增产物顺空气气流进入扩增前的区域。可按照试剂储存和准备区→标本制备区→扩增区→扩增产物分析区方向空气压力递减的方式进行。可通过安装排风扇、负压排风装置或其他可行方式实现。
- 17 -
二、临床基因扩增检验实验室工作基本原则。
(一)进入各个工作区域应当严格按照单一方向进行,即试剂储存和准备区→标本制备区→扩增区→扩增产物分析区。
(四)实验室的清洁应当按试剂储存和准备区→标本制备区→扩增区→扩增产物分析区方向进行。不同的实验区应当有各自的清洁用具以防止交叉污染。
三、临床基因扩增检验实验室各区域工作注意事项
(二)标本制备区。由于在样本混合、核酸纯化过程中可能会发生气溶胶所致的污染,可通过在本区内设立正压条件,避免从邻近区进入本区的气溶胶污染。为避免样本间的交叉污染,加入待测核酸后,必须盖好反应混合液的反应管。对具有潜在传染危险性的材料,必须在生物安全柜内开盖,并有明确的样本处理和灭活程序。
文件3、全国艾滋病检测技术规范(20xx年修订版) 第22页 4.HIV核酸检测实验室要求
4.1实验室分区和功能
实验室应设置两个独立的工作区域:核酸扩增前区和核酸扩增后区。核酸扩增前区包括试剂准备区和样品处理区,设在不同房间或区域;核酸扩增后区包括扩增区和扩增产区分析区,设在不同房间或区域。
4.1.4在满足下列要求的前提下,核酸扩增前区或核酸扩增后区可设在一个房间内。
- 18 -
4.1.4.1核酸扩增前区实验室内设置两个不同的位置的实验区,试剂配制在超净工作台中操作,样品处理在生物安全柜内进行。
4.1.4.2在核酸扩增后区使用全封闭的扩增和检测系统时,如实时荧光PCR仪等。
4.5.4单向工作流制度
4.5.4.1实验室的气流应从扩增前区流向扩增后区,不得逆向流动。建议扩增前区弱正压状态,扩增后区保持弱负压状态。
4.5.4.2实验室人员单向工作流向应该为:试剂储存和准备区→标本制备区→扩增区→扩增产物分析区,不得逆向流动。原则上实验人员在扩增后区工作后当天不能再返回扩增前区工作。
4.5.4.3 实验室用品单向工作流向应该为:试剂储存和准备区→标本制备区→扩增区→扩增产物分析区,不得逆向流动。实验用品包括实验材料(试剂、样品和扩增产物)、实验器材(容器、板架、实验服帽子、口罩、手套、鞋套)、办公用品(记录纸、笔等)以及清洁材料等。
文件4、出入境检验检疫行业标准SN-T1193—2003基因检验实验室技术要求
文件择录
3.实验室总体要求
3.1基因检验实验室区域设置原则
基因产品检测实验室分为五个隔开的工作区域;试剂储存和准备 - 19 -
区、样品粉碎、标本制备区、扩增反应混合物配制和扩增区、扩增产物分析区。如果使用荧光PCR仪,扩增区和扩增产物分析区可以合并。
3.1.3样品制备区
本区可部分或全部设为正压条件。从实际贮存和准备区拿来的主反应混合液,在此区正压条件下加入待测核酸后,必须盖好核酸反应物的反应管,再次进入反应扩增区。
3.1.5扩增产物分析区
本区的功能为:扩增片段的测定。
本区是最主要的扩增产物污染来源,本区如采用负压条件或减压情况下(如安装排风扇)可减少扩增产物从本区扩散至前面区域的可能性。
3.2基因检验实验室人员操作要求
进入各工作区必须严格按照单一方向进行,即试剂储存和准备区→标本制备区→扩增反应混合物配置和扩增区→扩增产物分析区。
实验室的清洁应按试剂储存和准备区→扩增产物分析区方向进行。不同的实验区域应有各自的清洁用具。
- 20 -
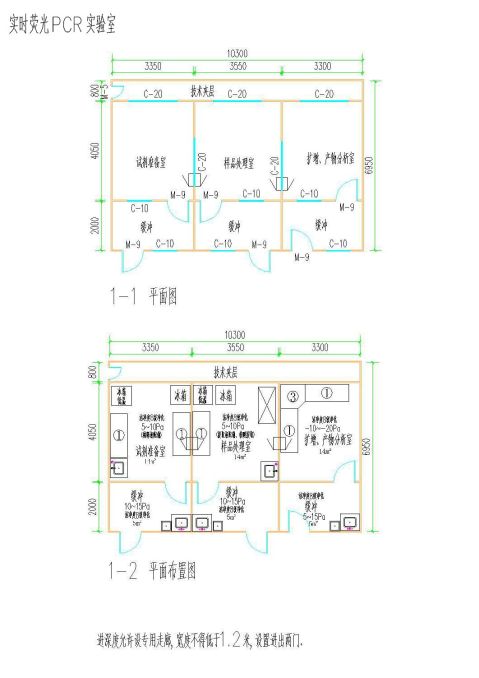
9.平面布局(1-1、1-2、1-3、1-4)
- 21 -
1-4 - 22 -
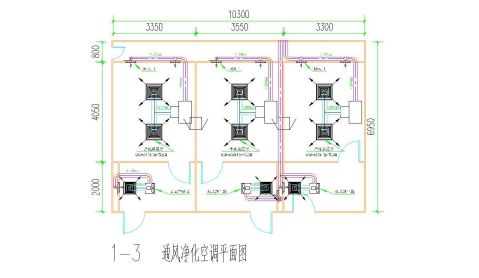
平面布局(2-1、2-2、2-3)
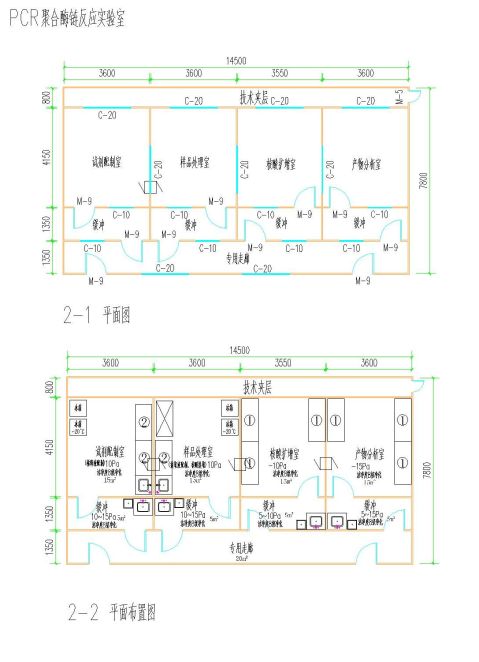
- 23 -
10. 工程案例
1. 鄂尔多斯市中心血站
2. 赤峰市中心血站
3. 兴安盟中心血站
4. 鞍山市动物疫病控制中心
5. 海城市动物疫病控制中心
6. 台安县动物疫病控制中心
7. 岫岩满族自治县动物疫病控制中心
8. 台安县疾病预防控制中心
9. 锦州市动物疫病控制中心
10. 北票市动物疫病控制中心
11. 义县动物疫病控制中心
12. 辽阳市动物疫病控制中心
13. 抚顺县动物疫病控制中心 - 24 -

地址:辽宁省辽阳市武圣路罗马假日288-29号
电话:0419-2253455 2252855 4153658
传真:0419-2253455
邮编:111000
网址: E-mail:1246701901@qq.com - 25 -
