例表1
药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□ 编码: 报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□ 其他□
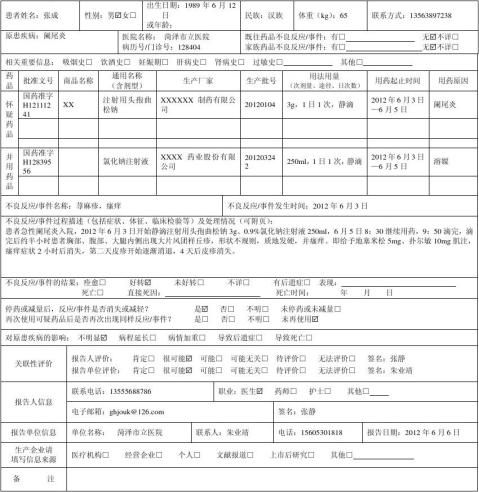
附表2
药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□ 编码: 报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□ 其他
不良反应过程描述:
3个时间3个项目和2个尽可能
3个时间:
• 不良反应发生的时间;
• 采取措施干预不良反应的时间;
• 不良反应终结的时间(好转、缓解、消失)。
3个项目:
• 第一次药品不良反应出现时的相关症状、体征和相关 检查;
• 药品不良反应动态变化的相关症状、体征和相关检查;
• 发生药品不良反应后采取的干预措施结果。
2个尽可能:
• 不良反应/事件的表现填写时要尽可能明确、具体;
• 与可疑不良反应/事件有关的辅助检查结果要尽可能明确填写。
严重不良反应过程描述套用格式:
何不良反应(包括症状,体征,相关检查),何时采取何种措施,何时病情发生何变化(症状,体征,相关检查)及采取何种治疗措施,何时不良反应治愈或好转。
一般不良反应过程描述套用格式:
何不良反应(包括症状,体征,相关检查),何时采取何种措施,何时不良反应治愈或好转。
要求:
相对完整,以时间为线索,重点为不良反应的症状、体征、治疗措施、结果,目的是为关联性评价提供充分的信息。
举例:
患者因败血症20xx年6月1日静滴万古霉素1g Bid , 6月5日(发生ADR时间)患者尿量明显减少,300ml/d。急查肾功Cr440μmol/L,BUN21.6mmol/L。 (第一次ADR出现时的相关症状、体征和相关检查)。患者用药前肾功能及尿量均正常。即(干预时间)停用万古霉素。 (采取的干预措施)。停药后患者尿量逐渐增多,至6月10日(终结时间)尿量恢复正常。6月11日复查肾功能:Cr138μmol/L,BUN7.2mmol/L 。(采取干预措施之后的结果)
患者因“衣原体尿路感染”于20xx年1月27日予注射用阿奇霉素0.5g qd,当天10:00静滴完该药后约10分钟面部出现轻微皮疹,未作处理。1月28日患者早上静滴完该药后颈部、胸部、大腿出现散在红色丘疹,瘙痒,予扑尔敏4mg口服,下午症状缓解。1月29日患者早上静滴完该药后使用后再次出现红色丘疹,遍及全身,瘙痒。立即给予给予非钠根25mg im ,扑尔敏4mg Tid,并停止使用阿奇霉素。于2月2日皮肤基本恢复正常。
多组液体用药背景描述:
患者先天性心脏病,患重感冒、支气管炎,于20xx年7月10日给予输液治疗,1.10%葡
萄糖注射液100ml+喘定0.15g+地塞米松3mg静滴;2.10%葡萄糖注射液100ml+炎琥宁80mg静滴,第1、2组液体输完后续用第3组液体5%葡萄糖氯化钠注射液100ml+头孢哌酮钠 1.0g,静滴10分钟后…
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应 30日内报告。有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。 用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
第二篇:不良反应报告单
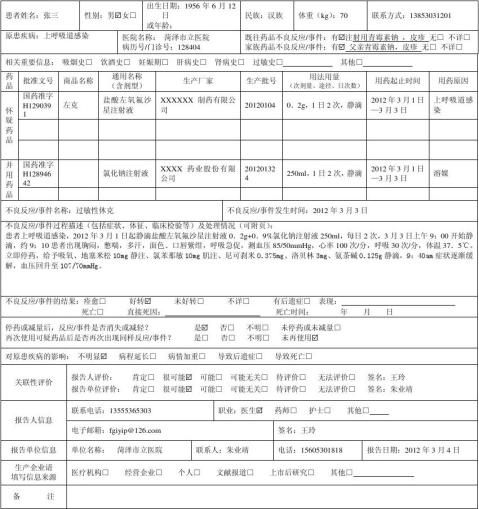
附表1
药 品 不 良 反 应 / 事 件 报 告 表
首次报告 跟踪报告 编码: 报告类型:新的 严重 一般 报告单位类别:医疗机构 经营企业 生产企业 个人 其他

严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应 30日内报告。有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。 用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
