第三章 结果与分析
第三章 结果与分析
淄博市张店区小区居民的生活水平相对以前有了显著的提高,健身场地,健身器械等方面也有所改善,居民对体育健身的意识越来越强,参加健身活动的居民也越来越多,但是在社区的建设发展过程中仍缺乏体育方面的规划和内容,主要表现在城市体育发展的相关法规政策不完善、忽视体育基本设施建设、体育文化活动缺乏组织与管理等。在社区的建设和发展过程中,注重基本生活设施建设,不注重体育基础设施的建设,造成这些地方体育设施的运营和管理与城市发展处于失衡的状态。我们对张店区小区居民的健身现状进行了调查,以了解张店区小区居民的健身现状及健身意识的高低,掌握张店区小区的健身设施状况,小区居民的健身要求及对小区管理建设的建议,为决策部门对小区的管理和建设提供理论依据。
3.1 社区居民对健身活动的认识
目前,社区体育的组织形式仍然是分散、小型的,没有打破区域内单位封闭,没有将不同行业、不同隶属关系、不同年龄结构的人员组织起来。社区体育的活动,主要以日常性活动为主,计划性竞赛很少[3]。活动的形式,内容多样,有体操、武术、舞蹈、气功、球类、田径、麻将、朴克牌、棋类等。日常性体育活动主要在辖区内体育场地、小区空地、庭院、室内等场所进行,而到面向社会收费的体育场馆健身的却很少。社区内的学校、企事业单位现有的体育场地设施向社区内各界群众开放的很少,活动时间,以早晨为主[4]。组织形式自发、灵活。社区内很少组织较大规模的计划性比赛,仍主要是各单位举办的,借用体育系统、教育系统场地。
表1 张店区社区居民对“全民健身计划”的了解程度一览表
对全民健身计划的了解 完全了解 了解不多 一点也不了解 人数 36 156 208 % 9.05 39.20 51.75
- 6 -
第三章 结果与分析
表2 张店区居民对于健身的喜欢程度一览表
喜欢程度 喜欢 一般 不喜欢
人数 257 108 35
% 64.57 27.14 8.03
调查显示:大部分居民对我国的全民健身计划不是很了解。居民喜欢和很喜欢活动的人数占调查总人数的64.57%;对体育活动持一般态度的占27.14%;不喜欢体育活动的占8.03%。这一数据反映了张点区居民对待健身活动的认识仍然相对比较落后,但参与体育活动及相关内容的热情较高。
3.2社区居民参加体育活动的现状
从表3 可以看出,在所抽查的居民中,每次锻炼半小时以上的361 人,占总数的90.20 %。
表3 社区居民每次锻炼时间一览表
每次锻炼的时间 0.5小时以下 0.5~1小时 1小时以上
人数 39 194 167
% 9.80 48.74 41.46
表4 显示,参加体育锻炼的居民每周3次以上的157 人,占总数的38.94 % , 美国运动医学学会给体育人口下的定义是:1) 每周身体活动频度3次以上; 2) 每次活动时间30 min以上; 3) 每次身体活动强度中等程度以上。( 美国占45% , 加拿大42% , 我国31. 4%)[5] , 这一数据略高于我国体育人口总数,低于我国大城市和经济发达沿海城市,略高于我国西部经济较落后地区,同时也低于世界工业发达国家,而高于发展中国家的平均水平。
表4 社区居民参加锻炼频率一览表
锻炼频率 1~3次/月 1~2次/周 3次以上/周
人数 38 205 157
% 9.55 51.51 38.94
- 7 -
第三章 结果与分析
每周参加体育活动3 次,这样能较好地保留锻炼效果的痕迹,具有较好的健身作用,如果利用休息日每周锻炼一次,对健身没有多大作用,如果不注意量力而行,运动的量和强度较大,反而会妨碍健康,所以说每周利用休息日锻炼一次的方法是不可取的[6]。
3.3 社区居民参与健身活动的动机
动机是指“直接推动一个人进行活动的内部动因或动力”。健身动机既是健身者的主观出发点,也是客观社会、经济、文化发展的必然结果。随着居民物质文化生活水平的提高,闲暇时间的增多,人们需要通过其它的方式来满足自身的需求,这便构成了社区居民的健身动机[7]。由于个体差异和习俗的不同导致城市居民参加社区体育活动的动机也大相径庭。过去,人们只是把体育当作一种健身的手段,对体育的娱乐价值、亲和价值、教育价值和自我价值等方面价值的认识不深。因此,必须扩大宣传,使人们认识到体育运动不仅具有健身价值,更重要的是它的文化、教育、休闲娱乐、亲和、自我实现等方面的价值。
表5 社区居民体育健身动机一览表
锻炼的目的 人数 %
增进健康 214 53.77
丰富生活 77 19.35
减肥健美 54 13.57
锻炼意志品质 23 5.78
其他 15 3.26
从表5中我们可以看出,调查显示,社区居民体育锻炼的目的主要以强身健体、娱乐和康复为主,占总数的53.77%。但随着体育的价值观、体育的多功能逐渐被广大居民所重视。居民参与体育健身的动机也逐渐趋于多元化。其中以丰富生活和减肥健美为目的健身活动也占到了比较大的比例。
- 8 -
第三章 结果与分析
3.4 社区居民参与健身活动的方式
从表6 、7可以看出,居民活动的场所仍主要集中在小区和公园。散步、跑步、健身路径类活动是人们选择较为集中的项目,其主要原因是这些项目不受场地、器材限制,活动量易于控制。社区居民体育活动的内容丰富多彩,以有氧运动项目为主,具有较好的健身和娱乐作用,跑步和走仍然是居民参与活动人数最多的项目,可能与以下因素有关,一是中老年人体能较差,运动技能较缺,故选择了简单易行的跑步和走;二是跑步对提高心肺能力有较好的作用。另外,活动人数较多的项目还有太极拳、健美操、健身舞等,这些活动项目具有明显的健身性、韵律性和表演性,被社区居民健身锻炼所接受[8]。
表6 社区居民参加体育健身的形式一览表
项目 散步 健身路径 跑步 球类活动 健身操 郊游 其他 人数 156 127 56 37 22 31 27 % 39.20 31.91 14.07 9.25 5.53 7.79 6.78
表7 社区居民参加体育健身的地点一览表
类别 小区公共场所 公园广场 自家庭园 体育场馆 学校 其他 人数 185 89 26 37 50 13 % 46.48 22.36 6.53 9.30 12.56 3.27
这个结果提示:政府应重视在居民住宅周围建设足够简易、实用的体育健身场所。随着居民经济承受能力及体育消费水平的提高,人们逐渐把健身场所设选为公共场所,所以说小区的健身路径成为居民的一个重要选择目标。其次,学校依然是青少年接受体育锻炼的主要场所,加强学校体育场地设施的建设是各级政府特别要重视的一件事情[10]。到体育场馆锻炼的居民人数仅占9.30 % ,说明集中大型的体育场馆并没有成为市民锻炼的主要场所,原因有三:一是多数人还没有能承受到大型体育场馆锻炼身体的消费能力;二是家远,不方便常去锻炼;三是个人原因,不喜欢到大型体育场馆锻炼[11]。
- 9 -
第三章 结果与分析
3.5 影响社区居民参与健身活动的因素
从表8 可见,影响居民参加社区体育活动的因素主要有:没有场地器材、没人指导、没人组织、没有时间、不会锻炼、没有兴趣等;从主客观的角度来说,客观条件已经是影响居民参加社区体育活动主要因素。
表8 影响社区居民参加体育健身的因素一览表
影响因素 人数 %
没有时间 131 32.91
缺乏场地器材 247 62.06
工作太累 81 20.35
不会锻炼 77 19.35
没有锻炼习惯 118 29.65
缺乏指导 214 53.77
缺乏组织 154 38.69
其他 94 23.62
调查显示,影响社区居民体育锻炼的因素里排在第一位的是缺乏场地器材,占总调查量的62.06%,尽管现在新建的新村都有体育活动场所和器械,但由于居民参加体育锻炼的人数的增加和锻炼质量的提高,已不能满足居民的要求,在早晚这些运动场所已是人满为患;缺乏指导的影响排在第二位,目前小区的建设日益扩大,但是相应的体育健身指导员之类的人才缺乏,大部分的居民缺乏相应的指导,不能合理的安排健身锻炼,这是影响居民健身锻炼水平的一个重要的因素;影响居民锻炼的情绪排在第三位,认为在心情不愉快时将不想活动;另外,时间工作状况、组织管理和缺乏运动的知识和技能也将影响了居民的体育锻炼[12]。
- 10 -
第三章 结果与分析
3.6 社区居民对小区体育健身的希望
根据表9的结果显示,目前居民的健身意识在不断的加强,但是相应的体育健身知识没有得到相应的提高,大部分居民希望能够得到比较系统的,合理的体育锻炼指导;同时,居民的小区的组织管理和体育场地器材的建设提出了更高的要求,这表明,社区体育健身的组织管理和场地器材的发展建设成为影响居民健身锻炼的一个重要的影响因素。
表9 社区居民对小区体育健身建设的希望一览表
对小区体育健身的发展希望 人数 %
政府加大小区体育场地建设的投资 195 48.75
经常组织居民参加健身活动 152 38.00
加强小区居民体育锻炼的指导 233 58.25
多办居民体育竞赛 53 13.25
健全小区体育组织,加强管理 172 43.00
其他 43 10.75
从调查的结果来看,大部分居民还是对社区体育健身中硬件设施的改善较为关注,这也表明我区在社区健身设施的建设上还存在不足,也可以说,以当前的社区健身设施已经不能满足居民的文化生活需要。一些设施的短缺和老旧已经成为影响居民健身水平的一个重要的因素。在这其中,以缺乏相应的体育锻炼指导尤为突出。
- 11 -
第二篇:分析化学(高教第五版)课后习题及思考题第七章重量分析法和沉淀滴定法章节答案(整理排版11页)
分析化学(高教第五版)课后习题及思考题
思 考 题
1.沉淀形式和称量形式有何区别?试举例说明之。
答:在重量分析法中,沉淀是经过烘干或灼烧后再称量的。沉淀形式是被测物与沉淀剂反应生成的沉淀物质,称量形式是沉淀经过烘干或灼烧后能够进行称量的物质。有些情况下,由于在烘干或灼烧过程中可能发生化学变化,使沉淀转化为另一物质。故沉淀形式和称量形式可以相同,也可以不相同。例如:BaSO4,其沉淀形式和称量形式相同,而在测定Mg2+时,沉淀形式是MgNH4PO4·6H2O,灼烧后所得的称量形式却是Mg2P2O7。
2.为了使沉淀定量完全,必须加人过量沉淀剂,为什么又不能过量太多?
答:在重量分析法中,为使沉淀完全,常加入过量的沉淀剂,这样可以利用共同离子效应来降低沉淀的溶解度。沉淀剂过量的程度,应根据沉淀剂的性质来确定。若沉淀剂不易挥发,应过量20%~50%;若沉淀剂易挥发,则可过量多些,甚至过量100%。但沉淀剂不能过量太多,否则可能发生盐效应、配位效应等,反而使沉淀的溶解度增大。
3.影响沉淀溶解度的因素有哪些?它们是怎样发生影响的?在分析工作中,对于复杂的情况,应如何考虑主要影响因素?
答:影响沉淀溶解度的因素有:共同离子效应,盐效应,酸效应,配位效应,温度,溶剂,沉淀颗粒大小和结构等。共同离子效应能够降低沉淀的溶解度;盐效应通过改变溶液的离子强度使沉淀的溶解度增加;酸效应是由于溶液中H+浓度的大小对弱酸、多元酸或难溶酸离解平衡的影响来影响沉淀的溶解度。若沉淀是强酸盐,如BaSO4,AgCl等,其溶解度受酸度影响不大,若沉淀是弱酸或多元酸盐[如CaC2O4、Ca3(PO4)2]或难溶酸(如硅酸、钨酸)以及与有机沉淀剂形成的沉淀,则酸效应就很显著。除沉淀是难溶酸外,其他沉淀的溶解度往往随着溶液酸度的增加而增加;配位效应是配位剂与生成沉淀的离子形成配合物,是沉淀的溶解度增大的现象。因为溶解是一吸热过程,所以绝大多数沉淀的溶解度岁温度的升高而增大。同一沉淀,在相同质量时,颗粒越小,沉淀结构越不稳定,其溶解度越大,反之亦反。综上所述,在进行沉淀反应时,对无配位反应的强酸盐沉淀,应主要考虑共同离子效应和盐效应;对弱酸盐或难溶酸盐,多数情况应主要考虑酸效应,在有配位反应,尤其在能形成较稳定的配合物,而沉淀的溶解度又不太大时,则应主要考虑配位效应。
4.共沉淀和后沉淀区别何在?它们是怎样发生的?对重量分析有什么不良影响?在分析化学中什么情况下需要利用共沉淀?
答:当一种难溶物质从溶液中沉淀析出时,溶液中的某些可溶性杂质会被沉淀带下来而混杂于沉淀中,这种现象为共沉淀,其产生的原因是表面吸附、形成混晶、吸留和包藏等。后沉淀是由于沉淀速度的差异,而在已形成的沉淀上形成第二种不溶性物质,这种情况大多数发生在特定组分形成稳定的过饱和溶液中。无论是共沉淀还是后沉淀,它们都会在沉淀中引入杂质,对重量分析产生误差。但有时候利用共沉淀可以富集分离溶液中的某些微量成分。
5.在测定Ba2+时,如果BaSO4中有少量BaCl2共沉淀,测定结果将偏高还是偏低?如有Na2S04、Fe2(SO4)3、BaCrO4共沉淀,它们对测定结果有何影响?如果测定S042-时,BaSO4中带有少量BaCl2、Na2S04、BaCrO4、Fe2(S04)3,对测定结果又分别有何影响?
答:如果BaSO4中有少量BaCl2共沉淀,测定结果将偏低,因为MBaO<MBaSO4。如有Na2S04、Fe2(SO4)3、BaCrO4共沉淀,测定结果偏高。如果测定S042-时,BaSO4中带有少量BaCl2、Na2S04、BaCrO4、Fe2(S04)3,对测定结果的影响是BaCl2偏高、Na2S04偏低、BaCrO4偏高、Fe2(S04)3偏低。
6.沉淀是怎样形成的?形成沉淀的性状主要与哪些因素有关?其中哪些因素主要由沉淀本质决定?哪些因素与沉淀条件有关?
答:沉淀的形成一般要经过晶核形成和晶核长大两个过程。将沉淀剂加入试液中,当形成沉淀离子浓度的乘积超过该条件下沉淀的溶度积时,离子通过相互碰撞聚集成微小的晶核,溶液中的构晶离子向晶核表面扩散,并沉淀在晶核上,晶核就逐渐长大成沉淀颗粒。离子形成晶核,再进一步聚集成沉淀颗粒的速度为聚集速率。在聚集的同时,构晶离子在一定晶格中定向排列的速率为定向速率。如果聚集速率大,定向速率小,即离子很快地聚集生成沉淀颗粒,却来不及进行晶格排列,则得到非晶形沉淀。反之,如果定向速率大,聚集速率小,即离子较缓慢地聚集成沉淀颗粒,有足够时间进行晶格排列,则得到晶形沉淀。其中定向速率主要由沉淀物质本性决定,而聚集速率主要与沉淀条件有关。
7.要获得纯净而易于分离和洗涤的晶形沉淀,需采取些什么措施?为什么?
答:欲得到晶形沉淀应采取以下措施:
(1)在适当稀的溶液中进行沉淀,以降低相对过饱和度。
(2)在不断搅拌下慢慢地加入稀的沉淀剂,以免局部相对过饱和度太大。
(3)在热溶液中进行沉淀,使溶解度略有增加,相对过饱和度降低。同时,温度升高,可减少杂质的吸附。
(4)陈化。陈化就是在沉淀完全后将沉淀和母液一起放置一段时间。在陈化过程中,小晶体逐渐溶解,大晶体不断长大,最后获得粗大的晶体。同时,陈化还可以使不完整的晶粒转化为较完整的晶粒,亚稳定的沉淀转化为稳定态的沉淀。也能使沉淀变得更纯净。
8.什么是均相沉淀法?与一般沉淀法相比,它有何优点?
答:均相沉淀法就是通过溶液中发生的化学反应,缓慢而均匀地在溶液中产生沉淀剂,从而使沉淀在整个溶液中均匀地、缓慢地析出。均匀沉淀法可以获得颗粒较粗,结构紧密,纯净而又易规律的沉淀。
9.某溶液中含SO42-、Mg2+二种离子,欲用重量法测定,试拟定简要方案。
答:在溶液中加入Ba2+生成BaSO4沉淀,过滤,沉淀烘干、灼烧,称重后利用化学因数计算SO42-含量。滤液中加入(NH4)2HPO4,将Mg沉淀为MgNH4PO4·6H2O,过滤,沉淀经烘干、灼烧,得到称量形式Mg2P2O7。称重后利用化学因数计算镁含量。
10.重量分析的一般误差来源是什么?怎样减少这些误差?
答:一般误差来源有两个,一是沉淀不完全,二是沉淀不纯净。通常采取同离子效应、盐效应、酸效应、配位效应以及控制体系的温度、溶剂、沉淀颗粒大小和结构等因素来降低沉淀的溶解度,以保证沉淀完全。同时采用适当的分析程序和沉淀方法、降低易被吸附离子的浓度、选用适当的沉淀条件和沉淀剂、或再沉淀等措施,以获得纯净沉淀。
11.什么是换算因数(或化学因数)?运用化学因数时,应注意什么问题?
答:待测组分的摩尔质量与称量形式的摩尔质量之比值。在运用化学因数时,必须给待测组分的摩尔质量和(或)称量形式的摩尔质量乘以适当系数,使分子分母中待测元素的原子数目相等。
12.试述银量法指示剂的作用原理,并与酸碱滴定法比较之。
答:银量法指示剂有三种:用铬酸钾作指示剂称为摩尔法,其作用原理是 在含有Cl-的溶液中,以K2CrO4作为指示剂,用硝酸银标准溶液滴定,当定量沉淀后,过量的Ag+即与K2CrO4 反应,形成砖红色的Ag2CrO4沉淀,指示终点的到达。
用铁铵矾作指示剂称为佛尔哈德法,其作用原理是 在含有Ag+的溶液中,以铁铵矾作指示剂,用NH4SCN标准溶液滴定,定量反应后,过量的SCN-与铁铵矾中的Fe3+反应生成红色FeSCN2+配合物,指示终点的到达。
用吸附指示剂指示终点的方法称为法扬司法,其作用原理是 吸附指示剂是一种有色的有机化合物,它被吸附在带不同电荷的胶体微粒表面后,发生分子结构的变化,从而引起颜色的变化,指示终点的到达。
13.用银量法测定下列试样中Cl-含量时,选用哪种指示剂指示终点较为合适?
(l)BaCl2 ;(2)NaCl+Na3P04; (3)FeCl2; (4)NaCl+Na2S04。
答:(1)铬酸钾; (2)铁铵矾; (3)吸附指示剂; (4)铬酸钾;铁铵矾;吸附指示剂
14.说明用下述方法进行测定是否会引人误差,如有误差则指出偏高还是偏低?
(1)吸取NaCl+H2S04试液后,马上以摩尔法测Cl-;
(2)中性溶液中用摩尔法测定Br-;
(3)用摩尔法测定pH~8的KI溶液中的I-;
(4)用摩尔法测定Cl-,但配制的K2CrO4指示剂溶液浓度过稀;
(5)用佛尔哈德法测定Cl-,但没有加硝基苯。
答:(1)偏高.因为在酸性溶液中CrO42-浓度降低,影响Ag2CrO4沉淀形成,终点过迟。
(2)无影响
(3)偏低,因为AgI 沉淀强烈地吸附I-,致使终点过早到达。
(4)偏高,因为K2CrO4指示剂溶液浓度过稀,致使终点过迟到达。
(5)偏低,因为没有加入硝基苯,致使AgCl沉淀部分转化为AgSCN沉淀,返滴剂SCN-用量过多。
15.试讨论摩尔法的局限性。
答:摩尔法只能在中性或弱减性(pH 6.5~10.5)溶液中进行,因为在酸性溶液中CrO42-浓度降低,影响Ag2CrO4沉淀形成,终点过迟。在强碱性溶液中,AgNO3会生成Ag2O沉淀。此外,摩尔法只能用来测定Cl-、Br-等,却不能用NaCl直接滴定Ag+.
16.为什么用佛尔哈德法测定Cl-时,引入误差的概率比测定Br-或I-时大?
答:因为AgCl的溶解度大于AgSCN,而AgBr和AgI的溶解度较小,所以用佛尔哈德法测定Cl-时,引入误差的概率比测定Br-或I-时大。
17.为了使终点颜色变化明显,使用吸附指示剂应注意哪些问题?
答:(1)由于吸附指示剂的颜色变化发生在沉淀微粒表面上,因此应尽可能使卤化银沉淀呈胶体状态,具有较大的表面积。(2)常用的吸附指示剂大多是有机弱酸,而起指示作用的是他们的阴离子,因此在使用吸附指示剂时,要注意调节溶液pH值。(3)卤化银沉淀对光敏感,遇光易分解析出金属银,使沉淀很快转变为灰黑色,影响终点观察,因此在滴定过程中应避免强光照射。(4)胶体微粒对指示剂离子的吸附能力,应略小于对待测离子的吸附能力,否则指示剂将在化学计量点前变色,但如果吸附能力太差,终点时变色也不敏锐。(5)溶液中被滴定离子的浓度不能太低,因为浓度太低时沉淀很少,观察终点比较困难。
18.试简要讨论重量分析和滴定分析两类化学分析方法的优缺点。
答:重量分析法和滴定分析法都适用于常量分析(被测组分含量大于1%)。
重量分析法 优点:(1)无需与标准样品或基准物质进行比较,因为该法直接用天平称量而获得分析结果。(2)对于高含量组分的测定,准确度较高。缺点:(1)操作较繁,费时较多,不适于生产中的控制分析。(2)对低含量组分的测定误差较大。滴定分析法 优点:操作简便,省时快速,准确度也较高,所用仪器简单,应用范围较广。缺点:需要指示剂和基准物质。
习 题
1.下列情况,有无沉淀生成?
(1) 0.00lmol·L-lCa(NO3)2溶液与0.01mol·L-l NH4HF2 溶液以等体积相混合;
(2) 0.00lmol·L-lMgCl2溶液与0.lmol·L-l NH3-lmol·L-l NH4Cl 溶液以等体积相混合。
解:(1)两溶液等体积混合后,[Ca2+] = 0.0005mol·L-l, [F-] = 0.01mol·L-l,
[Ca2+][F-]2 = 5×10-8>Ksp,CaF2 有沉淀生成。
(2)0.lmol·L-l NH3--lmol·L-l NH4Cl 溶液中,
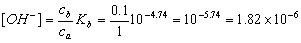 mol·L-l ,两溶液等体积混合后,[Mg2+] = 0.0005mol·L-l,[OH-] = 9.1×10-7 mol·L-l,
mol·L-l ,两溶液等体积混合后,[Mg2+] = 0.0005mol·L-l,[OH-] = 9.1×10-7 mol·L-l,
[Mg2+][OH-]2 = 4.14×10-16<Ksp,Mg(OH)2 无沉淀生成。
2.求氟化钙的溶解度: (1)在纯水中(忽略水解); (2)在0.0lmol·L-1CaCl2溶液中; (3)在0.0lmol·L-1HCl 溶液中。
解:已知 Ksp,CaF2 = 3.4×10-11, CaF2 = Ca2++2F- 设氟化钙的溶解度为s
(1) [s][2s]2 = 3.4×10-11, s = 2.0×10-4 mol·L-l
(2) [0.01+s][2s]2 ≈0.01×4s2 = 3.4×10-11, s = 2.9×10-5 mol·L-l
(3)αF(H) = (1+[H+]/KHF) = 1+0.01/3.5×10-4 = 29.57
[s] [2s]总2 = K’sp= Ksp·α2F(H) = 3.4×10-11×(29.57)2 = 2.973×10-8
s =(2.973×10-8/4)1/3 = 1.95×10-3
3.计算pH=5.0,草酸总浓度为0.05mol·L-1时,草酸钙的溶解度。如果溶液的体积为300mL,将溶解多少克CaC2O4?
解:设CaC2O4的溶解度为s, [Ca2+] = s CC2O42- = 0.05 +s≈0.05mol·L-1,
pH=5.0时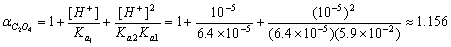 ,
,
K’sp,= KspαC2O4 = 2.0×10-9×1.156 = 2.312×10-9 K’sp,= [Ca2+]. CC2O42 = s×0.05
S = 2.312×10-9/0.05 = 4.624×10-8 mol·L-1
4.在250C时,铬酸银的溶解度为每升0.0279g,计算铬酸银的溶度积。
解:Ag2CrO4 = 2Ag+ + CrO42-
Ag2CrO4的溶解度 s =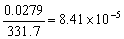 mol·L-1,
mol·L-1,
铬酸银的溶度积 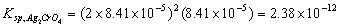
 5.为了使0.2032g (NH4)2SO4中的SO42-沉淀完全,需要每升含63g BaCl2·2H2O的溶液多少毫升?
5.为了使0.2032g (NH4)2SO4中的SO42-沉淀完全,需要每升含63g BaCl2·2H2O的溶液多少毫升?
解:(NH4)2SO4中的SO42-的物质的量为 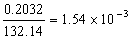 mol,若将SO42-沉淀完全,至少需要每升含63g BaCl2·2H2O的溶液的体积为:
mol,若将SO42-沉淀完全,至少需要每升含63g BaCl2·2H2O的溶液的体积为: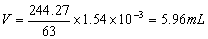
6.计算下列换算因数:
(1) 从Mg2P2O7,的质量计算MgSO4·7H2O的质量;
(2)从(NH4)3PO4·12MoO3的质量计算P和P2O5的质量;
(3)从Cu(C2H3O2)2·3Cu(AsO2)2的质量计算As2O3和CuO的质量;
(4)从丁二酮肟镍Ni(C4H8N2O2)2的质量计算Ni的质量;
(5)从8-羟基喹啉铝(C9H6NO)3Al的质量计算Al2O3的质量。
解:(1) 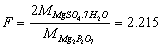
(2)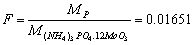

(3)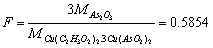
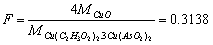
(4)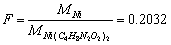
(5)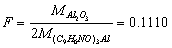
7.以过量的AgNO3处理0.3500g的不纯KCl试样,得到0.6416gAgCl,求该试样中KCl的质量分数。
解:KCl的质量分数为 
8.欲获得0.3gMg2P2O7沉淀,应称取含镁4.0%的合金试样多少克?
解: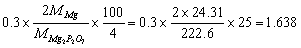 (g)
(g)
9.今有纯的CaO和BaO的混合物2.212g,转化为混合硫酸盐后重5.023g,计算原混合物中CaO和BaO的质量分数。
解:设CaO和BaO的质量分别为xg和yg, x + y = 2.212 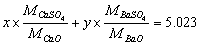 得:x = 1.828 g y = 0.344g
得:x = 1.828 g y = 0.344g
混合物中CaO和BaO的质量分数分别为 82.64%和17.36%。
10.有纯的AgCl和AgBr混合试样质量为0.8132g, 在C12气流中加热,使AgBr转化为AgCl,则原试样的质量减轻了0.1450g,计算原试样中氯的质量分数。
解:设混合试样中AgCl和AgBr的质量分别为x g和y g,x+y = 0.8132 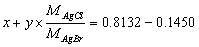 得:x = 0.2014g,
得:x = 0.2014g,
原试样中氯的质量分数为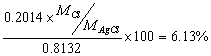
11.铸铁试样1.000g,放置电炉中,通氧燃烧,使其中的碳生成CO2,用碱石棉吸收后者增重0.0825g。求铸铁中含碳的质量分数。
解:铸铁中含碳的质量分数为 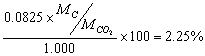
12.取磷肥2.500g,萃取其中有效P2O5,制成250mL试液,吸取10.00mL试液,加入稀HNO3,加H2O稀释至100mL,加喹钼柠酮试剂,将其中H3PO4沉淀为磷钼酸喹啉。沉淀分离后,洗涤至是中性,然后加25.00mL 0.2500mol·L-1 NaOH溶液,使沉淀完全溶解。过量的NaOH以酚酞作指示剂用0.2500 mol·L-1HCl溶液回滴,用去3.25mL。计算磷肥中有效P2O5的质量分数。
提示:(C9H7N)3H3[PO4·12MoO3]·H2O + 26NaOH = NaH2PO4+ 12Na2MoO4 + 3C9H7N + 15H2O NaOH + HC1= NaCl+ H2O
解:沉淀 (C9H7N)3H3[PO4·12MoO3]·H2O的质量M0为
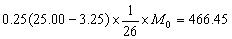 (mg)
(mg)
磷肥中有效P2O5的质量分数为 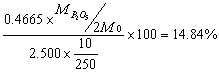
13.称取0.4817g硅酸盐试样,将它作适当处理后,获得0.2630g不纯的SiO2(主要含有Fe2O3、Al2O3等杂质)。将不纯的SiO2用H2SO4-HF处理,使SiO2转化为SiF4而除去。残渣经灼烧后,其质量为0.0013g。计算试样中纯SiO2的含量。若不经H2SO4-HF处理,杂质造成的误差有多大?
解:试样中纯SiO2的含量为 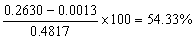
若不经H2SO4-HF处理,杂质造成的误差为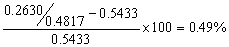
14.称取0.4670g正长石试样,经熔样处理后,将其中K+沉淀为四苯硼酸钾K[B(C6H5)4],烘干后,沉淀质量为0.1726g,计算试样中K2O的质量分数。
解:试样中K2O的质量分数为 
15.在含有相等浓度的Cl-和I-的溶液中,滴加入AgNO3溶液,哪一种先沉淀? 第二种离子开始沉淀时,Cl-与I-的浓度比为多少?
解:因为 Ksp,AgI<Ksp,AgCl,故AgI先沉淀。当Cl-开始沉淀时 [Cl-]=[Ag+]= (Ksp,AgCl)1/2 = 1.25×10-5 此时 [I-] = (Ksp,AgI)/ [Ag+] = 1.5×10-16/1.25×10-5
则 [Cl-]/[I-] = 1.25×10-5/1.5×10-16/1.25×10-5 = 1.04×106
16.将30.00mLAgNO3溶液作用于0.1357gNaCl,过量的银离子需用2.50mLNH4SCN滴定至终点。预先知道滴定20.00mLAgNO3溶液需要19.85mLNH4SCN溶液。试计算(l)AgNO3溶液的浓度;(2)NH4SCN溶液的浓度。
解:(1)作用于0.1357gNaCl所需AgNO3溶液体积为  ,
,
AgNO3溶液的浓度为 
(2)NH4SCN溶液的浓度为 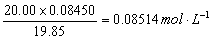
17.100mL 0.0300mol·L-1 KCl 溶液中加人0.3400g 固体硝酸银。求此溶液中的pCl及pAg。
解:100mL溶液中AgNO3的浓度 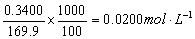
Ag+和Cl-反应后生成0.0200mol·L-1的AgCl沉淀。 此时[Cl-1] = 0.01 mol·L-1, pCl = 2.0
[Ag+] = (Ksp,AgCl) /[Cl-1] = 1.56×10-10/0.01=1.56×10-8 mol·L-1, pAg = 7.9
18.将0.1159mol·L-lAgNO3溶液30.00mL加人含有氯化物试样0.2255g的溶液中,然后用3.16mL 0.1033mol·L-lNH4SCN溶液滴定过量的AgNO3。计算试样中氯的质量分数。
解:生成AgCl的质量为 (0.1159×30.00 - 0.1033×3.16)×143.3 = 451.5mg
试样中氯的质量分数为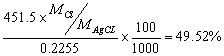
19.仅含有纯NaCl及纯KCl的试样0.1325g,用0.1032mol·L-1AgNO3标准溶液滴定,用去AgNO3溶液21.84mL。试求试样中NaCl及KCl的质量分数。
解:生成AgCl的质量为 0.1032×21.84×143.3 = 323.0mg
设试样中NaCl和KCl 的质量分别为x g和y g, x + y = 0.1325
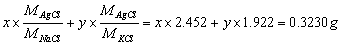
得:x = 0.1289g,试样中NaCl的质量分数为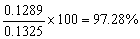
试样中KCl的质量分数为2.72%。
20.称取一定量的约含52%NaCl和44%KCl的试样。将试样溶于水后,加人0.1128mol.L-1AgNO3溶液30.00mL。过量的AgNO3需用10.00mL标准NH4SCN溶液滴定。已知1.00mL标准NH4SCN相当于1.l5mLAgNO3。应 称取试样多少克?
解:生成AgCl的质量为 0.1128×(30.00-10×1.15)×143.3 = 299.0mg
应称取试样质量为xg, x = 0.14g
x = 0.14g
21.己知试样中含Cl- 25% ~ 40%。欲使滴定时耗去0.1008mol·L-1AgNO3溶液的体积为25~45mL,试求应称取的试样量范围。
解:最小试样量 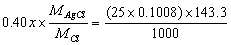 得 x = 0.2233g
得 x = 0.2233g
最大试样量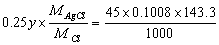 得 y = 0.6432g
得 y = 0.6432g
22.称取含有NaCl和NaBr的试样0.5776g,用重量法测定,得到二者的银盐沉淀为0.4403g;另取同样质量的试样,用沉淀滴定法测定,消耗0.1074mol·L-lAgNO3溶液25.25mL。求NaCl和NaBr的质量分数。
解:设试样中NaCl和NaBr的质量分别为 x g和 y g,
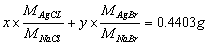

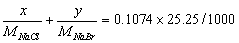

得 x = 0.0909g 试样中NaCl的质量分数 15.73%
y = 0.1191g 试样中NaBr的质量分数 20.63%
23.某混合物仅含NaCl和NaBr。称取该混合物0.3177g,以0.1085mol·L-lAgNO3溶液滴定,用去38.76mL。求混合物的组成。
解:设试样中NaCl和NaBr的质量分别为 x g 和 y g, x + y = 0.3177g
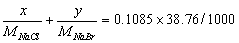
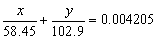
得:x = 0.1513g 试样中NaCl的质量分数 47.62%
y = 0.1664g 试样中NaBr的质量分数 52.38%
24.将12.34L的空气试样通过H2O2溶液,使其中的SO2转化成H4SO4,以0.01208mol·L-1 Ba(ClO4)2溶液7.68mL滴定至终点。计算空气试样中SO2的质量和 l L空气试样中SO2的质量。
解:SO2~ SO4-2~Ba2-,空气试样中SO2的质量 0.01208×7.67×MSO2 = 5.943mg
l L空气试样中SO2的质量为 5.943/12.34 = 0.4816 mg·L-1
25.某化学家欲测量一个大水桶的容积,但手边没有可用以测量大体积液体的适当量具,他把420gNaCl放人桶中,用水充满水桶,混匀溶液后,取100.0mL所得溶液,以0.0932mol·L-1AgNO3溶液滴定,达终点时用去28.56mL。该水桶的容积是多少?
解:NaCl 溶液浓度为 
水桶的容积为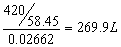
26.有一纯KIOx,称取0.4988g,将它进行适当处理,使之还原成碘化物溶液,然后以0.1125mol·L-1AgNO3溶液滴定,到终点时用去20.72mL,求 x 值。
解:纯KIOx的物质的量为 0.1125×20.72 = 2.331 mmol
KIOx的相对分子量 M = 0.4988/0.002331=214 39.098+126.9+15.999x = 214 得x = 3
27.有一纯有机化合物C4H8SOx,将该化合物试样174.4mg进行处理分解后,使S转化为SO42-,取其1/10,再以0.01268mol·L-1Ba(ClO4)2溶液滴定,以吸附指示剂指示终点,达终点时,耗去11.54mL,求 x 值。
解:纯有机化合物C4H8SOx的物质的量为 0.01268×11.54×10 = 1.463 mmol
纯有机化合物C4H8SOx的分子量为 174.4/1.463 = 119.2
其组成:12.01×4 +1.008×8 +32.07+15.999x = 119.2 得 x = 2
28.0.2018gMCI2试样溶于水,以28.78mL 0.1473mol·L-1AgNO3溶液滴定,试推断M为何种元素?
解:MCI2的物质的量为 (28.78×0.1473)/2 = 2.120 mmol
MCI2的分子量为 0.2018/0.00212 = 95.19 M 的原子量为 95.19-70.9 = 24.29
M原子量与Mg相当,M = Mg
